芦丁对冷藏猪肉糜脂肪和蛋白氧化及品质特性的影响
2016-12-02贾娜王乐田邵俊花李儒仁宋立刘登勇
贾娜,王乐田,邵俊花,李儒仁,宋立,刘登勇
(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
芦丁对冷藏猪肉糜脂肪和蛋白氧化及品质特性的影响
贾娜*,王乐田,邵俊花,李儒仁,宋立,刘登勇
(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
研究不同浓度(0、0.05、0.1和0.2 g/kg)的多酚物质芦丁对冷藏猪肉糜的抗氧化效果及其对肉糜品质特性的影响,并以0.2 g/kg叔丁基羟基茴香醚(butylhydroxyanisole,BHA)作为对照,测定了硫代巴比妥酸值(TBARS值)、总巯基含量、羰基含量、表面疏水性以及猪肉糜的色泽、蒸煮损失和质构特性。结果表明:芦丁对TBARS生成、总巯基损失、表面疏水性的增加具有一定的抑制作用,但对羰基含量不具有抑制作用,且高浓度芦丁反而促进了羰基氧化产物的生成;芦丁能提高肉糜红度值,减少蒸煮损失,并能提高熟肉糜的硬度和弹性等质构特性。因此,适量的芦丁对抑制猪肉脂肪和蛋白氧化以及改善其品质特性具有较好的作用。
芦丁;猪肉糜;脂肪氧化;蛋白氧化;肉糜品质
脂肪氧化和蛋白氧化是影响肉及肉制品品质的2个重要因素,其中脂肪氧化易导致产生有害物质和腐败臭味[1]。而自由基和脂肪氧化产物能导致蛋白氧化,如可促使蛋白中的巯基基团交联损失,形成复杂的羰基化合物,从而降低蛋白质的溶解度,减弱蛋白凝胶等功能性质[2]。目前,防止肉制品中脂肪和蛋白质氧化的方法很多,其中添加抗氧化剂是最有效的办法之一。人工合成抗氧化叔丁基羟基茴香醚(BHA),2,6-二叔丁基羟基甲苯(BHT)等被常应用于肉及肉制品生产中来防止脂肪和蛋白氧化。近年来,人工合成抗氧化剂对人体具有不利影响相继被报道[3],因此,在肉及肉制品中使用天然抗氧化剂成为必然趋势。
天然抗氧化剂多是从植物中提取出来的酚类物质,可降低脂肪和蛋白质的氧化程度。据研究表明,葡萄籽提取物、茶多酚、苹果多酚等对肉及肉制品具有较好的抗氧化作用[4-5]。芦丁(芸香叶苷、槲皮素-3-O-芸香糖苷)是广泛存在于芦笋、橙子、柚子等植物的黄酮糖苷类化合物[6],其结构是由槲皮素碳环上C-3位置结合鼠李糖和葡萄糖2个二糖分子构成的[7]。据研究表明,芦丁有降低高血压、抗炎、抗氧化、抑制癌症等功效[8]。近年来,芦丁逐渐被用于食品抗氧化研究中,如对牛肉脂肪氧化的抑制作用以及对果汁抗氧化稳定性的影响等相继被研究[2,9]。因此,本研究将不同含量的芦丁添加到肉糜中,通过测定TBARS值、总巯基含量、羰基含量、表面疏水性、色差、蒸煮损失、质构特性,来研究芦丁对猪肉糜脂肪和蛋白质的抗氧化作用及其对肉糜品质特性的影响,并对相关机理进行探讨。
1 材料与方法
1.1 材料与试剂
猪背最长肌、肥膘,购于当地超市;丁基羟基茴香醚(BHA),购自国药试剂公司;芦丁,购自Sigma化学公司(美国);MgCl2、NaH2PO4、乙二胺四乙酸二钠、氯仿、甲醇、NaCl等试剂均为国产分析纯。
1.2 仪器及设备
Allegra 64R冷冻离心机,美国Beckman公司;FE20 pH计,梅特勒-托利仪器(上海)有限公司;T25数显型均质机,德国IKA集团;UV2550紫外-可见光分光光度计,日本Shimadzu公司; TA-XT2i质构仪 英国Stable Micro Systems公司;电子分析天平PL203型,梅特勒-托利仪器(上海)有限公司;CR-400色差仪,柯尼卡美能达光学有限公司。
1.3 实验方法
1.3.1 实验预处理
1.3.1.1 肉糜制作方法
基本配方为70%猪背最长肌、10%肥膘、18%水和2%NaCl。用绞肉机将猪肉绞碎后,按比例分为5个处理组,第1组为空白组,即不添加任何抗氧化剂,第2~4组分别添加0.05、0.1和0.2 g/kg芦丁,第5组添加0.2 g/kg BHA。混匀后,将肉糜制成50 g重的肉饼,直径约7 cm,厚度约1 cm,每3个肉饼放入1个包装盒(CT盒)中,用保鲜膜封好,置于4 ℃冰箱冷藏,分别在第1、3、6和9天测定各项指标。
1.3.1.2 蛋白质提取方法
肌原纤维蛋白提取按照PARK[12]的方法进行,称取适量的猪肉糜加入4倍体积的冰冷提取液(10 mmol/L磷酸缓冲溶液,含100 mmol/L NaCl、2 mmol/L MgCl2和1 mmol/L EDTA,pH为7.0),匀浆60 s后,冷冻离心15 min(3 500 r/min,4 ℃)。取沉淀,再重复提取2次。去上清液,得到粗肌原纤维蛋白,然后用4倍体积冷冻的洗液(100 mmol/L NaCl)重复清洗3次。最终用4层纱布过滤,用0.1 mol/L HCl调节pH为6.0,然后再冷冻离心15 min(3 500 r/min,4 ℃)后,去上清液。称重后放置4 ℃条件下冷藏,并在24 h内用完。蛋白质浓度用双缩脲法测定,牛血清蛋白作为标准蛋白。
1.3.2 TBARS值的测定
参照JONGBERG等[11]的方法,并做适当修改。准确称取绞碎的猪肉糜5 g,加入15 mL 7.5 % TCA-0.1 %焦性没食子酸-0.1 % EDTA混合溶液,均质60 s(11 000 r/min),冷冻离心5 min(3 500 r/min)后分别过滤,加2.5 mL TBA溶液(0.02 mol/L)于装有2.5 mL滤液的试管中,然后沸水浴反应50 min显色,冷却后在532 nm处测定吸光值。TBARS值的计算表示为每千克肉样品中所含的丙二醛的毫克数,计算公式如下:
(1)
式中:A,吸光度;V,样品体积,mL;M,丙二醛的分子质量72.063,g/mol;ε,摩尔吸光系数156 000,L/(mol·cm);1,光程1,cm;m,肉样质量,kg。
1.3.3 总巯基测定
总巯基测定方法按照YANG[12]方法并加以修改。量取1 mL 5 mg/mL蛋白质溶液和8 mL Tris-甘氨酸溶液(其中包括10.4 g/LTris,0.9 g/L甘氨酸,1.2 g/L EDTA,8 mol/L尿素,pH 8.0)置于塑料离心管中。均质后,高速冷冻离心15 min(10 000 r/min,4 ℃),除去不溶性蛋白。然后准确量取4.5 mL上清液,加入0.5 mL Ellman试剂,混匀,在室温下放置30 min后,在412 nm处测定其吸光度。使用分子吸光系数13 600 L/(mol·cm)计算蛋白中总巯基的含量。
1.3.4 羰基含量
1.3.5 表面疏水性
参照CHENH[14]的方法,将肌纤维蛋白溶于pH 7.0的20 mmol/L磷酸缓冲溶液,使蛋白液浓度为5 mg/mL,取1 mL蛋白溶液加入200 μL的1 mg/mL溴酚蓝(BPB),混匀,室温下搅拌10 min,然后在6 000 r/min的条件下离心15 min,取上清液稀释10倍,在595 nm波长处测定吸光值,对照组为无蛋白溶液添加的磷酸盐缓冲溶液。表面疏水性可用以下公式表示:
(2)
1.3.6 肉糜颜色的测定
使用色差仪测定肉糜颜色,先将色差仪进行校正,将肉样放置于自然光充足的平面上,垂直将色差仪置于肉糜至上,镜面紧扣肉面(不漏光),随机在每个样品3个不同的位置测定数据,分别得到L*、a*和b*,将3次测量值的平均数作为色差读数。
1.3.7 肉糜的蒸煮损失
准确称取重为m1的均匀肉糜,填装到50 mL塑料离心管中,然后低速离心去除肉糜中的气泡,然后将肉样置于85 ℃水浴锅中,蒸煮30 min,蒸煮后冷却至室温,用吸水纸吸干水分,然后称肉糜质量为m2。称完后,放在4 ℃环境中保存。蒸煮损失计算公式为:

(3)
1.3.8 熟肉糜的质构分析
对1.3.7中所制熟肉糜,切取直径为2 cm,高度为1 cm的柱状样品。质构仪参数设定为:P50铝合金探头;使用TPA模式,二次挤压循环;测前速度测前速度2 mm/s,测中速度1 mm/s,测后速度1 mm/s,间隔时间5 s,数据收集率200点/s,压缩比50%,触发力5.0 kg,每组6个平行,重复3次。测试完后使用仪器附带的TA-XT EXPRESS软件获取质构参数。
1.4 统计分析
每个试验重复3次,结果表示为(平均值±标准差)(X±SD)。数据统计分析采用SPSS 19.0软件中的Linear Models程序进行处理,差异显著性(P<0.05)分析采用Tukey HSD程序。作图使用Sigmaplot 11.0软件。
2 结果与分析
2.1 芦丁对猪肉糜TBARS值的影响
脂肪氧化程度用TBARS值来表示。如图1所示,从贮藏第1至9天时,所有肉糜组的TBARS值均逐渐增加,其中空白组的TBARS值由0.07 mg/kg依次显著增加至0.18、0.39和0.86 mg/kg(P<0.05),说明贮藏时间越长,肉糜中脂肪氧化程度愈严重。从图中还可以看出,贮藏期间芦丁组肉糜的TBARS值一直显著低于空白组(P<0.05),说明芦丁能显著抑制肉糜脂肪氧化,减少氧化产物的生成。
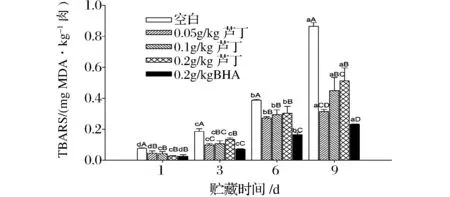
图1 芦丁对冷藏中猪肉糜的TBARS值的影响Fig.1 Effect of rutin on the TBARS of porcine patties during chilled storage注:小写字母a-d为同一处理组的不同冷藏时间之间比较,大写字母A-D为不同处理组之间比较。下同。
DEJONG等[15]研究表明,多酚物质对脂肪和蛋白的抗氧化作用取决于其苯环上羟基的位置和数量,其中芦丁B环C-4位置上的羰基与A环C-5位置上的羟基对自由基有较强的猝灭作用,能有效抑制脂肪氧化。贮藏第9天时,0.05 g/kg芦丁组肉糜的TBARS值显著低于0.2 g/kg芦丁组(P<0.05),并与0.2 g/kg BHA组的TBARS值差异不显著(P>0.05),说明低浓度的芦丁对脂肪氧化的抑制效果更好,且其抗氧化效果与BHA相当。芦丁在高浓度(200 μmol/L)时有促氧化的作用,其可能的原因是适量的芦丁与自由基相结合减少脂肪氧化,而多余的芦丁A环上7-OH可以形成超氧自由基和过氧化合物,反而促进脂肪的氧化[16]。因此,芦丁对猪肉糜的脂肪的抗氧化效果与其添加量有关,合适的浓度将有利于降低肉及肉制品中的脂肪氧化程度。
2.2 芦丁对猪肉糜总巯基含量的影响
蛋白质氧化变性是一个复杂的过程,其中半胱氨酸是敏感氨基酸,其巯基易被自由基攻击而氧化成二硫键,导致总巯基含量减少,故总巯基的损失可用来评估蛋白质氧化程度[17]。如图2所示,随贮藏时间的延长,各处理组的总巯基含量均呈不同程度的降低。
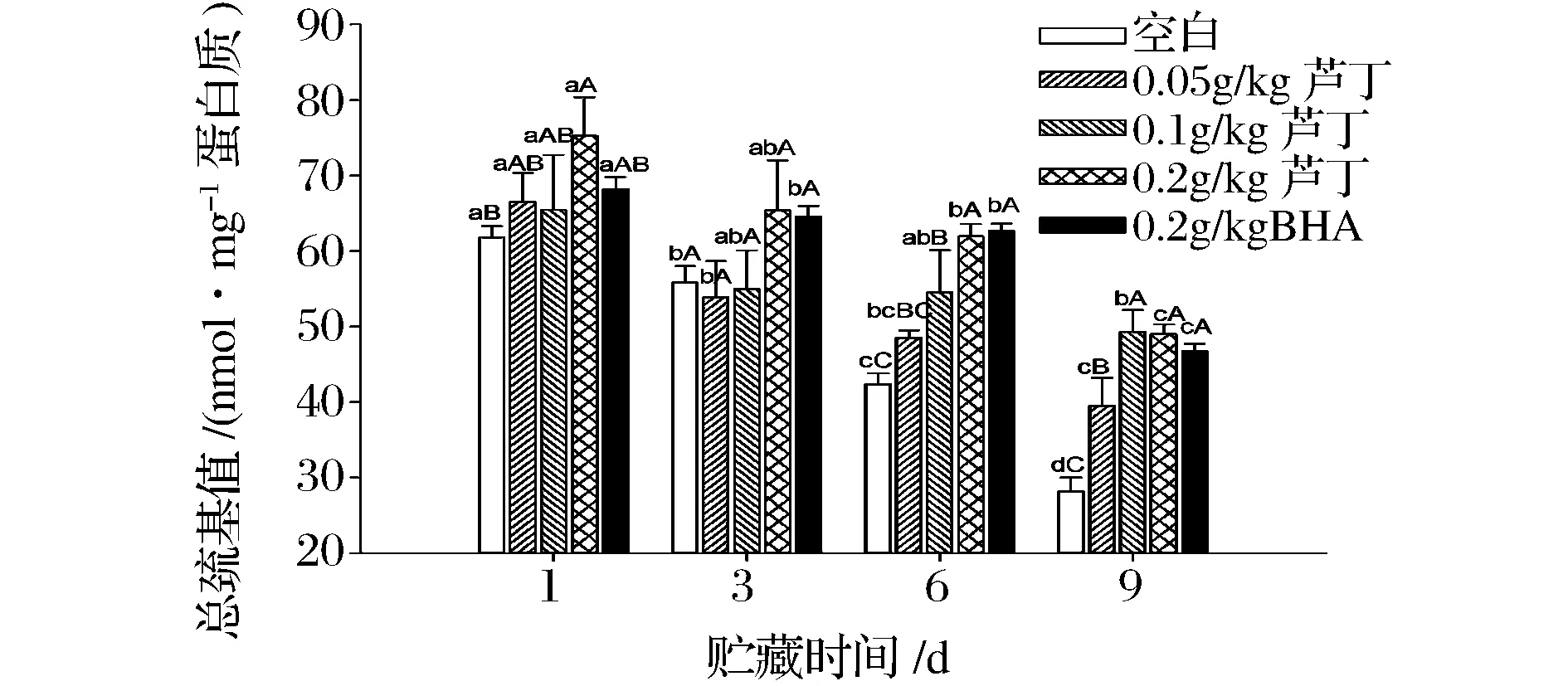
图2 芦丁对冷藏中猪肉糜的总巯基值的影响Fig.2 Effect of rutin on the total sulfhydryl of porcine patties during chilled storage
贮藏9 d后,空白组巯基含量由61.81 nmol/mg显著下降至28.13 nmol/mg(P<0.05),而0.05、0.1和0.2 g/kg芦丁处理组的下降幅度均低于空白组;尤其第9 d时,0.05、0.1和0.2 g/kg芦丁处理组的总巯基量显著高于空白组(P<0.05),且0.1和0.2 g/kg添加量效果较为明显,说明芦丁对猪肉糜总巯基损失具有一定的抑制作用,且浓度越高,巯基含量越高,其损失程度越低,这可能是由于较高浓度的芦丁可充分防止自由基攻击蛋白质,抑制蛋白质结构变化。但是,有研究发现,低浓度的迷迭香提取物能有效抑制猪肉糜的巯基损失,而高浓度的添加促使多酚与巯基之间共价结合成巯基醌加成物,反而促进了巯基的损失[18],这与本研究结果不一致,说明不同的多酚与蛋白质之间的作用不同,其对蛋白结构的影响也不同。且贮藏第9天时,0.1和0.2 g/kg芦丁处理组的总巯基含量与BHA相比,并无显著差异(P>0.05),说明芦丁对蛋白巯基保护作用与BHA相类似,可能是由于芦丁分子结构中的多酚羟基与自由基相互作用,防止自由基攻击蛋白结构,从而保护蛋白质巯基免受损失。
2.3 芦丁对猪肉糜羰基含量的影响
蛋白质羰基化合物是通过氨基酸侧链氧化而形成的,是蛋白质氧化综合作用的结果,能够代表蛋白质的氧化程度[19],羰基含量越高,蛋白质氧化越严重。芦丁对猪肉糜羰基化合物含量的影响见图3,随着贮藏时间的延长,空白组前3 d羰基含量增加不显著(P>0.05),说明贮藏初期蛋白氧化程度并不高,而到第6、9天时,羰基含量分别显著上升至2.81、2.91 nmol/mg(P<0.05),说明贮藏后期蛋白氧化加剧。第1、3和6天时,芦丁处理组的羰基含量与空白组差异并不显著(P>0.05),并且0.2 g/kg芦丁处理组的羰基含量略高于空白组;而到第9天时,0.1和0.2 g/kg芦丁处理组羰基含量显著高于空白组(P<0.05)。以上结果说明,芦丁不具有抑制蛋白羰基的作用,且高浓度芦丁能促进蛋白羰基的生成,加剧猪肉糜蛋白质氧化程度。ESTÉVEZ等[20]研究了芦丁、没食子酸、绿原酸、槲皮素和染料木素等多酚对蛋白氧化的影响,其中只有芦丁对蛋白质羰基化合物的生成具有促进作用,这与本研究的结果相类似。UTRERA等[21]证实槲皮素的抗氧化性得益于它位于B环上的3,4-OH二羟基基团和C环上的3-OH结构,可有效清除自由基,防止自由基攻击蛋白质,抑制蛋白羰基化合物生成。而芦丁则是由槲皮素与芸香糖苷相结合而成,其A环位置上的7-OH能促进过氧化合物的形成,多余的芦丁物质产生过多的过氧化氢,促进肉糜脂肪氧化和蛋白质羰基的生成[22];故高浓度芦丁比低浓度含量更容易促进蛋白羰基化合物的生成。DEJONG等[2]研究证实由于槲皮素上的3-OH的糖基化形成芦丁,致使芦丁对蛋白质抗氧化活性降低了50%。

图3 芦丁对冷藏中猪肉糜的羰基值的影响Fig.3 Effect of rutin on the carbonyl of porcine patties during chilled storage
2.4 芦丁对猪肉糜蛋白质表面疏水性的影响
表面疏水性可以反映蛋白质分子表面疏水氨基酸的相对含量,其含量的变化可看做蛋白质结构变化的一个重要参数。溴酚蓝可以与蛋白质疏水氨基酸相结合,其结合量可用来表示表面疏水性的大小。由图4可知,蛋白质的表面疏水性随贮藏时间的延长而增大,贮藏至第9天时,空白组由59.32 μg显著上升至142.21 μg(P<0.05),说明贮藏时间越长,蛋白氧化程度加剧,促使蛋白结构解折叠,蛋白内部的疏水氨基酸暴露,从而使蛋白表面疏水性增加[23]。在第1、3天时,空白组与芦丁处理组之间均无显著差异(P>0.05);而第6、9天时,0.05 g/kg芦丁处理组的表面疏水性显著低于空白组(P<0.05),而高浓度芦丁抑制表疏水性增加的效果不如0.05 g/kg芦丁,说明低浓度的芦丁对肌原纤维蛋白氧化具有一定的抑制作用。ZHAO等[24]研究发现0.2%和0.3%茶多酚的处理可以很好的抑制大黄鱼肌原纤维蛋白表面疏水性的增加,更好地保护蛋白质不受氧化破坏。

图4 芦丁对冷藏中猪肉糜中表面疏水性的影响Fig.4 Effect of rutin on the surface hydrophobicity of porcine patties during chilled storage
2.5 芦丁对肉糜颜色的影响
颜色是肉制品一个重要的品质,是影响消费者购买的主要因素之一。L*值表示肉糜表面的亮度值,a*值表示红度值,其中a*值主要取决于肉中肌红蛋白的数量和氧化程度。如图5(a)和5(b)所示,随贮藏时间的增加,各处理组肉糜的L*和a*值均呈下降趋势,L*值不断下降是由于肉糜表面水分损失,肉糜表面亮度变暗,a*不断下降主要是由于肌红蛋白被氧化成高铁肌红蛋白[25]。而贮藏期间,芦丁处理组的L*值与空白组均差异不显著(P>0.05),说明芦丁对肉糜亮度的影响不大。由图6(b)可知,贮藏至第9天,0.05、0.1、0.2 g/kg芦丁和0.2 g/kgBHA处理组的a*值均显著高于空白组(P<0.05),说明芦丁可以抑制肌红蛋白的氧化,防止肉糜a*值的下降,效果与BHA相当。且研究表明,芦丁作为一种具有抗氧化活性的多酚,与肉糜中氧合肌红蛋白竞争脂质过氧化基,阻止肌红蛋白氧化,从而减缓贮藏中肉糜中a*值的下降速度[26]。
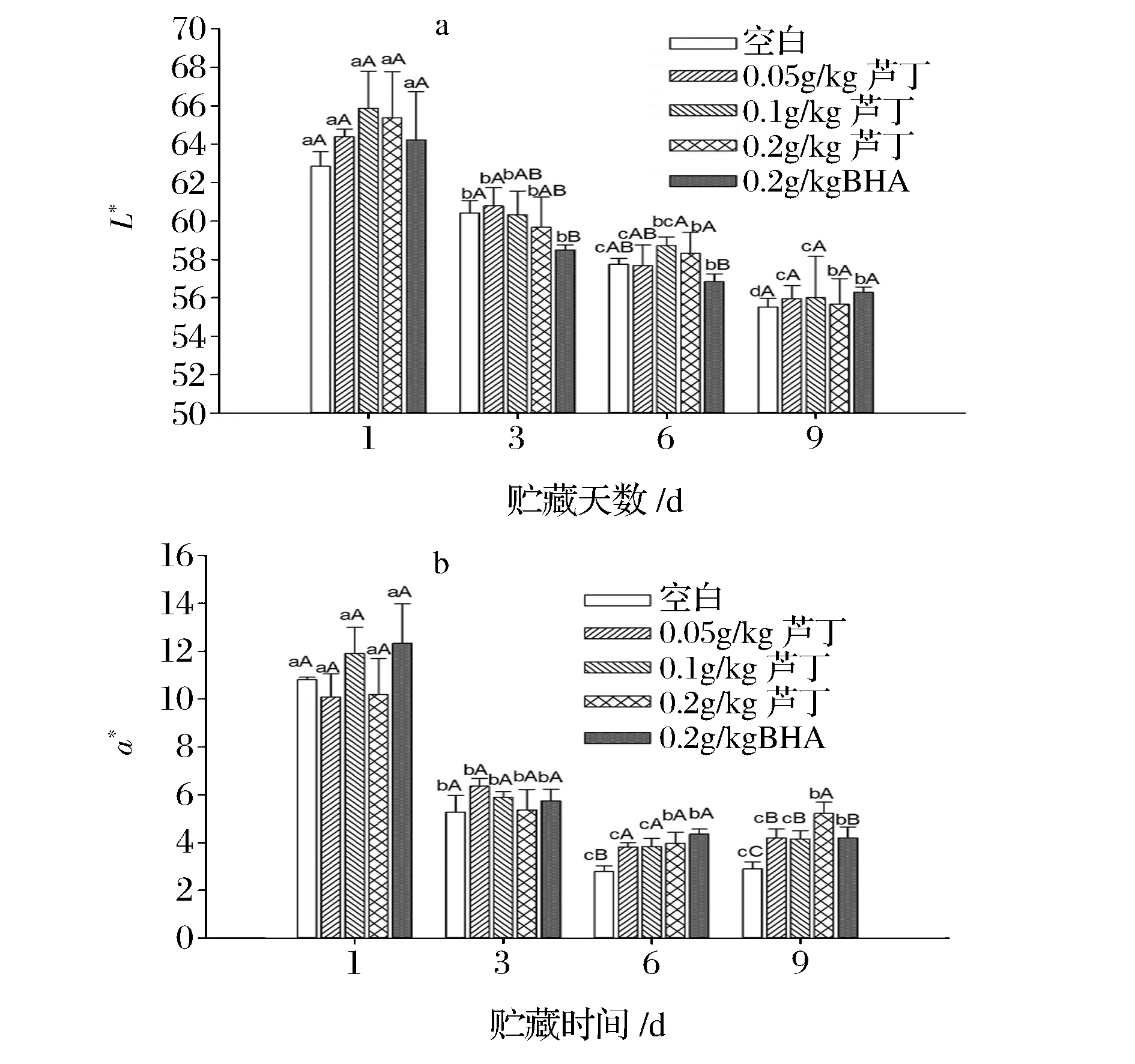
a: L*值; b: a*值图5 芦丁对冷藏中猪肉糜颜色的影响Fig.5 Effect of rutin on the color of porcine patties during chilled storage
2.6 芦丁对猪肉糜蒸煮损失的影响
肉的蒸煮损失与其系水能力息息相关,能影响肉制品的加工产量,还可以影响肉的颜色、嫩度、质地、口感和风味等食用品质。由图6可得,随着贮藏时间的增加,猪肉糜的蒸煮损失不断增加。余小领等[27]研究表明,肉糜冷藏时间越长,蒸煮损失越大,从而减少了肉制品的出品率。由空白组可知,贮藏第1~3天时,蒸煮损失显著增加了4.46%(P<0.05);随后贮藏至第9天,蒸煮损失仍逐渐增加,但差异不显著(P>0.05)。贮藏前6 d时,各芦丁处理组的蒸煮损失各不相同,相互之间差异并不显著(P>0.05),且与空白相比无显著差异(P>0.05),说明在贮藏前期不同浓度的芦丁对蒸煮损失影响并不明显;贮藏至第9天时,芦丁组的蒸煮损失低于空白组,尤其是0.1 g/kg处理组显著低于空白组(P<0.05),说明芦丁在一定程度上可以抑制肉糜蒸煮损失,增加加工过程中肉糜的系水能力,尤其是贮藏后期效果更为明显。这可能是由于芦丁促进肌原纤维蛋白中肌动蛋白、肌球蛋白和肌动球蛋白等相互之间聚合,形成稳定可靠的凝胶网络,从而增加肉糜的系水能力[28]。值得注意的是,BHA处理组的蒸煮损失始终低于空白组和芦丁组,说明芦丁与肉糜相互作用后对蒸煮损失的抑制效果不如BHA。
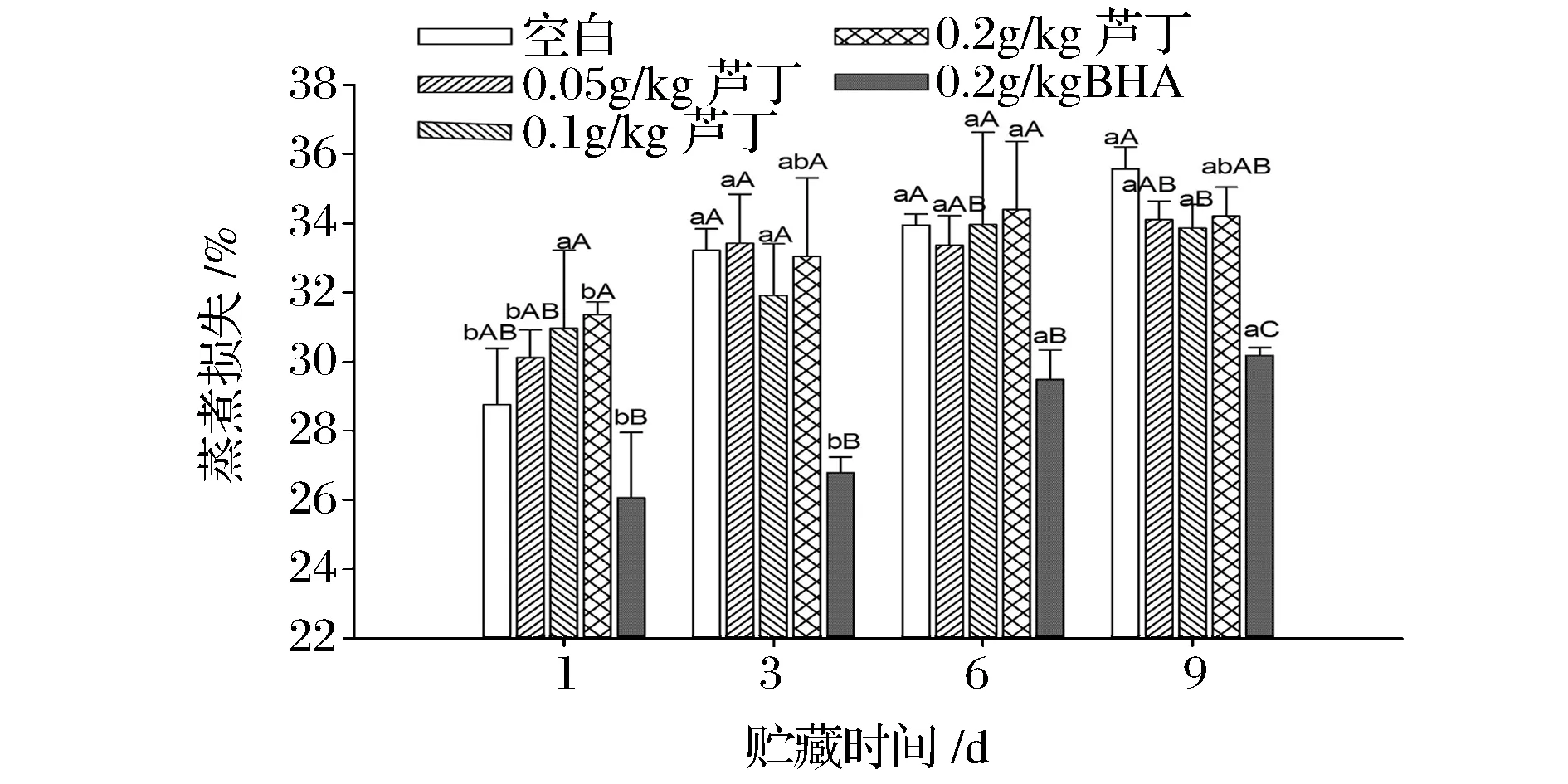
图6 芦丁对冷藏中猪肉糜蒸煮损失的影响Fig.6 Effect of rutin on cooking loss of porcine patties during chilled storage
2.7 芦丁对猪肉糜质构的影响
猪肉糜的质构特性主要是从硬度、弹性、咀嚼度和回复性等4个参数来研究。由表1可知,空白组的硬度随时间增加而不断降低,至贮藏第9天,硬度下降至最低值,且显著低于贮藏前期(P<0.05)。从第1~6天空白组弹性随时间增加呈下降趋势,差异变化不显著(P>0.05),原因可能是贮藏时间长,脂肪和蛋白氧化加剧,蛋白质发生变性或降解,从而导致肉糜硬度和弹性下降。随贮藏时间增加,芦丁组的硬度和弹性值呈现先增加后下降的趋势,均在第6天达到最大值,且在第6~9天时,芦丁组的硬度显著高于空白组(P<0.05),出现此种现象的原因可能是芦丁能够抑制蛋白的氧化变性,并且与蛋白质发生共价或非共价结合,形成稳定的网络结构,使贮藏前期肉糜的硬度和弹性不断增加;随贮藏时间增加,贮藏后期由于环境中的微生物腐败和氧化加剧,两者之间的相互作用力减弱,组织化结构断裂,使肉糜贮藏后期的硬度和弹性下降[29-30]。BHA处理组的硬度和弹性随时间增加呈上升趋势,其结果说明BHA能较好地抑制猪肉糜氧化作用,维持猪肉糜的组织结构,尤其在贮藏后期比芦丁作用效果更明显。而咀嚼度和回复性随时间增加也均呈先增加后降低的趋势,但由表1可看出,芦丁处理组的咀嚼度和回复性总体上高于空白组,说明芦丁对猪肉糜贮藏的质构特性具有一定的改善作用。
3 结论
芦丁对猪肉糜的脂肪氧化具有较好的抑制作用,能有效减少蛋白巯基的损失,防止疏水氨基酸残基的暴露,并能保持猪肉糜的颜色,减少蒸煮损失,提高肉糜的硬度、弹性和咀嚼度等食用品质,但芦丁不具有抑制羰基氧化产物增加的作用,且高浓度芦丁促进了羰基氧化产物的生成。综合看来,0.1 g/kg芦丁添加量最为合适,能有效抑制脂肪和蛋白氧化,同时可改善猪肉糜的食用品质,且其作用效果与BHA相当。因此,芦丁可作为一种有效的抗氧化剂,但要选择合适的浓度应用于肉制品中,才能起到抑制肉制品脂肪和蛋白氧化以及有效改善品质特性的作用。
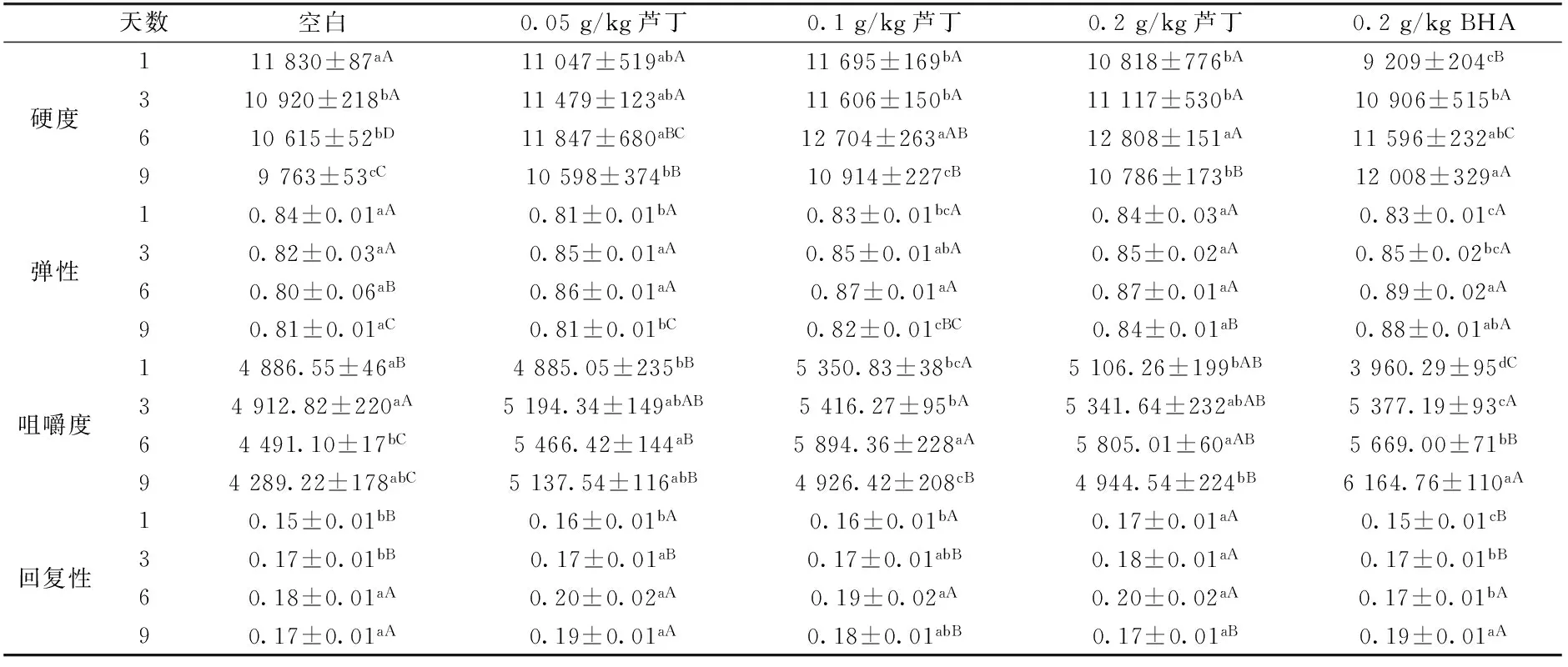
表1 芦丁对冷藏中熟猪肉糜质构的影响
[1] FALOWO A B, FAYEMI P O, MUCHENJE V. Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products: A review[J]. Food Research International, 2014, 64: 171-181.
[2] DEJONG S, LANARI M C. Extracts of olive polyphenols improve lipid stability in cooked beef and pork: Contribution of individual phenolics to the antioxidant activity of the extract[J]. Food chemistry, 2009, 116(4): 892-897.
[3] BOTTERWECK A A M, VERHAGEN H, GOLDBOHM R A, et al. Intake of butylated hydroxyanisole and butylated hydroxytoluene and stomach cancer risk: results from analyses in the Netherlands cohort study[J]. Food and Chemical Toxicology, 2000, 38(7): 599-605.
[4] KULKARNI S,DESANTOS F A, KATTAMURI S, et al. Effect of grape seed extract on oxidative, color and sensory stability of a pre-cooked,frozen, re-heated beef sausage model system[J]. Meat Science, 2011, 88(1): 139-144.
[5] ÖZVURAL E B, VURAL H. Grape seed flour is a viable ingredient to improve the nutritional profile and reduce lipid oxidation of frankfurters[J]. Meat Science, 2011, 88(1): 179-183.
[7] NGUYEN T A, LIU B, ZHAO J, et al. An investigation into the supramolecular structure, solubility, stability and antioxidant activity of rutin/cyclodextrin inclusion complex[J]. Food Chemistry, 2013, 136(1): 186-192.
[8] ZHANG Z L, ZHOU M L, TANG Y, et al. Bioactive compounds in functional buckwheat food[J]. Food Research International, 2012, 49(1): 389-395.
[10] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1 239-1 246.
[11] JONGBERG S, TØRNGREN M A, GUNVIG A, et al. Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3): 538-546.
[12] YANG H, MENG P, XIONG Y L, ET AL. Oxidation in HiOx-packaged pork Longissimus muscle predisposes myofibrillar and sarcoplasmic proteins to N-nitrosamine formation in nitrite-curing solution[J]. Meat Science, 2013, 95(3): 465-471.
[14] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[15] DEJONG S, LANARI M C. Extracts of olive polyphenols improve lipid stability in cooked beef and pork: Contribution of individual phenolics to the antioxidant activity of the extract[J]. Food Chemistry, 2009, 116(4): 892-897.
[16] KESSLER M, UBEAUD G, JUNG L. Anti- and pro-oxidant activity of rutin and quercetin derivatives[J]. Pharm. Pharmacol,2003,55:131-142.
[17] ESTÉVEZ M, KYLLI P, PUOLANNE E, et al. Fluorescence spectroscopy as a novel approach for the assessment of myofibrillar protein oxidation in oil-in-water emulsions[J]. Meat Science, 2008, 80(4): 1 290-1 296.
[18] NIETO G, JONGBERG S, ANDERSEN M L, et al. Thiol oxidation and protein cross-link formation during chill storage of pork patties added essential oil of oregano, rosemary, or garlic[J]. Meat Science, 2013, 95(2): 177-184.
[19] CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food chemistry, 2015, 180: 235-243.
[20] ESTÉVEZ M, KYLLI P, PUOLANNE E, et al. Oxidation of skeletal muscle myofibrillar proteins in oil-in-water emulsions: interaction with lipids and effect of selected phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10 933-10 940.
[21] UTRERA M, ESTÉVEZ M. Impact of trolox, quercetin, genistein and gallic acid on the oxidative damage to myofibrillar proteins: The carbonylation pathway[J]. Food Chemistry, 2013, 141(4): 4 000-4 009.
[22] KESSLER M, UBEAUD G, JUNG L. Anti-and pro-oxidant activity of rutin and quercetin derivatives[J]. Journal of Pharmacy and Pharmacology, 2003, 55(1): 131-142.
[23] 李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13):70-74.
[24] ZHAO J, LV W, WANG J, et al. Effects of tea polyphenols on the post-mortem integrity of large yellow croaker (Pseudosciaena crocea) fillet proteins[J]. Food Chemistry, 2013, 141(3): 2 666-2 674.
[25] 梁成云, 刘笑笑, 孟令丽, 等. 日粮 VE水平对熟化过程中牛肉肉色和抗氧化酶活性的影响[J]. 食品科学, 2008, 29(8): 61-64.
[26] 刘立山,刘婷,石磊,等. 日粮中添加牛至精油改善牛肉熟化过程中的肉品质[J].食品工业科技,网络出版时间:2015-09-18,网络出版地址:http://www.cnki.net/kcms/detail/11.1759.TS.20150918.1538. 024.html
[27] 余小领, 周光宏, 李学斌, 等. 不同宰后时间冷冻对肉糜质量的影响[J]. 食品科学, 2008, 29(12): 202-205.
[28] YANG H, HAN M, WANG X, et al. Effect of high pressure on cooking losses and functional properties of reduced-fat and reduced-salt pork sausage emulsions[J]. Innovative Food Science & Emerging Technologies, 2015, 29: 125-133.
[29] SUREL O, FAMELART M H, L. Heat induced gelation of acid milk: balance between weak and covalent bonds.[J]. Journal of Dairy Research, 2003, 70(70):253-256.
[30] 倪晨, 杨铭铎,霍力. 大豆组织蛋白的处理工艺及在肉制品中的应用[J]. 哈尔滨商业大学学报:自然科学版, 2002, 18(3):336-340.
Effect of rutin on lipid/protein oxidation and quality of minced pork during chilled storage
JIA Na*, WANG Le-tian, SHAO Jun-hua, LI Ru-ren, SONG Li, LIU Deng-yong
(College of Food Science and Technology, Bohai University; Food Safety Key Lab of Liaoning Province; National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products; Jinzhou 121013, China)
The inhibitory effect of different concentrations of rutin (0, 0.05, 0.1 and 0.2 g/kg meat) on pork patties and quality were investigated during chilled storage. The pork patties with 0.2 g/kg butylated hydroxyanisole (BHA) were used as control group. The thiobarbituric acid value (TBARS), total sulfhydryl content, carbonyl content, surface hydrophobicity, color, cooking loss and texture characteristics were determined. The results indicated that rutin has some inhibitory effect on the formation of TBARS, thiol loss and surface hydrophobicity. But rutin has no inhibitory effect on protein carbonyl, especially the higher concentration increased the protein carbonyl content. The color, cooking loss, hardness and elasticity of meat were improved by Rutin. Therefore, appropriate amount of rutin had a better effect on inhibition of lipid and protein oxidation and improved the quality properties of minced pork.
rutin; minced pork; lipid oxidation; protein oxidation; quality of minced pork
10.13995/j.cnki.11-1802/ts.201610018
博士,副教授(本文通讯作者,E-mail:jiana_2010@163.com)。
国家自然科学青年基金(31301509);辽宁省食品安全重点实验室开放课题(LNSAKF2013014)
2016-02-16,改回日期:2016-03-23
