优良饲用乳酸菌的筛选及在模拟消化环境中的耐受性
2016-12-02王彦萍熊涛黄涛廖良坤
王彦萍,熊涛,黄涛,廖良坤
(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047)
优良饲用乳酸菌的筛选及在模拟消化环境中的耐受性
王彦萍,熊涛*,黄涛,廖良坤
(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047)
通过MRS培养基进行初筛,耐酸耐胆盐复筛,从乳猪粪便中筛选出能够应用于饲料中的优良乳酸菌。MRS初筛得到26株乳酸菌疑似菌株,在pH2.0和3 g/L胆盐的MRS培养复筛得到7株菌,对性能较好的菌株G1和G9进行生理生化及分子生物学鉴定:G1为植物乳杆菌(NCU156)、G9为戊糖片球菌(NCU301)。进一步研究NCU156的耐酸耐胆盐性能以及模拟动物消化道耐受性能。结果表明:NCU156在pH2.5的MRS培养基中,作用4 h存活率为87.31%;在胆盐质量浓度为3 g/L的培养基中,作用6 h活菌数下降不到一个数量级;在pH3.0的人工胃液中作用4 h,NCU156的活菌数稍有增加,在3 g/L胆盐的人工肠液中作用6 h,活菌数下降约一个数量级(1.81×109~1.27×108CFU/mL),活菌数仍保持在108CFU/mL以上。可见NCU156对动物胃肠道有良好的耐受性,在饲料产品中有很好的应用前景。
筛选;鉴定;植物乳杆菌NCU156;耐酸;耐胆盐;消化环境
20世纪90年代为了防治仔猪腹泻,我国开始引入饲用抗生素。随着抗生素的长期使用,因药物残留、抗药性、环境污染等问题给人和动物的健康带来诸多危害[1-3]。寻找绿色、安全的抗生素替代品成为国内外研究的热点。益生菌制剂、中草药、酶制剂、抗菌肽为常见的抗生素替代品[4-5]。益生菌制剂无毒副作用、绿色安全、效果好、成本低,具有其他添加剂无法相比的优点[6-7]。我国《饲料添加剂品种目录》中批准使的微生物主要有芽孢杆菌、乳酸菌、酵母菌、霉菌等,乳酸菌是动物肠道正常菌群之一,乳酸菌在肠道内可以通过产生抗菌物质、竞争性粘附肠道生态位、调节肠道环境等作用来维持动物肠道健康[8-9]。本实验从健康野生乳猪粪便中筛选出对低pH环境和高浓度胆盐有较好耐受性的菌株,通过生理生化实验、分子生物学手段进行鉴定,研究了其耐酸耐胆盐能力,并对该菌株在模拟动物胃肠道环境中的生存能力进行考察,为该菌株运用于饲料添加提供依据。
1 材料与方法
1.1 样品
野生乳猪粪便。
1.2 培养基
MRS培养基:采用GB 4789.35—2010《食品微生物学检验乳酸菌检验》[10]方法配置。
初筛培养基:于固体MRS培养基中加入0.04%的溴甲酚紫。
复筛培养基:(1)用盐酸将MRS液体培养基的pH值调至3.0;(2)在MRS液体培养基中加入3 g/L的猪胆盐。
1.3 试剂
HCl(分析纯),西陇化工股份有限公司;NaOH(分析纯),天津市大茂化学试剂厂;猪胆盐,广州市齐云生物技术有限公司;胃蛋白酶(酶活力 1∶10 000),美国Sigma公司;胰蛋白酶(酶活力1∶250),美国Amresco公司;过氧化氢酶(酶活力2 000~5 000 u/mg),美国 Sigma公司。
人工胃液[11]:NaCl(125 mmol/L)、KCl(7 mmol/L)、NaHCO3(45 mmol/L)和胃蛋白酶(3 g/L),用HCl将溶液pH调至3.0,用0.20 μm的微孔滤膜过滤除菌。
人工肠液[12]:胰蛋白酶(1g/L)、猪胆盐(3 g/L),用NaOH调pH至7.5,过滤除菌。
1.4 仪器与设备
YXQ-LS-50SⅡ/75SⅡ立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;Airtech 生物安全柜,苏净集团安泰公司;DNP-9272型生化培养箱,上海精宏实验设备有限公司;FE-28型pH计,梅特勒-托利多仪器(上海)有限公司;XSZ-4G生物光学显微镜,重庆光电仪器有限公司;Mastercycler Ep PCR仪,Eppendorf AG;TG16-W微量高速离心机,湖南湘仪实验室仪器开发有限公司;DYY-6C型电泳仪,北京六一仪器厂。
1.5 实验方法
1.5.1 乳酸菌的初筛
将采集到的新鲜样品置于MRS液体培养基中,37 ℃下富集培养24 h,采用十倍梯度稀释法,涂布于初筛平板上,37 ℃培养24 h,挑取黄色包围圈较大的菌落进行划线分离。
1.5.2 耐酸耐胆盐复筛
将初筛得到的菌株于MRS液体培养基中活化24 h,按3%的接种量接种于pH 2.0或含有3 g/L胆盐的MRS培养基中培养4 h,进行乳酸菌平板计数。
1.5.3 菌株形态学及生理生化鉴定
对复筛得到菌株的菌落形态、颜色、菌落边缘等特征进行观察并记录,将菌株进行革兰氏染色,在显微镜下观察菌体形状、大小。选取革兰氏染色阳性菌株进行糖发酵实验、硫化氢实验、接触酶实验。
1.5.4 分子生物学鉴定
对待鉴定菌株进行DNA提取,以其基因组DNA为模板,使用细菌16S rRNA通用引物进行PCR,PCR条件参照熊涛等的方法[13]。对PCR得到的产物进行琼脂糖凝胶电泳检测,成功扩增的产物送样测序,将测序结果与NCBI数据库中的序列进行同源性比对,同时利用MEGA6.0软件构建系统发育树,确定待测菌株的分类。
1.5.5 酸耐受性实验
用HCl将液体MRS培养基的pH调至2.5、3.5、4.5,121 ℃灭菌20 min待用。将菌株于37 ℃条件下活化24 h,取3 mL菌液进行离心(4 500 r/min,10 min),离心所得菌体用无菌生理盐水洗涤3遍[14],使用上述100 mL MRS液体培养基对菌体进行重悬,pH6.8的MRS液体培养基作为对照,37 ℃培养,使用菌落平板计数法分别于0、1、2、3、4 h进行活菌计数,按(1)式计算存活率。

(1)
1.5.6 胆盐耐受性实验
使用NaOH将MRS液体培养基的pH调至8.0[15],在其中加入猪胆盐,使胆盐终质量浓度分别为1、2、3 g/L,121 ℃灭菌20 min待用。按照1.5.5中的方法接入上述准备好的培养基中,以不添加胆盐的培养基作为对照,37 ℃培养,使用菌落平板计数法分别于0、1、2、3、4 h进行活菌计数,按公式(1)式计算存活率。
1.5.7 人工动物胃肠液耐受性实验
按照1.5.5中的方法获得菌体,将菌体用等体积配制好的人工动物胃液重悬,在摇床上培养模拟胃液的消化作用[16](37 ℃ 80 r/min),4 h后,将人工胃液离心(4 500 r/min,10 min),收集菌体,菌体用等体积的人工动物肠液重悬,按照上述条件培养,每小时取样计算活菌数。
2 结果与分析
2.1 乳酸菌的初筛
在MRS平板上共划线纯化出26株疑似乳酸菌,它们均能不同程度地产生酸性物质,使得加有溴甲酚紫的紫色培养基变为黄色[17]。图1为1株具有很强产酸性能的菌株,图2为此菌株经美蓝染色后在显微镜下的形态。

图1 菌落形态Fig.1 Colonial morphology
图2 美蓝染色(×1000)Fig.2 Basic methylene blue stain
2.2 耐酸耐胆盐复筛
经过复筛后得到7株耐酸耐胆盐性能较好的菌株,如图3所示,其中菌株G1和G9在pH 2.0的培养基中作用4 h后活菌数仍达105以上,在含有3 g/L胆盐的培养基中作用4 h活菌数仍有107以上,选取G1、G9进行生理生化鉴定。

图3 不同菌株在pH2.0和3 g/L胆盐的液体MRS培养基中作用4 h后的活菌数Fig.3 Viable count of different strains in pH2.0 MRS medium or MRS medium with 3 g/L bile salt for 4 h
2.3 菌株形态学及生理生化鉴定
根据形态学及生理生化鉴定结果(见表1和表2)结合《伯杰氏细菌鉴定手册》[18],推断G1可能为乳杆菌属,G2可能为链球菌科中的片球菌属,对这2株菌进行分子生物学鉴定。

表1 形态学鉴定
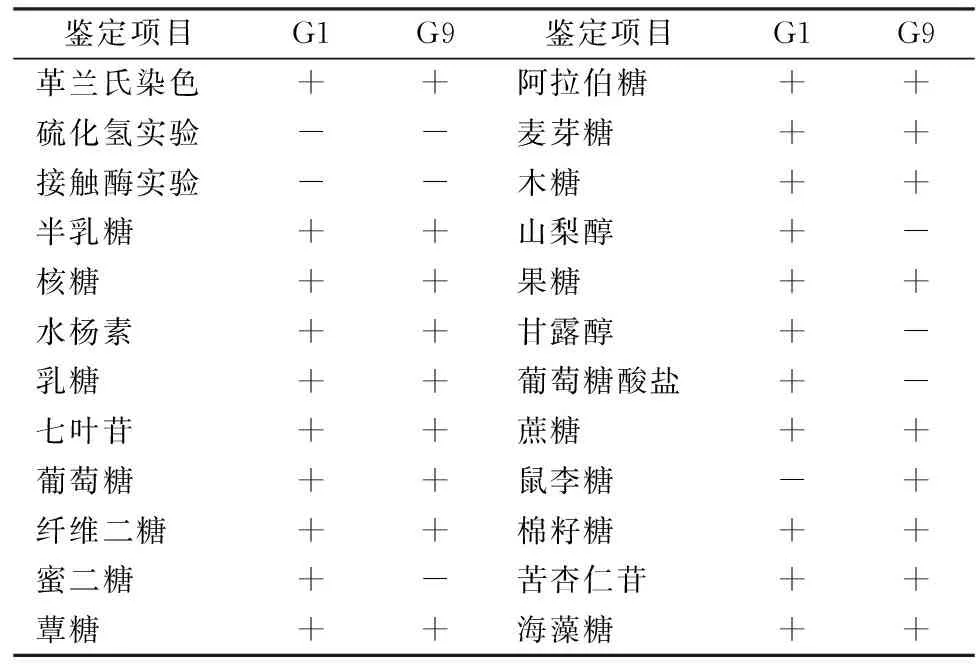
表2 生理生化鉴定
注:+ 表示阳性实验结果;-表示阴性实验结果。
2.4 分子生物学鉴定
将菌株G1和G9的16S rRNA测序结果与NCBI数据库中的微生物序列进行比对,G1与LactobacillusplantarumWCFS1的同源性为97%,G9与PediococcuspentosaceusATCC 25745的同源性也为97%。利用MEGA6.06软件构建系统发育树进行同源性分析,见图4。由图4可知,G1为植物乳杆菌的可信度为99%,G9为戊糖片球菌的可信度为99%,结合,2株菌的形态学、生理生化鉴定,鉴定菌株G1为植物乳杆菌,菌株G9为戊糖片球菌。鉴于菌株G1的产酸能力比G9强,选取G1进行后续实验,G1、G9分别命名为NCU156和NCU301。
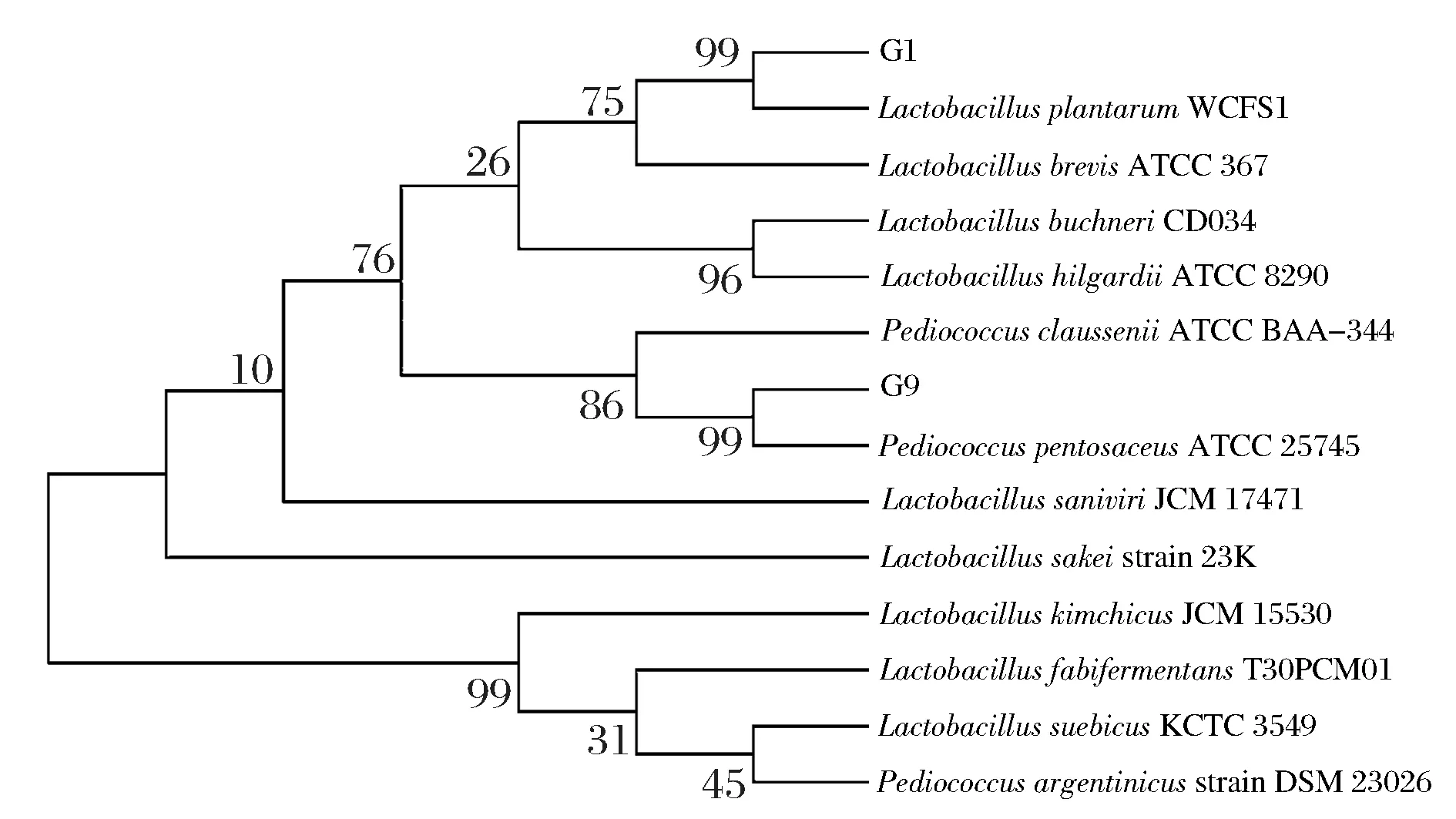
图4 菌株G1和G9的系统发育树Fig.4 Phylogenetic tree of strains G1 and G2
2.5 酸耐受性
在到达肠道末端发挥益生功能之前,乳酸菌必须通过胃液的酸性环境[19],断奶仔猪的胃液pH值在3.1~4.0范围内变化[20],胃完全排空时间为3~5 h[21]。植物乳杆菌NCU156酸耐受性实验结果如图5。
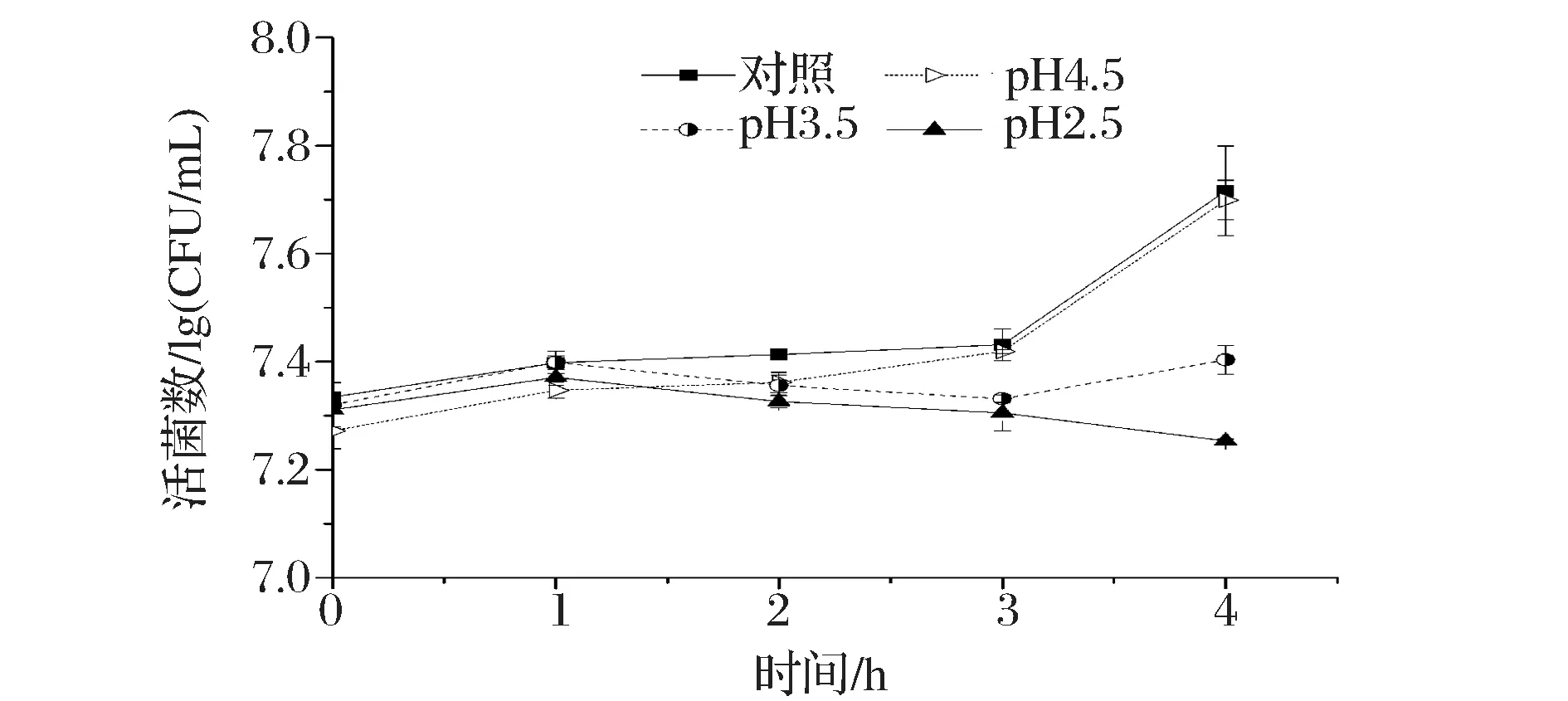
图5 植物乳杆菌NCU156在不同pH下生长情况Fig.5 Growth of L.plantarum NCU156 with different pH values
在pH 4.5的MRS培养基中,植物乳杆菌NCU156的生长情况与对照组中的相似,4 h后活菌数与对照组相比没有显著性差异(P>0.05);在pH 3.5的MRS培养基中作用4 h后,其活菌数呈先下降后上升的趋势,较0 h处显著增加(P<0.05),这说明其能够通过自身的应激反应来抵抗胁迫所造成的危害[22];在pH 2.5的MRS培养基中作用4 h后,活菌数较0 h处显著下降(P<0.05),存活率为87.31%,但活菌数仍在107CFU/mL以上,说明该菌株具有良好的酸耐受性,能够在低pH环境中保持较好的活性。
2.6 胆盐耐受性
乳酸菌在通过胃液到达十二指肠后,必须能够耐受十二指肠中高浓度的胆盐,以活菌的状态到达下消化道[23],仔猪肠道中的胆盐浓度在0.03%~0.3%变化[24]。由图6可知,胆盐对植物乳杆菌NCU156的生长有一定的抑制作用,并且随着胆盐质量浓度的升高抑制作用增强。在胆盐质量浓度分别为1、2 g/L的培养基中,植物乳杆菌NCU156作用6 h后,活菌数出现显著下降(P<0.05),存活率分别为47.78%和21.15%,在作用过程中活菌数的缓慢下降可能是由于胆盐导致细菌细胞膜溶解使菌体内溶物外泄,从而导致细胞死亡[25];在胆盐质量浓度为3 g/L的培养基中,作用4 h的存活率为41.88%,作用6 h活菌数由1.17×107CFU/mL降到1.63×106CFU/mL,下降不到1个数量级,说明此菌对胆盐有一定的耐受性。
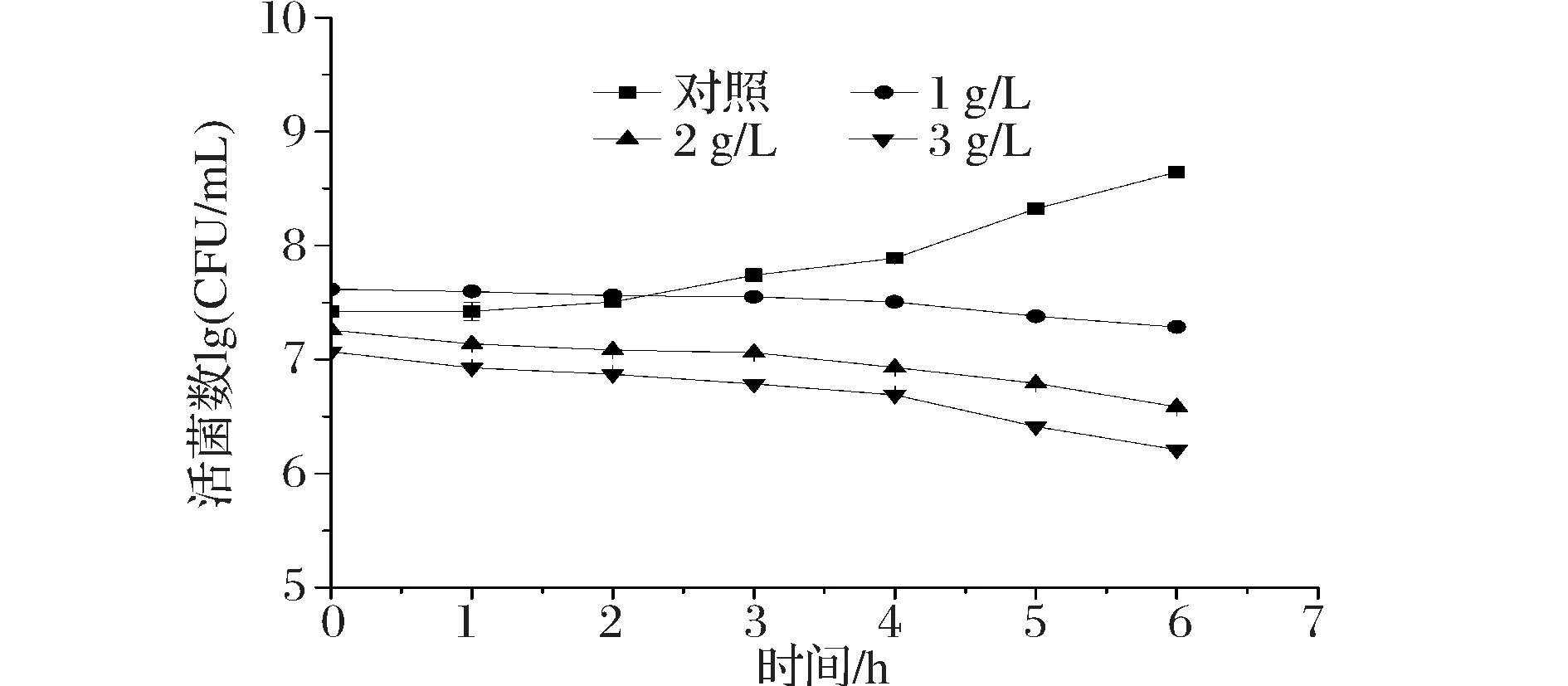
图6 植物乳杆菌NCU156在不同质量浓度胆盐下生长情况Fig.6 Growth of L.plantarum NCU156 with different bile salts concentrations
2.7 人工动物胃肠液耐受性
植物乳杆菌NCU156在人工胃肠液作用下活菌数变化如图7。在人工胃液中作用4 h后,植物乳杆菌NCU156的活菌数稍有增加(P>0.05);在接入人工肠液后,活菌数呈平稳的下降趋势,在前4 h稍有下降(P>0.05),5 h处开始出现明显下降(P<0.05),说明人工肠液中高质量浓度的胆盐和胰蛋白酶对植物乳杆菌NCU156有损伤作用。在人工胃肠液中作用10 h后,植物乳杆菌NCU156的活菌数为108CFU/mL以上,满足乳酸菌在生物体肠道内发挥益生作用的要求[26]。De ANGELIS[11,27]等研究发现,L.plantarum4.1在pH3.0人工胃液作用3 h活菌数稍有下降[10~9.6 lg(CFU/mL)],在人工肠液中3 h下降约2个数量级,并对其进行了动物饲养实验,发现L.plantarum4.1顺利通过了胃肠道并发挥了益生作用。与L.plantarum4.1相比植物乳杆菌NCU156具有更强的耐酸耐胆盐性能,可见植物乳杆菌NCU156具有很好的抗胃肠道逆环境能力。
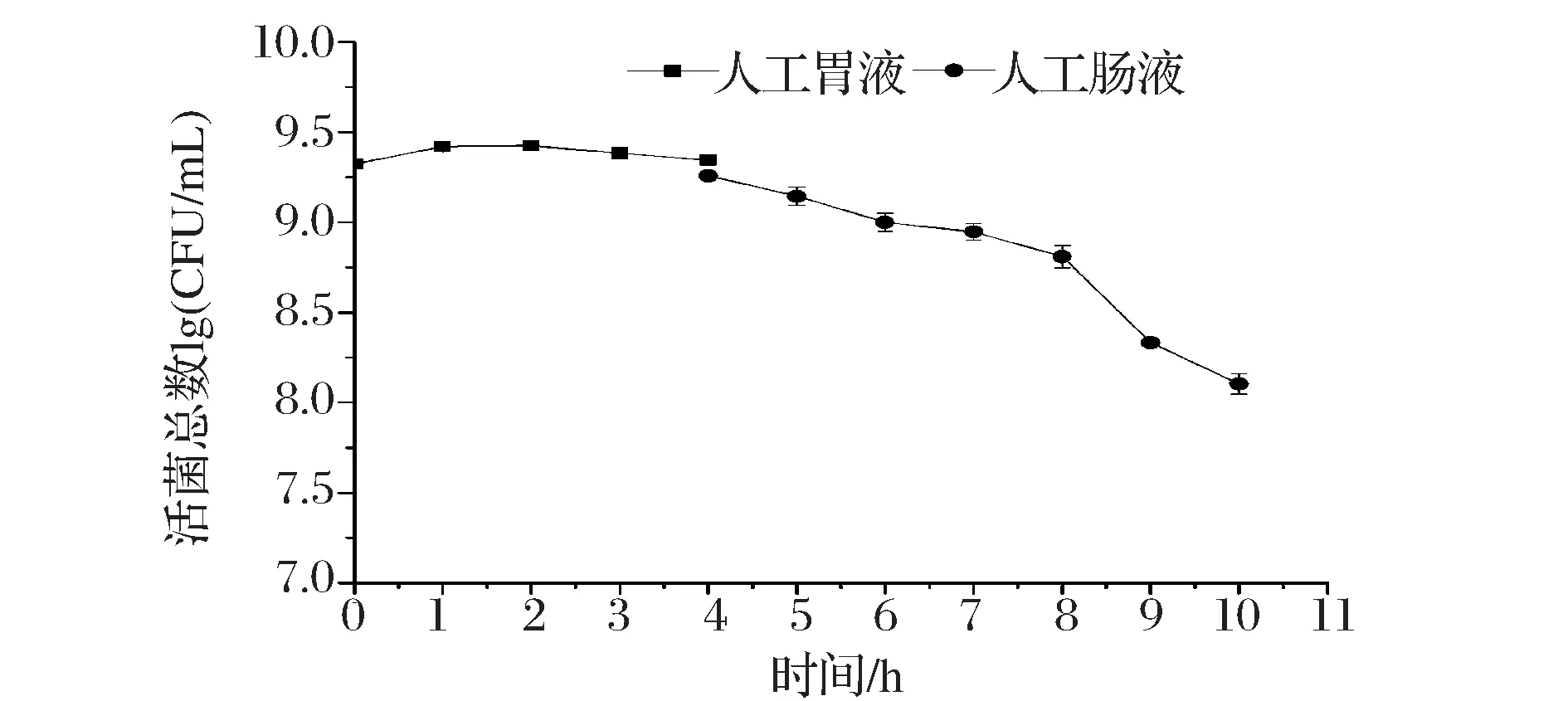
图7 植物乳杆菌NCU156在人工动物胃肠液中生长情况Fig.7 Growth of L.plantarum NCU156 in artifical animal gastric and intestinal fluids
3 结论
乳酸菌是饲料微生物制剂中常用的菌种之一,利用MRS作为初筛培养基,经过耐酸耐胆盐复筛、生理生化鉴定及分子生物学鉴定后,确定NCU156为植物乳杆菌。菌株NCU156具有良好的酸耐受性,在pH 2.5的MRS培养基中作用4 h后,存活率为87.31%。植物乳杆菌NCU156有一定的耐胆盐性能,在胆盐质量浓度为3 g/L的培养基中作用6 h,活菌数下降不到1个数量级。在人工胃肠液中作用10 h后,植物乳杆菌的活菌数为108CFU/mL以上,可见植物乳杆菌NCU156对人工动物胃肠液有较好的耐受性,可抗胃肠道逆环境。因此,本实验中植物乳杆菌NCU156在应用于饲料添加剂中有一定的潜力。
[1] 胡远亮.利用分子生物学技术研究益生菌对断奶仔猪生长及粪便菌群的影响[D].武汉:华中农业大学,2014:6-8.
[2] 王长彦.微生物发酵饲料替代饲用抗生素技术在商品猪生产中的应用研究[D].咸阳:西北农林科技大学,2008:4-5.
[3] BARTON M D.Antibiotic use in animal feed and its impact on human healt[J].Nutrition Research Reviews,2000,13(2): 279-299.
[4] 杜银峰.几种饲用抗生素替代品对肉鸡生长消化和免疫性能的影响[D].扬州:扬州大学,2013:6-16.
[5] 刘炜.绿色饲料添加剂在肉鸡健康养殖中的应用[D].南京:南京农业大学,2006:7-21.
[6] 王冬梅,耿晓娜,赵宝华.饲用微生态制剂的应用研究进展[J].畜牧与饲料科学,2010,31(2):54-56.
[7] KANMANI P, SATISH KUMAR R, YUVARAJ N, et al. Probiotics and its functionally valuable products—A review[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(6): 641-658.
[8] SLEATOR R D. Designer probiotics: Development and applications in gastrointestinal health[J]. World Journal of Gastrointestinal Pathophysiology, 2015, 6(3): 73.
[9] 王芳芳,刁华杰,夏九龙,等.乳酸菌及其发酵饲料在动物生产中的应用[J].饲料研究,2016(1):15-19.
[10] GB 4789.35—2010 食品微生物学检验乳酸菌检验[S].
[11] DE ANGELIS M, SIRAGUSA S, BERLOCO M, et al. Selection of potential probiotic lactobacilli from pig feces to be used as additives in pelleted feeding[J]. Research in Microbiology, 2006, 157(8): 792-801.
[12] GUO Xiao-Hua,LI De-Fa,LU Wen-Qing,et al.Screening ofBacillusstrains as potential probiotics and subsequent confirmation of theinvivoeffectiveness ofBacillussubtilisMA139 in pigs[J]. Antonie Van Leeuwenhoek,2006,90(2):139-146.
[13] 熊涛,唐晓星,黄涛,等.产蛋白酶兼性厌氧菌株的筛选, 酶学性质及发酵豆粕应用探究[J].食品科学,2014,35(9):162-167.
[14] CEBECA A,GURAKAN C.Properties of potential probioticLactobacillusplantarumstrains[J].Food Microbiology,2003,20(5): 511-518.
[15] 熊涛,刘妍妍,黄涛,等.副干酪乳杆菌NCU622耐酸耐胆盐及其黏附性能[J].食品科学,2015,36(5):20.
[16] FUCHSR L,REAMJ E, HAMMOND B G,et al.Safety assessment of the neomycin phosphotransferase II (NPTII) protein[J].Bio Technology,1993,11(13):1 543-1 547.
[17] CROFTS A R,JACKSON J B.Bromothymol blue and bromocresol purple as indicators of pH changes in chromatophores ofRhodospirillumrubrum[J]. European Journal of Biochemistry,1969,10(2):226-237.
[18] R.E.布坎南, N.E.吉本斯等编.伯杰细菌鉴定手册第八版[M].中国科学院微生物研究所,译.科学出版社,1984:797-934.
[19] BARMPALIA-DAVIS I M,GEORNARAS I, KENDALL P A, et al. Differences in survival among 13Listeriamonocytogenesstrains in a dynamic model of the stomach and small intestine[J]. Applied and Environmental Microbiology, 2008, 74(17): 5 563-5 567.
[20] GARDINER G E, CASEY P G, CASEY G, et al. Relative ability of orally administeredLactobacillusmurinusto predominate and persist in the porcine gastrointestinal tract[J]. Applied and Environmental Microbiology, 2004, 70(4): 1 895-1 906.
[21] 周其家, 朱翔宇. 仔猪消化环境与营养代谢调节剂的应用[J]. 畜牧兽医科技信息, 2011 (5): 56-57.
[22] DUARY R K, BATISH V K, GROVER S. Expression of theatpD gene in probioticLactobacillusplantarumstrains underinvitroacidic conditions using RT-qPCR[J]. Research in Microbiology, 2010, 161(5): 399-405.
[23] 胡斌.植物乳杆菌胆盐耐受性评价及内在影响因素[D].无锡:江南大学,2015:3-5.
[24] 李琳琳,王雅婷,杨欣,等.猪源乳酸菌的分离及其生物学特性研究[J].西北农林科技大学学报,2016,44(2):1-7.
[25] RUIZL, MARGOLLES A, SANCHEZ B. Bile resistance mechanisms inLactobacillusandBifidobacterium[J]. Frontiers in Microbiology.2013, 4(396). doi:10.3389/fmicb,2013.00396.
[26] ISHIBASHIN, SHIMAMURA S. Bifidobacteria: research and development in Japan[J]. Food Technology, 1993, 47(6): 126-135.
[27] DE ANGELIS M, SIRAGUSA S, CAPUTOL, et al. Survival and persistence ofLactobacillusplantarum4.1 andLactobacillusreuteri3S7 in the gastrointestinal tract of pigs[J]. Veterinary Microbiology, 2007, 123(1): 133-144.
Screening of forage lactic acid bacteria with good tolerance to stimulated animal digestive environments
WANG Yan-ping,XIONG Tao*,HUANG Tao,LIAO Liang-kun
(State Key Laboratory of Food Science and Technology, Nanchang University,Nanchang 330047,China)
Twenty six strains were isolated from fresh litter feces using MRS broth. Seven strains with high tolerance to MRS broth (pH2.0) and MRS broth with 3g/L bile salt were further screened out. Strains G1 and G9 with better properties were respectively identified asLactobacillusplantarumandPedicoccuspentosaceusby morphology, biochemical characteristics and molecular biology identification. Furthermore, the tolerance of NCU156 to acid and bile salt was studied. The animal digestive environments were simulated. The result showed that survival rate of NCU156 was 87.31% after 4h incubation in MRS (pH2.5). After incubation in MRS with 3 g/L bile salt for 6h, the viable count of NCU156 reduced less than an order of magnitude. The viable count increased slightly after incubation in the artificial gastric fluid with pH3.0 for 4h. The number of NCU156 reduced about an order of magnitude, but still above 108CFU/mL after 6 h in artificial intestinal fluid.L.plantarumNCU156 had excellent tolerance to simulated animal digestive environments and had potential to be used in pellet feed.
screening; identification; acid tolerance; bile tolerance; gastrointestinal circumstance
10.13995/j.cnki.11-1802/ts.201610010
硕士研究生(熊涛教授为通讯作者,E-mail:xiongtao0907@163.com)。
江西省主要学科学术和技术带头人培养计划(20133BCB22001);江西省重大科技专项计划(赣财教字[2014]104号);"赣鄱英才555工程"领军人才培养计划(赣才字[2013]2号)
2016-04-18,改回日期:2016-05-05
