5-ALA-PDT法在HPV11.HaCaT细胞模型中的应用
2016-12-02宋莎莎李新宇王永芳
宋莎莎 孙 洋 李新宇 王永芳
·论著·
5-ALA-PDT法在HPV11.HaCaT细胞模型中的应用
宋莎莎 孙 洋 李新宇 王永芳
目的: 确定光动力疗法(5-ALA-PDT)对携带HPV11全基因组的HaCaT细胞(HPV11. HaCaT)模型的影响。方法: HPV11.HaCaT细胞培养传代后分别用不同浓度5-ALA(0.375、0.75、1.5、3 mM),或不同剂量红光(10、20、40 J/cm2),或不同浓度5-ALA结合不同剂量红光处理。用MTT法检测细胞增殖,实时荧光定量PCR测定HPV11早期基因E5、E6和E7mRNA的表达。结果: 0.75mM以上浓度的5-ALA联合20或40 J/cm2红光,细胞存活率均在50%以下(P<0.01)。0.375mM 5-ALA联合20 J/cm2红光能明显降低HPV11 E6和E7mRNA表达,相对表达量为0.28和0.26(P<0.01),而0.75mM 5-ALA联合20 J/cm2红光处理对HPV11 E6和E7mRNA表达影响不明显,相对表达量为0.85和1.46(P>0.05),但以上两种处理条件对HPV11 E5 mRNA的表达均无明显影响。结论: 5-ALAPDT法应用于HPV11.HaCaT细胞模型能抑制HPV11.HaCaT细胞增殖,并能降低该细胞中HPV11 E6、E7mRNA的表达。
HPV11.HaCaT; 尖锐湿疣; 光动力疗法; 细胞增殖; 早期基因
人乳头瘤病毒(Human papilloma virus,HPV)是在鳞状上皮复制的双链环状DNA病毒,可通过与感染皮肤接触传播。根据HPV致恶性程度的不同,分为高危型(如 HPV16、HPV18等)和低危型(如HPV6、HPV11等)两类。因高危型HPV的致癌性,基础和临床研究较多,相对而言低危型HPV的研究较少。尖锐湿疣(Condyloma acuminatum,CA)是我国性传播疾病中位居第三位的疾病[1],主要由低危型HPV(90%以上为HPV6/11)感染引起,以皮肤、黏膜部位出现疣状增生性病变为特征。目前临床上CA的治疗主要通过激光、冷冻、手术或局部用药,以去除肉眼所见的疣体为主,而直接针对病原体本身的抗HPV药物尚无,这亦是HPV潜伏感染以及CA容易复发的原因之一。由于HPV高度的种属特异性以及其生长周期与宿主细胞分化状态的密切相关性,迄今为止,HPV不能在动物体成功接种和生长,也无法在体外组织培养系统中繁殖,这是制约HPV深入研究以及抗HPV药物研发的重要因素。近年来,随着细胞和分子生物学技术的发展,已经出现了数种含高危型HPV的转化细胞系或人工构建的细胞模型供研究者应用,而因为低危型HPV的E6、E7基因不具备转化活性和永生化能力,病毒基因在体外宿主细胞中较难稳定维持,因此低危型HPV的体外感染模拟系统研究的较少。本课题组在以往研究中成功构建了携带HPV11全基因组的HaCaT角质形成细胞(HPV11. HaCaT)[2],并证明在一定传代次数以及冻存、复苏后,细胞中HPV11游离型基因组稳定维持,病毒基因能正常复制和表达[3,4],且经raft培养后证实所构建的重组细胞系统能支持HPV11的完整生命周期[5]。为了进一步探讨所构建的HPV11.HaCaT细胞作为抗HPV11药效学模型应用的可能性,我们亦采用了有治疗CA线索的药物或化合物进行了初步尝试并获得了相应的结果[4]。本研究中我们将通过5-氨基-4 -酮戊酸盐介导的光动力疗法(aminolevulinicaid photodynamic therapy,5-ALA-PDT)在HPV11.HaCaT细胞模型上的应用,观察它对携带病毒基因组细胞生长增殖的影响,以及对HPV11早期基因E5、E6和E7 mRNA表达的影响,以进一步考证HPV11.HaCaT细胞作为药效学模型应用的可行性,5-ALA-PDT在临床上已用于治疗CA,并取得明显疗效[6]。
1 材料和方法
1.1 材料 HPV11.HaCaT细胞由本实验室在前期研究中通过环化HPV11全长DNA后经脂质体转染至HaCaT角质形成细胞中构建而成[2]。DMEM培养基(美国Gibco公司)。新生牛血清(浙江天杭生物科技股份有限公司)。5-ALA(上海复旦张江生物医药股份有限公司,含量100.0%,批号140401)。四甲基偶氮唑盐(MTT,美国Sigma公司)。Trizol(美国Invitrgen公司)。PrimeScriptTMRTMaster Mix(日本TaKa-Ra公司)。PCR引物(上海生工生物工程有限公司合成,具体序列见表1)。SYBR®Select Master Mix(美国Applied Biosystems公司)。细胞培养板(美国Corning公司)。7300型实时荧光定量PCR仪(美国Applied Biosystems公司)。酶联免疫检测仪(Thermo公司)。LED治疗仪(LEB-IB,武汉亚格光电技术有限公司)。M92C型激光功率测试仪(北京光电技术研究所)。
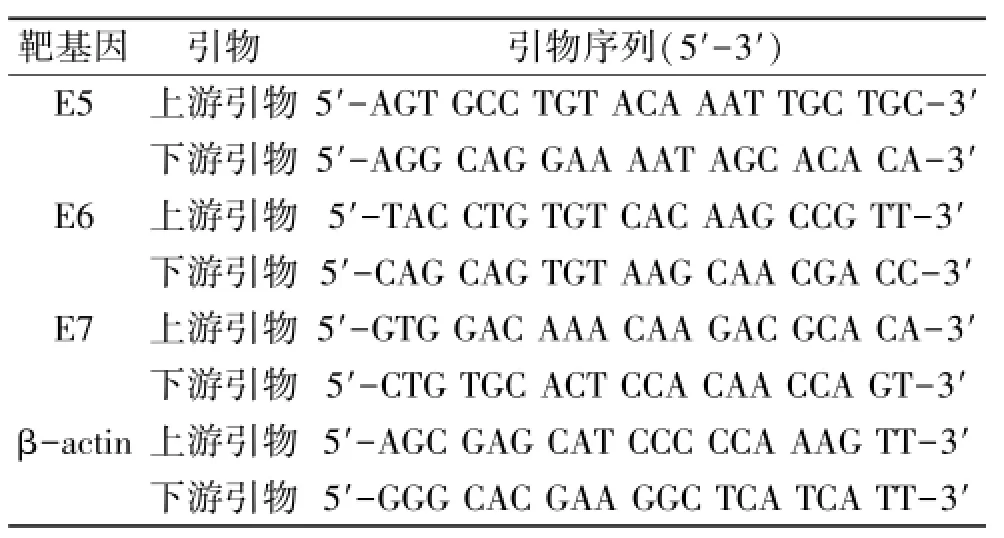
表1 荧光PCR引物序列
1.2 细胞培养与传代 HPV11.HaCaT细胞培养于含10%新生牛血清DMEM中,37℃、5%CO2培养箱生长。细胞达80%融合时用含0.02%EDTA的0.25%胰酶消化,用培养基调整为2×104/孔密度接种96孔细胞培养板,或按1×106/孔接种6孔板,培养过夜。
1.3 分组及处理 分为空白组(无任何处理)、单纯5 -ALA(0.375、0.75、1.5、3 mM)处理组、单纯红光(10、20、40 J/cm2)处理组、不同浓度5-ALA分别结合不同剂量红光处理组。细胞培养24 h后吸除培养基,按设定的分组加入用2%新生牛血清DMEM培养基配制的不同浓度5-ALA,避光培养24 h,用无菌PBS漂洗1次,加入少量PBS后接受不同剂量红光照射。照射完毕后去除孔内PBS,加入含10%新生牛血清的DMEM培养基继续培养24 h。
1.4 MTT法检测细胞增殖 培养结束后,96孔板加5mg/mLMTT液,20μL孔,继续培养4 h,弃培养基,加入150μL/孔DMSO,避光震荡混匀15 min使蓝紫色沉淀充分溶解,在酶标仪下以550 nm波长测定吸光度。
1.5 荧光定量PCR检测HPV11E5、E6和E7 mRNA表达 用Trizol提取细胞总RNA。将总RNA反转录为第1链cDNA,得到的cDNA进行实时荧光定量PCR测定。扩增体系为cDNA 1.5μL,上下游引物各0.8μL,SYBR®Select Master Mix 10μL,无核酶水6.9 μL,总体积为20μL。扩增条件为50℃2 min;95℃2 min;95℃15 s,58℃15 s,72℃1min,40个循环,并添加熔解曲线以确保扩增产物的特异性。每个样品设3个复孔,同时设内参(β-actin)对照,结果通过△△Ct法分析。
1.6 统计学方法 采用SPSS 17.0统计软件对数据进行统计分析,数据以¯x±s表示,P<0.01为差异有统计学意义。
2 结果
2.1 5-ALA-PDT应用后对HPV11.HaCaT细胞增殖的影响 单纯给予0.375、0.75、1.5、3 mM 5-ALA后,HPV11.HaCaT细胞的增殖不受影响,细胞存活率均在95%以上;单纯用 10、20、40 J/cm2红光处理HPV11.HaCaT细胞,细胞的存活率亦在92%以上。以上各组的OD550 nm值与空白组比较差异无统计学意义(P>0.05)。但将不同浓度5-ALA联合不同剂量的红光处理HPV11.HaCaT细胞后,发现5-ALA在0.75 mM以上浓度时联合20或40 J/cm2红光,细胞存活率明显降低,均低于50%,其OD550 nm值与单纯给予同浓度5-ALA组或单纯给予同剂量红光处理组相比,有明显差异(均P<0.01)。见图1。
2.2 5-ALA-PDT应用后对HPV11.HaCaT细胞中HPV 11早期基因E5、E6和E7 mRNA表达的影响根据以上细胞增殖试验的结果,0.375和0.75 mM浓度5-ALA联合20 J/cm2红光照射时,HPV11.HaCaT细胞的存活率分别为99%和87%,我们选择了这两个浓度的5-ALA并联合20 J/cm2红光照射处理,进行HPV11早期基因表达试验。结果显示,0.375 mM 5-ALA联合20 J/cm2红光处理后明显降低HPV11 E6和E7 mRNA表达(相对表达量为0.28和0.26),与单纯给予0.375 mM 5-ALA处理组或单纯用20 J/cm2红光照射组比较,均有统计学差异(P<0.01)。而0.75 mM 5-ALA+20 J/cm2红光处理后,HPV11 E6和E7 mRNA表达(相对表达量为0.85和1.46)并未出现明显降低(P>0.05)。此外,以上两种联合处理条件对HPV11 E5 mRNA的表达均无影响(相对表达量均大于1)。见图2。

图1 不同浓度的5-ALA联合不同剂量的红光照射对HPV11.HaCaT细胞增殖的影响

图2 5-ALA-PDT对HPV 11早期基因E5、E6和E7mRNA表达的影响
3 讨论
尖锐湿疣的高复发率一直是临床治疗中的棘手问题。深入探讨HPV与宿主免疫间的相互关联以及研发直接针对病原体的抗HPV药物将有益于突破这一难点,而其中建立HPV的体外模拟感染系统并将其转化为抗HPV的药效学体外模型具有重要意义。前期研究中我们构建了携带HPV11全基因组的角质形成细胞,为了探讨该体外模拟感染的细胞模型向抗HPV11药效学模型转化的可行性,需要用已知阳性治疗药物进行考核,而目前市场上尚无直接针对HPV的药物,因此我们选择了有CA治疗线索的药物进行初步探索并获得了一定的结果[4]。本研究中我们选择5-ALA-PDT作为探针,进一步探讨HPV11.HaCaT细胞用于测试抗HPV11药效的可行性。PDT法是自二十世纪七十年代末迅速发展起来的一种针对增生性病变组织的选择性治疗技术,近年来国内外亦将此应用于治疗非肿瘤性疾病如尖锐湿疣、鲜红斑痣、银屑病、类风湿性关节炎等,并取得一定疗效。5-ALA及其衍生物是第二代新型光敏剂,是人体血红蛋白生物合成的前体物质,其本身并无光毒作用,在体内可转化成内源性光敏剂原卟啉IX,经特定波长光源激发后产生光动力学反应,产生单线态氧和自由基等毒性因子,进而杀伤增殖旺盛的细胞。5-ALA-PDT法治疗尖锐湿疣具有组织选择性好、安全性高、不良反应少、复发率低及患者依从性好等特点,该方法在治疗尖锐湿疣中对HPV本身的作用并不清楚。5-ALA -PDT法包括三个要素:光敏剂、照射光和氧。由于活体组织本身有一定含氧量,因此光敏剂浓度和照射光的剂量成为影响PDT疗效的关键因素。我们将不同浓度的5-ALA、不同剂量的红光以及两者联合应用于HPV11.HaCaT细胞后,结果表明,单纯用不同浓度的5-ALA处理或单纯用不同剂量的红光照射对HPV11.HaCaT细胞的生长无明显影响。而用0.75 mM以上浓度的5-ALA联合20 J/cm2或40 J/cm2红光照射时,可明显降低HPV11.HaCaT细胞的存活率,提示此种条件下5-ALA-PDT法能达到抑制感染细胞增殖的效果。
HPV病毒基因组中的早期基因控制着病毒的转录、复制以及宿主细胞的增生或恶性转化,其中E5、E6、E7为癌基因。高危型HPV的E5、E6、E7基因分别通过干扰宿主细胞周期蛋白以及与p53和pRb的结合在致癌机制中起着关键作用[7]。虽然在低危型HPV感染的细胞中,E6和E7蛋白与宿主细胞p53和pRb结合的亲和力较高危型低[8],但低危型HPV的E5、E6、E7基因在病毒的致病和免疫逃逸等方面亦发挥着重要作用。我们选择HPV11 E5、E6、E7 mRNA的表达作为指标,观察5-ALA-PDT应用于HPV11. HaCaT细胞模型后对HPV11的影响。实验中我们选择了对细胞存活影响较小的条件,即5-ALA浓度为0.375和0.75 mM,红光照射剂量为20 J/cm2,观察5-ALA-PDT对上述三种基因mRNA表达的影响。结果表明,0.375 mM 5-ALA联合20 J/cm2的红光照射能显著抑制HPV11 E6和E7 mRNA表达,提示5-ALAPDT临床治疗尖锐湿疣有效可能与其能抑制HPV11 E6和E7基因表达有关。实验中也发现,在0.75 mM 5-ALA联合20 J/cm2红光照射后对HPV11 E6和E7 mRNA表达并未显示明显抑制作用,提示选择合适的光敏剂浓度可能对抑制病毒早期基因表达有一定影响,需要深入探讨。5-ALA-PDT法在我们的细胞模型中也未观察到对HPV11 E5 mRNA表达有明显的降低作用,提示该方法在临床治疗CA中发挥的作用可能与抑制HPV11 E5基因表达无明显关联,这亦需要进一步考证。
以上研究表明,5-ALA-PDT法应用于我们前期构建的HPV11.HaCaT细胞后,能表现出对HPV11感染细胞增殖的有效抑制,以及对HPV11 E6、E7mRNA表达的明显降低,这一方面提示了HPV11.HaCaT细胞模型用于测试抗HPV11药效的可能性,同时亦证明5-ALA-PDT法有效治疗尖锐湿疣可能与其能抑制病毒感染细胞的增殖以及降低早期基因表达有关,其他确切机制尚待进一步研究。
(志谢:上海复旦张江生物医药股份有限公司提供5-ALA样品和LED治疗仪,特此感谢!)
[1]朱伟,曹萍.尖锐湿疣的研究进展[J].皮肤病与性病,2014,36(16):327-329.
[2]吴剑波,李新宇,郑家润.人乳头瘤病毒11型基因组DNA在HaCaT株中的转染[J].中华皮肤科杂志,2009,42(2): 85-87.
[3]Wang Y,Li X,Song S,et al.Development of basal-Like HaCaT keratinocytes containing the genome of human papillomavirus(HPV)type 11 for screening of anti-HPV effects [J].JBiomol Screen,2014,19(8):1154-1163.
[4]Sun Y,Li X,Song S,et al.Integrity of a HPV11 infection cellmodel and identification of(-)-Epigallocatechin-3-gallate as a potential HPV11 inhibitor[J].Oncotarget,2016,7(24):37092-37102.
[5]王永芳,李新宇,宋莎莎,等.携带HPV11型基因组细胞三维培养模型的建立及其衣壳蛋白L1的表达[J].中国艾滋病性病,2010,16(2):105-109.
[6]Wang HW,Zhang LL,Miao F,et al.Treatment of HPV infection-associated cervical condylomataacuminata with 5-aminolevulinic acid-mediated photodynamic therapy[J]. Photochem Photobiol,2012,88(3):565-569.
[7]de Freitas AC,Coimbra EC,LeitaoMda C.Molecular targets of HPV oncoproteins:Potential biomarkers for cervical carcinogenesis[J].Biochim Biophys Acta,2014,1845(2):91-103.
[8]Oh ST,Longworth MS,Laimins LA.Roles of the E6 and E7 proteinsin the life cycle of low-risk human papillomavirus type 11[J].JViro,2004,78(5):2620-2626.
(收稿:2016-06-30)
The app lication of 5-ALA-PDT in HPV11.HaCaT cellmodel
SONG Shasha,SUN Yang,LIXinyu,WANG Yongfang.
Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
Objective:To determine the impactof 5-ALA-PDT on the HPV11.HaCaT cellmodel(HaCaT keratinocytes harboring human papillomavirus type 11 episome).Methods:Cultured HPV11.HaCaT cells were treated with 5-ALA(0.375、0.75、1.5、3 mM),red light irradiation(10、20、40 J/cm2),or different concentration of 5-ALA combined with different dose of red light irradiation.The effects on cells proliferation were examined by MTT assay.The alterations of HPV11 E5,E6 and E7 mRNA expression level were examined by real-time fluorescence quantitative PCR.Results:When 5-ALA concentration was higher than 0.75 mM and combined with 20 or 40 J/cm2red light irradiation,the survival rate of the cells was less than 50% (P<0.01).When 0.375 mM 5-ALA combined with 20 J/cm2red light irradiation,the expression of HaCaT keratinocyteswas significantly reduced,with relative expression rates of 0.28 and 0.26(P<0.01).0.75mM 5 -ALA combined with 20 J/cm2red light irradiation did not inhibit the expression of HPV11 E6 and E7mRNA,with relative expression rates of 0.85 and 1.46(P>0.05).However,the two kinds of treatmentmentioned above did notaffect the expression of HPV11 E5mRNA.Conclusion:5-ALA-PDT can effectively impacton the HPV11.HaCaT cell model,such as the proliferation of the HPV11.HaCaT cells and the expression of HPV11 E6 and E7 mRNA.
HPV11.HaCaT;condyloma acuminatum;Photodynam ic therapy;cell proliferation;early genes
中国医学科学院北京协和医学院皮肤病研究所药物研究室,210042
李新宇,E-mail:xinyusli609@163.com
