朗格汉斯细胞表面分子与尖锐湿疣复发的相关性
2016-12-02范向华
范向华 缪 旭 林 桦 施 健
朗格汉斯细胞表面分子与尖锐湿疣复发的相关性
范向华 缪 旭 林 桦 施 健
目的: 确定朗格汉斯细胞(Langerhans cells,LC)表面分子与尖锐湿疣(condyloma acum inatum,CA)复发的相关性。方法: 采用免疫组化方法对正常包皮、CA初发和复发患者皮损组织中LC进行CD1a、S100、HLA-DR标记,并对其表达强度进行半定量分析。结果: 正常对照组、CA初发组及CA复发组CD1a免疫组化染色IOD值分别为7644.84±2865.10、4075.62±2410.39和2308.08±1256.34;S100分别为4400.34±2962.29、1815.78±1013.35及1414.46±1337.13,CA组织中LC的CD1a及S100分子表达较正常组织显著下降(P<0.05),在复发组尤为明显。HLA-DR IOD值分别为583.91±592.85、2262.87±2983.09和1191.75±1698.36。HLA-DR的表达在CA初发组和复发组均强于正常组,但复发组较初发组下降。结论: HPV感染人体后,会导致HPV感染的免疫逃避,造成CA的持续感染和易复发。
尖锐湿疣; 人乳头瘤病毒; 免疫组化; 朗格汉斯细胞
尖锐湿疣(CA)是临床常见的性传播疾病(sexually transmitted diseases,STD),在国内监测的STD中发病率为第三位[1]。CA治疗后极易复发,短期难以根治。免疫机制为影响CA转归的主要因素,其决定病毒被清除或长期在体内存活继而引起相关肿瘤[2]。LC为树突状细胞(dendritic cell,DC)系统中的一种独特类型,作为皮肤、黏膜的抗原提呈细胞,在免疫系统中起重要作用。HPV感染后,LC在数量、密度、形态和功能上亦有不同程度的改变[3]。LC表面有多种分子,其中CD1a、S100和HLA-DR被认为是LC区别于其他DC的标志性表面标记[4],并在LC的各种生物学行为中起主导作用。
本研究通过免疫组化标记正常皮肤组织、CA初发和CA复发患者皮肤LC表面功能分子CD1a、S100和HLA-DR,并测定三组皮肤组织LC表面功能分子表达水平,进而分析及探讨其与HPV感染和复发的相关性。
1 资料与方法
1.1 病例资料 40例尖锐湿疣患者来自2009-2015年本院门诊就诊患者。均符合尖锐湿疣诊断标准[1]。排除标准:合并有其他局部感染或性传播疾病、慢性严重感染、严重系统疾病、糖尿病、精神病、器官移植、恶性肿瘤、自身免疫性疾病等;近期内系统使用过糖皮质激素及免疫调节剂或免疫抑制剂等。其中初发患者20例,男13例,女7例,年龄20~61岁,平均34.25岁;病程1周~1年,平均63.30天。复发组20例,男12例,女8例,年龄21~63岁,平均32.90岁,复发病程以复发皮损至本次就诊时间计为3天~9个月。初发病程与复发病程无统计学差异(P>0.05)。正常对照组10人来自于包皮环切术后正常包皮,病理及HPV试剂盒检测为阴性,年龄16~38岁,平均33.5岁。
1.2 试剂 抗CD1a、S100、HLA-DR抗体、DAB显色试剂盒及HRP偶联的山羊抗兔二抗购置自福州迈新公司;封闭血清购置自Sigma公司。
1.3 方法 所有组织予10%福尔马林溶液固定后常规制成蜡块,对石蜡切片标本和正常包皮组织分别予ELIVISION二步法进行CD1a、S100、HLA-DR免疫组化染色,采用OLYMPUSCX41显微镜及江苏省捷达软件工程公司JD-801病理图文工作站,相同曝光条件下取图,每张切片在高倍镜(10×40)下随机选择5个不连续视野,用Image pro-plus 6专业图像分析软件对图像进行半定量分析,计算出每张切片的累积光密度值(IOD)。
2 结果
2.1 LC表面分子免疫组化染色 对三组标本LC表面分子CD1a、S100、HLA-DR进行免疫组化染色,其中棕色部分为阳性染色。CD1a、S100染色标本中,阳性染色LC数量和形态方面,正常包皮组织中见表皮内较多阳性染色LC,细胞结构轮廓清晰,胞体呈圆形、椭圆形或不规则形,树突状突起较多且细长,可见二级突起(图1a,1d);初发组CA皮损表皮中LC数目较正常包皮组织减少,LC细胞结构轮廓尚清晰,胞体呈类圆形、椭圆形或不规则形,树突状突起减少、变短(图1b,1e);复发组CA皮损表皮中LC数量明显减少,胞体较小,树突状突起明显减少、缩短或消失,部分LC结构不完整,个别标本表皮局部LC消失(图1c,1f)。LC表面分子CD1a、S100阳性染色强度方面,CA患者较正常对照组明显下降,且复发组下降尤为显著。而HLA-DR染色标本中,正常对照组阳染细胞数量较少,胞体多呈类圆形,树突状结构不明显(图1g);CA初发组则较正常对照组数量明显增多,胞体及分枝清晰(图1h);CA复发组中阳染细胞数量虽仍较正常对照组增多,但较初发组下降,胞体小且分枝短小(图1i)。在LC表面分子HLA-DR阳性染色强度方面,CA患者初发及复发组均较正常对照组升高,但复发组较初发组下降。
2.2 免疫组化染色IOD测定 采用图像分析软件进行半定量分析发现,并采用SPSS 16.0软件进行统计学分析。在CD1a、S100免疫组化染色中,CA初发及复发组IOD值显著低于正常对照组,差异具有统计学意义(P<0.05),复发组较初发组IOD值降低,两组有统计学差异(P<0.05)。而对于HLA-DR,CA初发组较正常对照组增高(P<0.05),复发组IOD值虽仍较正常对照组增加,但较初发组降低,且未见统计学差异(P>0.05),见表1。
3 讨论
LC来源于骨髓造血干细胞,为一种特殊类型的树突状细胞。正常免疫状态下,当遭遇感染或炎症后,LC的数量、密度较正常反应性增加,主要发挥摄取、加工、处理抗原的作用,同时亦会发生形态学变化,逐步离开表皮移行至局部引流淋巴结,并将抗原呈递给T辅助细胞,在协同刺激因子的作用下使之活化,从而启动免疫应答。LC表面分子CD1a、S100和HLA-DR为LC发育成熟的不同阶段的标记并在免疫活动中承担不同角色[5,6],其中CD1a是标记人LC细胞的最可靠方法[7,8]。随着LC不断成熟,其吞噬和处理抗原的能力下降,而呈递抗原和激活特异性T细胞的能力不断加强。本研究显示,CA皮损中,CD1a阳染LC数量较之正常组织明显下降,细胞出现胞体变小,分枝变少,且其IOD值明显降低,这些改变在复发组尤为明显。HPV感染后,其病毒抗原仅在终末分化成熟的皮肤或黏膜上皮细胞内表达[9],而表皮中的LC通过其伸展的树突结构形成扩张性网络以识别外源性抗原[10]。当抗原与LC表面受体Langerin结合后进入胞内,与Birbeck颗粒结合,再通过CD1a的特殊结构通道表达于LC表面,从而为进一步激活T细胞做好准备[6]。CA组织中LC的数量、形态及功能分子的这些改变大大降低LC摄取和处理抗原的能力,进而进一步影响抗原传递和特异性T细胞的激活。而S100分子被认为是LC的活化标记,表达于成熟LC[11,12]。LC通过S100调节T细胞内钙离子浓度,参与激活T细胞的过程[13],本研究显示,CA组织中S100阳染 LC数量、形态及表达强度出现与CD1a相似改变,表明HPV感染后,LC的成熟活化明显受到阻碍,从而直接影响其抗原递呈功能,进而影响T细胞激活。HLA-DR是人类主要组织相容性复合物(MHC-II)类分子的主要抗原,表皮中主要表达于成熟的LC表面,在抗原递呈中充当第一信号的作用。其通过将抗原从胞内囊泡传递到细胞表面,进而被CD4+T细胞识别进行抗原传递,是LC细胞实现抗原递呈功能的前提和必需条件[14]。本研究表明,初发组CA患者中,HLA-DR较正常对照组表达增强,说明HPV感染上皮组织后,刺激了HLA-DR的表达,机体发挥免疫保护作用。而复发组CA患者,HLA -DR虽仍较对照组增加,但差异无统计学意义,且较初发组下降,表明随着病程的进一步发展,病毒抗原刺激引起的免疫保护反应不能抗衡病毒的免疫逃避机制,导致HLA-DR介导的抗原提呈作用下降。

表1 CA患者和正常对照组表面分子免疫组化染色IOD测定 (¯x±s)
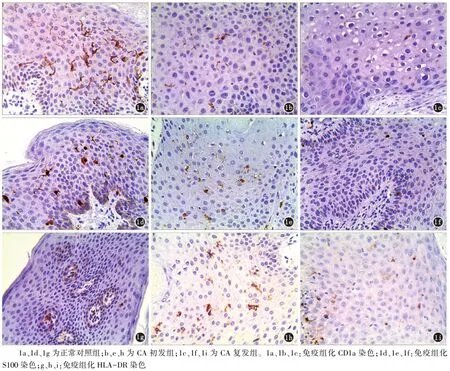
图1 LC表面分子表达(IHC,×400)
本研究通过免疫组化染色观察正常对照组、CA初发组和CA复发组LC表面三种分子表达,并进行半定量分析,发现LC表面分子CD1a、S100表达强度在CA患者均有显著下降,且复发组下降尤为显著,这一改变降低了LC的抗原呈递功能,从而导致HPV的持续感染和复发。其发生机制与HPV感染后表皮的E-cadherin蛋白的降低直接相关[15]。而HLA-DR在CA组织中表达强度虽有增强,尤其在初发期,一定程度上有利于LC抗原递呈,对HPV感染起到一定保护作用,但随着病程发展,其表达及所发挥的保护性作用下降。以上表明,HPV感染人表皮组织后,LC的抗原处理和传递功能受到了影响,尤其在复发患者中影响更为显著,从而导致HPV感染的免疫逃避,造成CA的持续感染和易复发。
[1]赵辨.中国临床皮肤病学[M].南京:江苏科技技术出版社,2010.1779,1816-1821.
[2]Harwood CA,Surentheran T,Spink P,et al.Human papillomavirus infection and non-melanoma skin cancer in immunosuppressed and immunocompetent individuals[J].JMed Virol,2000,61(3):289-297.
[3]缪旭,骆丹.朗格汉斯细胞与人类乳头瘤病毒感染[J].国外医学皮肤性病学分册,2005,31(2):113-115.
[4]Elmas C,Erdoĝan D,Özoĝul C.Langerhans cells of the skin in lymphoid organs:An immunohistochemical study[J].Gazi Medical Journal,2010,21(1):3-10.
[5]Berger CL,Vasquez JG,Shofner J,et al.Langerhans cells: mediators of immunity and tolerance[J].Int J Biochem Cell Biol,2006,38(10):1632-1636.
[6]Mizumoto N,Takashima A.CD1a and langerin:acting as more than Langerhans cellmarkers[J].JClin Invest,2004,113(5):658-660.
[7]Baleeiro RB,Barbuto JA.Local secretion/shedding of tumorderived CD83molecules as a novel tumor escapemechanism [J].Mol Immunol,2008,45(12):3502-3504.
[8]Fausch SC,Silva DMD,Martin KW.Differential uptake and cross-presentation of human papillomavirus virus-like particles by dendritic cells and Langerhans cells[J].Cancer Res, 2003,63(13):3478-3482.
[9]Leong CM,Doorbar J,Nindl I,etal.Deregulation of E-cadherin by human papillomavirus is not confined to high-risk,cancer-types[J].Br JDermatol,2010,163(6):1253-1263.
[10]RomaniN,Holzmann S,Tripp CH,et al.Langerhans cells–dendritic cells of the epidermis[J].APMIS,2003,111(7 -8):725-740.
[11]Villa LL,Costa RL,Petta CA,et al.High sustained efficacy of a prophylactic quadrivalent human papillomavirus types 6/11/16/18 L1 virus-like particle vaccine through 5 years of follow-up[J].Br JCancer,2006,95(11):1459-1466.
[12]Kikuchi K,Kusama K,Taguchi K.Vascular endothelial growth factor and dendritic cells in human squamous cell carcinoma of the oral cavity[J].Anticancer Res,2002,22 (2A):545-557.
[13]Kohrgruber N,Halanek N.Survival,maturation,and function of CD11c-and CD11c+peripheral blood dendritic cells are differentially regulated by cytokines[J].J Immunol,1999,163(6):3250-3259.
[14]Park JH,Lee YJ,Kim KL,et al.Selective isolation and identification of HLA-DR-associated naturally processed and presented epitope peptides[J].Immunol Invest,2003,32(3):155-169.
[15]Pan YZ,Wang HL,Wang F.Changes in distribution and ultrastructure of Langerhans cells in condyloma acuminatum tissues,and analysis of the underlyingmechanism[J].Dermatol Sin,2013,31:120-125. (收稿:2016-04-26 修回:2016-06-27)
Relationship between the surfacemolecules of Langerhans cells and recurrence of condyloma acum inatum
FAN Xianghua,MIAO Xu,LIN Hua,SHIJian.
Department of Dermatology,Nantong First People's Hospital,Nantong 226001,China Corresponding author:MIAO Xu,E-mail:mx730129@163.com
Objective:To determine the relationship between the surface molecules of langerhans cells (LC)and recurrence of condyloma acuminatum(CA).Methods:The expression of CD1a,S100 and HLADR of LC was measured by immunohistochemical technique,and their semi-quantities were analyzed by graphic software in skin samples of control group,primary CA group and recurrent CA group.Resu lts:In control group,primary CA group and recurrentCA group,the IOD of immunohistochemical staining of CD1a were 7644.84±2865.10,4075.62±2410.39 and 2308.08±1256.34;The IOD of S100 were 4400.34±2962.29,1815.78±1013.35 and 1414.46±1337.13.The staining intensity of CD1a and S100 in CA decreased significantly when compared with control group(P<0.05),with an even more decrease in the recurrent CA group. The IOD of HLA-DR were 583.91±592.85,2262.87±2983.09 and 1191.75±1698.36 in the three groups respectively.The staining intensity of HLA-DR was increased in primary and recurrent CA groups,when compared with control group,but the expression in recurrent group decreased when compared with primary group. Conclusion:After infection of HPV,immune escapewill occure and lead to the persistence and recurrence of CA.
Condyloma acuminatum;human papillomavirus;immunohistochemical staining;langerhans cells
南通市社会事业科技创新与示范计划项目(编号:HS2014048)
南通市第一人民医院皮肤科,江苏南通,226001
缪旭,E-mail:mx730129@163.com
