不同浓度藻类水华对两种沉水植物的影响
2016-12-01代亮亮郭亮亮吴中奎周维成李根保中国科学院水生生物研究所淡水生态与生物技术国家重点实验室湖北武汉430072中国科学院大学北京00049
代亮亮,郭亮亮,吴中奎,周维成,李根保*(.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,湖北 武汉 430072;2.中国科学院大学,北京 00049)
不同浓度藻类水华对两种沉水植物的影响
代亮亮1,2,郭亮亮1,2,吴中奎1,周维成1,2,李根保1*(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,湖北 武汉 430072;2.中国科学院大学,北京 100049)
为了研究藻类水华对沉水植被恢复的影响,通过模拟不同浓度的藻类水华,开展了篦齿眼子菜(Potamogeton pectinatus)和伊乐藻(Elodea nuttallii)在不同浓度藻类水华下(0, 6.25×108, 2.5×109, 1010cell/L)的生长和生理试验.结果表明,低浓度(6.25×108cell/L)处理组中伊乐藻的干重显著低于对照组,而藻浓度达到1010cell/L时,篦齿眼子菜的干重才显著低于对照组.与其它处理组相比,在藻浓度为1010cell/L的情况下,篦齿眼子菜的株高最矮,而伊乐藻的株高最高.叶绿素荧光特性表明藻浓度为1010cell/L的情况下,篦齿眼子菜的光合活性从0.77降低至0.50,而伊乐藻的光合活性无显著性变化,在0.72~0.79之间波动.沉水植物的抗氧化酶活性在藻类水华胁迫环境下先增加后降低.这表明,藻类水华对水生植物的生长影响有差异性;水体中过高的藻浓度会影响植物的抗性生理.沉水植物能忍耐短期低浓度的藻类水华胁迫,但是长期高浓度的藻类水华会严重影响沉水植物的生长,进而影响水生植被的恢复.
藻类水华;沉水植物;生长
沉水植物是指整个植物体全部浸没于水层下面的大型水生植物[1].作为水体生态系统中主要的初级生产者,沉水植物能够为浮游动物提供避难所,为鱼类繁殖提供生境[2],改善水下光照和溶解氧条件,为形成复杂的食物链提供了食物、场所和其他必要条件,是水体生物多样性耐以维持的基础[3-4].然而随着富营养化进程的加快,沉水植物衰退和消失的现象在世界范围内普遍出现[5],例如中国的云南滇池[6]、武汉东湖[7],日本的霞浦湖[8],美国切萨皮克湾上部和中部[9],丹麦的阿勒湖[10],德国东北部湖泊等[11].沉水植物的逐步消亡打破了原有的生态平衡,加快了水体从大型水生植物占优的草型清水态向浮游植物占优的藻型浊水态转变的过程[12].
云南滇池是超富营养化水体,最突出的问题是蓝藻水华的污染,在2009年1~12月期间,滇池全湖浮游植物的密度平均值为1.77×108cell/L,变幅在0.83×108~3.95×108cell/L之间[6].蓝藻水华的暴发,会降低水体透明度和水下光强,严重影响水中其它动植物的生长,而藻类大量死亡后,在其腐败、分解过程中,也会消耗水体中大量的溶解氧,释放有害物质,使水体恶臭,从而影响沉水植物的生长[13].在“十一五”期间,我们课题组在草海建成了以轮叶黑藻为优势种群的水生植被生长区,沉水植被盖度达80%以上,在沉水植被生长区,水清澈见底,水质改善效果明显,进而促进藻型浊水态向草型清水态的转换[6].然而,自 2014年以来,在生长季节,相关管理部门将滇池北部高浓度的富藻水下泄到草海,使局部浮游植物密度达到4.11×109cell/L,甚至更高,这严重影响到水草的萌发和生长.
目前,国内外在沉水植物衰退的影响因子方面进行了大量研究,但大多集中在光照强度[14]、营养盐[15]、水位[16]、重金属[17]等方面,而造成水体透明度下降的重要因素之一蓝藻水华对沉水植物生长影响的相关研究较少.鉴于此,本实验挑选滇池现存的优势种伊乐藻(Elodea nuttallii)和篦齿眼子菜(Potamogeton pectinatus)为研究对象,研究不同浓度的藻类水华对伊乐藻和篦齿眼子菜的生长影响,旨在为沉水植物的恢复提供理论依据.
1 材料与方法
1.1 实验材料
实验用水生生物材料采自“中国科学院水生生物研究所“十二五”水专项草海生态修复工程示范区”,时间为2014年10月份,采生长状况良好且一致的伊乐藻和篦齿眼子菜,用清水洗去植物表面的杂质、附着物等,伊乐藻取顶端10cm扦插种植,篦齿眼子菜留根种植,两者均种植在容积为120L的塑料桶中进行驯化,保种.
1.2 实验处理
2015年5月,取驯化后的伊乐藻顶端10cm,根系健壮10cm长的篦齿眼子菜,洗净,分别种在80L(上口直径50cm,下底直径40cm,高50cm)的塑料桶中,种植深度为5cm,伊乐藻的种植密度为每桶种6丛,每丛3株;篦齿眼子菜种植密度为每桶种6丛,每丛3株,实验所用底泥来自草海,培养水为经25号浮游植物网(200目)过滤后的草海原位湖水.为保证伊乐藻和篦齿眼子菜幼苗成活,伊乐藻和篦齿眼子菜生长一个月后再进行实验处理.
2015年6月3日,将不同浓度的藻加入到塑料桶中.实验设置4个藻浓度梯度,取经浮游植物网采集的藻加入到实验组中,使对应实验组的藻细胞浓度分别为 0(对照)、6.25×108(低)、2.5× 109(中)、1010(高)cell/L,每个浓度梯度设置3个重复.每隔 3d添加一次藻样,以维持实验期间蓝藻的藻浓度梯度.藻类水华的主要优势种为铜绿微囊藻,占96%以上.
实验监测指标为伊乐藻和篦齿眼子菜株高、干重、叶绿素荧光、抗氧化酶活力及水质理化指标.叶绿素荧光的监测采用Water-Pam(WALZ,德国).对植物抗氧化酶活力的检测,超氧化物歧化酶(SOD)的测定采用氮蓝四唑光化还原法,过氧化物酶(POD)的测定采用愈创木酚法,过氧化氢酶(CAT)的测定采用紫外吸收法[18].水质理化指标中,可溶性总磷(DTP)的测定参照钼酸铵分光光度法,可溶性总氮(DTN)的测定参照碱性过硫酸钾消解分光光度法[19].株高和叶绿素荧光的监测周期为每周一次,抗氧化酶活力和水质的监测周期为每两周一次,实验结束时,收集伊乐藻和篦齿眼子菜,将沉水植物表面的水吸干,然后作60℃、72h烘干处理,测量其干重.采样时间为每天中午13:00~14:00,整个实验的周期为2015年6月3日~2015年7月22日,实验期间水温变化范围为18.1~31.9℃,光强变化范围为0~79500Lx.
1.3 图形与数据处理
数据、图形处理分别利用 SPSS 20(IBM,USA)和Origin 8(OriginLab,USA)完成.
2 结果与讨论
2.1 不同浓度藻类水华对沉水植物株高的影响
由图1可知,不同藻浓度对篦齿眼子菜和伊乐藻株高的影响是不同的.对于篦齿眼子菜,当藻浓度为0、6.25×108、2.5× 109cell/L时,篦齿眼子菜的株高没有显著性差异(P>0.05),当藻浓度增加到 1010cell/L时,与其它处理组相比,篦齿眼子菜的株高显著降低(P<0.05)(图 1A),实验结束时其株高为(20.3±3.3)cm.而对于伊乐藻,当藻浓度为0、6.25×108、2.5× 109cell/L时,伊乐藻的株高是没有显著性差异的(P>0.05),但在高浓度藻类水华下(1010cell/L)时,伊乐藻的株高显著高于其它处理组(P<0.05)(图 1B),实验结束时其株高为(34.6±2.3)cm.
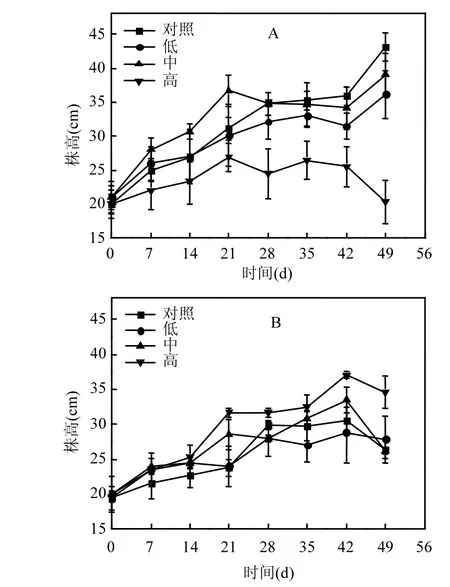
图1 不同藻华浓度下沉水植物株高随培养时间的变化情况Fig.1 The change in height of submerged macrophytes at different concentrations of algal blooms
不同浓度的藻类水华对沉水植物株高影响的差异性原因或许与植株的光合作用有关.高浓度藻类水华条件下,水体中的大量蓝藻使得光照在水下迅速衰减,而篦齿眼子菜和伊乐藻的光合活性对光照的响应是不同的,高藻浓度下,篦齿眼子菜光合活性下降,导致篦齿眼子菜随时间增长由绿色转化为黄绿色,其株高也是最矮的.而光照对伊乐藻光合活性的影响不显著,伊乐藻在实验过程中均为绿色,低光条件下,伊乐藻为了获取更多的光照,呈现出株高长的生长趋势.
2.2 不同浓度藻类水华对沉水植物干重的影响

图2 实验结束时沉水植物的总干重Fig.2 The total dry weight of submerged macrophytes at the end of the experiment
由图2可知,不同藻浓度对篦齿眼子菜和伊乐藻干重的影响是不同的.对于篦齿眼子菜,当藻浓度为0、6.25×108、2.5×109cell/L时,各处理组的干重未表现出显著性差异(P>0.05),但是,当藻浓度增加到 1010cell/L时,与其它处理组相比,篦齿眼子菜的干重显著较小(P<0.05)(图 2A),干重为(0.485±0.120)g.对于伊乐藻,当藻浓度为 6.25× 108、2.5×109cell/L时,与对照组相比,伊乐藻的干重显著较小(P<0.05),对照组的干重为(19.265± 4.080)g,而当藻浓度为 1010cell/L时,伊乐藻的干重显著小于其它处理组(P<0.05)(图 2B),干重为(1.533±0.625)g.
实验结果表明,与伊乐藻相比,篦齿眼子菜对藻浓度的变化更耐受.篦齿眼子菜在藻浓度提高到 1010cell/L时,其干重才显著小于其它处理组,而伊乐藻在藻浓度提高到6.25×108cell/L时,其干重就显著小于对照组(图 2).不过,篦齿眼子菜对蓝藻的耐受能力也是有限的,长时间的高藻浓度处理,其干重会显著降低,这与陈开宁等的研究是一致的[20].
2.3 不同浓度藻类水华对沉水植物叶绿素荧光特性的影响
不同浓度藻类水华下,篦齿眼子菜和伊乐藻的叶绿素荧光参数Fv/Fm呈现不同的变化(图3).在1010cell/L的藻浓度下,篦齿眼子菜的最大光量子产量在第 28d时显著降低(P<0.05),实验结束时,Fv/Fm值由0.77降低至0.50,而其他藻浓度下,其最大光量子产量无显著差异(P>0.05),Fv/Fm值在0.75左右(图3A).但是,对于伊乐藻,藻浓度梯度对伊乐藻的最大光量子产量无显著影响(P>0.05),Fv/Fm值在0.72~0.79之间波动(图3B).
不同浓度藻类水华的处理下,沉水植物的光合活性表现出不同特性.藻类水华的暴发会直接影响水体浊度和水下光强,有研究发现,光照强度和浊度的变化会显著影响苦草和篦齿眼子菜的光合作用效率[21-23],而黑藻和伊乐藻对光强有着较好的适应性[21,24].本实验中,随着藻浓度梯度的增大和受藻胁迫时间的增长,篦齿眼子菜的颜色由绿色转化为黄绿色, 当藻浓度为低于 2.5× 109cell/L时,最大光量子产量(Fv/Fm)的变化没有显著性差异,当藻浓度增加到 1010cell/L时,篦齿眼子菜的最大光量子产量显著降低(P<0.05)(图3A),这说明高藻浓度能显著影响篦齿眼子菜的光合活性,进而影响篦齿眼子菜的生长.然而,藻浓度梯度变化对伊乐藻的最大光量子产量无显著影响(P>0.05),Fv/Fm值在0.72~0.79之间波动(图 3B),表明不同藻浓度对伊乐藻的光合活性产生的影响不大,可能是由于植物对弱光环境会产生一定的光合适应性[25],实验过程中,我们观察到伊乐藻呈现为绿色,也说明弱光下植物产生叶绿素的量并不会减少[26-27].

图3 不同藻华浓度下沉水植物最大光量子产量随时间的变化情况Fig.3 The change in maximum quantum yield of submerged macrophytes at different concentrations of algal blooms
2.4 不同浓度藻类水华对沉水植物抗氧化酶系统的影响
2.4.1 超氧化物歧化酶SOD的变化 由图4可知,篦齿眼子菜的SOD活性对不同藻浓度的响应是不同的(图4A),对照组篦齿眼子菜的SOD活性在整个监测期间是没有显著性变化的(P>0.05),在其他3个处理组中,篦齿眼子菜的SOD呈现出先增高后降低的趋势(P<0.05),在高藻浓度1010cell/L下,SOD的活性在第30d时达到最大值,为(1632.06±82.12)U/gFW.实验中,伊乐藻SOD活性的变化和篦齿眼子菜SOD活性的变化是相似的(图4B),对照组中伊乐藻的SOD活性在整个监测期间没有显著性变化(P>0.05),其他 3个处理组的 SOD活性呈现出先增高后降低的趋势(P<0.05),在高藻浓度1010cell/L下,SOD的活性在第30d时达到最大值(1141.50±62.07 )U/gFW(图4B).
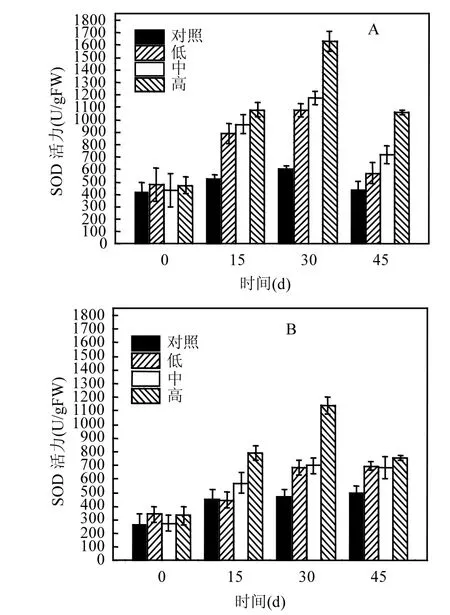
图4 不同藻华浓度下沉水植物SOD活力随时间的变化情况Fig.4 The change in SOD activity of submerged macrophytes at different concentrations of algal blooms
2.4.2 过氧化物酶POD的变化 篦齿眼子菜和伊乐藻的POD活性对不同藻浓度的响应是不一致的,且篦齿眼子菜的POD活性明显大于伊乐藻的POD活性(图5).在藻浓度为1010cell/L处理下,篦齿眼子菜的POD活性随时间的变化存在显著性差异(P<0.05),在第15d时为最大值,此时POD活力为(2428.82±169.46)U/(gFW·min),其它藻浓度下,篦齿眼子菜的POD活性随时间的变化没有显著性差异(P>0.05)(图 5A).当藻浓度为1010cell/L时,伊乐藻的 POD活性随时间的变化存在显著性差异,在第 30d时为最大值(P<0.05),此时POD活力为(203.63±11.52)U/(gFW·min),其它藻浓度下,伊乐藻的过氧化物酶活性随时间的变化没有显著性差异(P>0.05)(图5B).

图5 不同藻华浓度下沉水植物POD活力随时间的变化情况Fig.5 The change in POD activity of submerged macrophytes at different concentrations of algal blooms
2.4.3 过氧化氢酶 CAT的变化 由图 6可知,篦齿眼子菜的过氧化氢酶CAT活性对不同藻浓度的响应是不同的(图6A),当藻浓度为0cell/L时,篦齿眼子菜的CAT在整个监测期间没有显著性变化(P>0.05),但其他 3个处理组中,篦齿眼子菜的CAT呈现出先增高后降低的趋势(P<0.05),在第15d时,藻浓度为1010cell/L处理组的CAT的活性达到最大值(26.22±1.45)U/(gFW·min).伊乐藻CAT活性的变化和篦齿眼子菜CAT活性的变化是相似的(图6B),对照组伊乐藻的CAT活性在整个监测期间没有显著性变化(P>0.05),但其他3个处理中,伊乐藻的CAT活性呈现出先增高后降低的趋势(P<0.05),在第 15d时,高藻浓度(1010cell/L)处理组的伊乐藻 CAT活性达到最大值(55.85±1.45) U/(gFW·min).
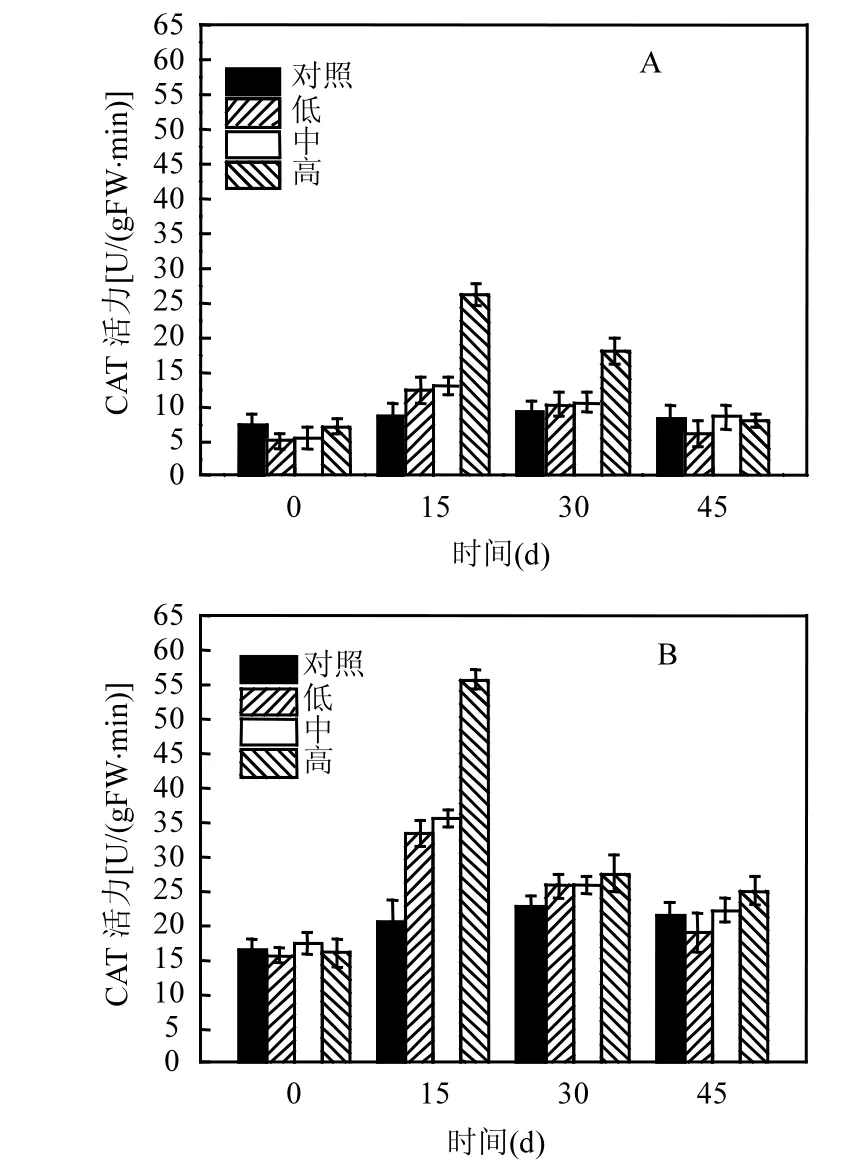
图6 不同藻华浓度下沉水植物CAT活力随时间的变化情况Fig.6 The change in CAT activity of submerged macrophytes at different concentrations of algal blooms
在抵抗藻类水华影响过程中,沉水植物的抗氧化系统发挥不同的作用.逆境胁迫下植物细胞内固有的自由基代谢平衡被破坏而导致过量产生自由基[28-29].过量自由基引发或加剧膜脂过氧化作用,造成细胞膜系统损伤,干扰植物细胞光合、呼吸和代谢过程,严重时会导致植物细胞死亡[30].SOD、POD、CAT是酶促防御系统重要的保护酶[31],正常情况下,植物体内 SOD、POD、 CAT维持在一定水平,以去除不断产生的自由基
[32].本研究发现,篦齿眼子菜和伊乐藻的 SOD活性在藻浓度为0cell/L时,是没有显著性差异的,但是当藻浓度提高时,它们的SOD活性随时间的变化表现出先增高后降低的趋势(图4).篦齿眼子菜和伊乐藻CAT活性与SOD活性变化的趋势是相一致的,但是POD活性的变化与SOD和CAT活性的变化却表现出差异性(图5).在藻浓度低于2.5×109cell/L时,篦齿眼子菜和伊乐藻的POD活性变化不大,但是当藻浓度为 1010cell/L时,它们的POD活性随时间的变化表现出先增高后降低的趋势(图5).篦齿眼子菜和伊乐藻的抗氧化酶系统在较高的藻浓度下随时间的变化总体表现出先增高后降低的趋势,表明在短期低浓度藻的胁迫下,篦齿眼子菜和伊乐藻具有一定的抵抗逆境胁迫、适应环境的能力,但是当篦齿眼子菜和伊乐藻处于长期的高浓度藻胁迫环境中时,它们的生长会受到抑制,抗逆性能也会受到抑制.此外,各处理组中篦齿眼子菜的POD活力明显大于伊乐藻,表明篦齿眼子菜清除自由基的能力强于伊乐藻,篦齿眼子菜对藻浓度的变化更具耐受性.
2.5 不同藻浓度对水质的影响
2.5.1 不同藻浓度对水体中可溶性总氮含量的影响 不同藻浓度对种植篦齿眼子菜和伊乐藻的水体中 DTN含量的变化均具有显著性影响(P<0.05)(图7).在种植篦齿眼子菜的水体中,当藻浓度为0和6.25×108cell/L时,两者的DTN含量在监测期间没有显著性差异(P>0.05).当藻浓度为 2.5× 109cell/L时,与藻浓度为 0和 6.25× 108cell/L时相比,从第30d起,水体中DTN含量显著提高了(P<0.05),第45d时,水体DTN中含量为(2.19±0.26)mg/L.而当藻浓度为 1010cell/L时,与其它实验组相比,从第15d起,水体中DTN含量显著提高了(P<0.05),第45d时,水体中DTN含量为(4.24±0.16)mg/L(图7A).
在种植伊乐藻的水体中,其各处理组中DTN含量的变化与种植篦齿眼子菜的处理组是相一致的,当藻浓度为0和6.25×108cell/L时,两者的DTN含量在监测期间均没有显著性差异(P>0.05).当藻浓度为2.5× 109cell/L时,与藻浓度为0和 6.25×108cell/L时相比,从第 15d起,水体中DTN含量显著提高了(P<0.05),第45d时,水体中DTN 含量为(3.19±0.37)mg/L.而当藻浓度为1010cell/L时,与其它实验组相比,从第 15d起,水体中DTN含量显著提高了(P<0.05),第45d时,水体中DTN含量为(5.39±0.34) mg/L(图7B).

图7 培养体系中DTN含量的变化情况Fig.7 The change of DTN in cultivation
2.5.2 不同藻浓度对水体中可溶性总磷含量的影响 不同藻浓度对种植篦齿眼子菜和伊乐藻的水体中DTP含量的变化也具有显著性影响(图8).在种植篦齿眼子菜的水体中,当藻浓度为 0、6.25×108、2.5× 109cell/L时,它们的DTP含量在监测期间均没有显著性差异(P>0.05).当藻浓度为1010cell/L时,与其它实验组相比,从第15d开始,水体中DTP含量显著提高了(P<0.05),第45d时,水体中DTP含量为(0.25±0.02) mg/L(图8A).
在种植伊乐藻的水体中,其各处理组中DTP含量的变化与种植篦齿眼子菜的处理组是相一致的,当藻浓度为0cell/L时,其DTP含量在检测期间均没有显著性差异(P>0.05).当藻浓度为6.25×108cell/L时,与藻浓度为0cell/L相比,第45d时,水体中DTP含量显著提高了(P<0.05),含量为(0.11±0.02)mg/L.当藻浓度为2.5×109cell/L时,水体中DTP含量从第15d起显著提高(P<0.05),第45d时,水体中DTP含量为(0.18±0.02)mg/L,而当藻浓度为 1010cell/L时,与其它实验组相比,水体中DTP含量从第15d起显著提高(P<0.05),第45d时,水体中DTP含量为(0.45±0.04) mg/L(图8B).
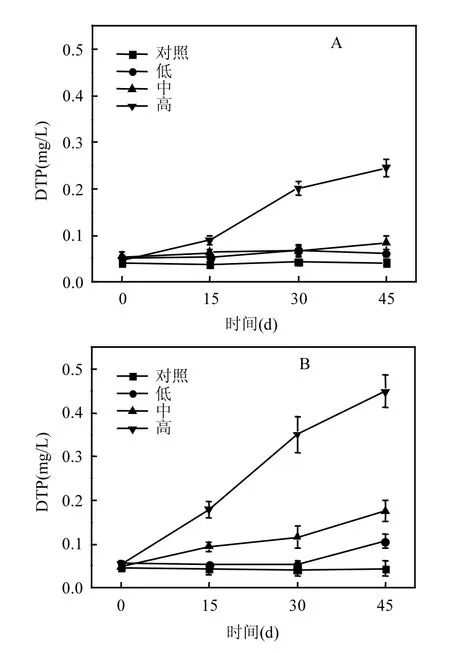
图8 培养体系中DTP含量的变化情况Fig.8 The change of DTP in cultivation
对水体中DTN、DTP的检测结果表明,维持藻浓度为1010cell/L时,水体中DTN、DTP的含量随着时间的变化显著增加了(图 7、8),与武晓飞等研究反复扰动下,加藻会导致DTP含量先增加的结果相一致[33].这表明持续添加水华藻类对水体营养盐的增加起到一定的影响.从滇池外海下泄的富藻水不仅能对沉水植物造成影响,同时也会加剧草海的营养盐浓度.有研究认为TN、TP并不是制约沉水植物生长的因素[34],沉水植物对水体营养盐浓度具有较宽的耐受范围[35].但是,当营养盐浓度高于沉水植物忍受阈值时,菹草石芽苗的生长速率受到抑制,光合系统热耗散增加;同时,观察到在静止水体中,营养盐浓度升高导致浮游藻类大量繁殖,在营养盐和浮游藻类的双重胁迫下,菹草的生长受到抑制,不易存活[36].在本实验中,并没有对营养盐的影响进行研讨,关于添加藻类造成的营养盐浓度上升对沉水植物生长的影响需要进一步的研究.
3 结论
3.1 藻类水华的暴发会影响沉水植物的生长,不同的沉水植物对藻类水华的耐受能力不同.低浓度(6.25×108cell/L)的藻类水华即可使伊乐藻的干重减少,但当藻浓度达到 1010cell/L时,也会使篦齿眼子菜的干重显著降低.
3.2 沉水植物对不同浓度藻类水华的响应存在时效和种间差异. 藻浓度达到1010cell/L时,篦齿眼子菜的光合活性由0.77降低至0.50,但其POD活力明显大于伊乐藻,表明篦齿眼子菜清除自由基的能力强于伊乐藻,篦齿眼子菜对藻浓度的变化更具耐受性.因此,在水生态修复过程中,尽可能避开藻类水华的干扰,可以降低沉水植被恢复与重建的失败风险.
[1] 王 华,逄 勇,刘申宝,等.沉水植物生长影响因子研究进展[J]. 生态学报, 2008,28(8):3958-3968.
[2] Jeppesen E, Sondergaard M, Sondergaard M, et al. The structuring role of submerged macrophytes in lakes [M]. Springer Science & Business Media, 2012:91-113.
[3] Gumbricht T. Nutrient removal processes in freshwater submersed macrophyte systems [J]. Ecological Engineering, 1993,2(1):1-30.
[4] Van donk E, Van D E, Bund W J. Impact of submerged macrophytes including charophytes on phyto-and zooplankton communities: allelopathy versus other mechanisms [J]. Aquatic botany, 2002,72(3):261-274.
[5] Melzer A. Aquatic macrophytes as tools for lake management [J]. Hydrobiologia, 1999,395:181-190.
[6] 李根保,李 林,潘 珉,等.滇池生态系统退化成因,格局特征与分区分步恢复策略 [J]. 湖泊科学, 2014,26(4):485-496.
[7] QIU D R, WU Z B. Ecological studies on aquatic macrophytes in lake Donghu of Wuhan—feasibility for rehabilitation of submerged macrophytes in the lake [J]. Resources and Environment in the Yangtze Basin, 1998,7(1):42-47.
[8] SAKURAI Y. Decrease in vegetation area, standing biomass and species diversity of aquatic macrophytes in Lake Kasumigaura(Nishiura) in recent years [J]. Japanese Journal of Limnology,1990,51:45-48.
[9] Kemp W M, Boynton W R, Adolf J E, et al. Eutrophication of Chesapeake Bay: historical trends and ecological interactions [J]. Marine Ecology Progress Series, 2005,303(21):1-29.
[10] Sand-jensen K, Riis T, Vestergaard O, et al. Macrophyte decline in Danish lakes and streams over the past 100years [J]. Journal of Ecology, 2000,88(6):1030-1040.
[11] KRNER S. Loss of submerged macrophytes in shallow lakes in North-Eastern Germany [J]. International Review of Hydrobiology, 2002,87(4):375-384.
[12] MOSS B. Engineering and biological approaches to the restoration from eutrophication of shallow lakes in which aquatic plant communities are important components [M]. Biomanipulation Tool for Water Management. Springer, 1990:367-377.
[13] Robinson K, Purintun B, LEE J, et al.The Variance of Oxygen Levels As It Relates to the Amount of Algae in Water Samples [J]. Journal of Introductory Biology Investigations, 2014,1(4):42-53.
[14] LI W, LIAN G. Light demand for brood-bud germination of submerged plant [J]. Journal of Lake Sciences, 1995,8(suppl.):25-29.
[15] Kosten S, Jeppesen E, Huszar V L, et al. Ambiguous climate impacts on competition between submerged macrophytes and phytoplankton in shallow lakes [J]. Freshwater Biology, 2011,56(8):1540-1553.
[16] Loverde-Oliveira S M, Huszar V L M, Mazzeo N, et al. Hydrology-driven regime shifts in a shallow tropical lake [J]. Ecosystems, 2009,12(5):807-819.
[17] Dushenko W, Bright D, Reimer K. Arsenic bioaccumulation and toxicity in aquatic macrophytes exposed to gold-mine effluent:relationships with environmental partitioning, metal uptake and nutrients [J]. Aquatic Botany, 1995,50(2):141- 158.
[18] 邹 琦.植物生理学实验指导 [M]. 北京:中国农业出版社,2000: 65-128.
[19] 魏复盛,寇洪茹,洪水皆.水和废水监测分析方法 [M]. 北京:中国环境科学出版社. 2002:243-255.
[20] 陈开宁,李文朝,吴庆龙,等.滇池蓝藻对沉水植物生长的影响[J]. 湖泊科学, 2003,15(4):364-368.
[21] 苏文华,张光飞,张云孙,等.5种沉水植物的光合特征 [J]. 水生生物学报, 2004,15(4):391-395.
[22] 潘国权,王国祥,李 强,等.浊度对苦草(Vallisneria natans)幼苗生长的影响 [J]. 生态环境, 2007,16(3):762-766.
[23] 陈开宁,强 胜,李文朝.蓖齿眼子菜的光合速率及影响因素 [J].湖泊科学, 2002,14(4):357-362.
[24] 靳 萍,胡灵卫,靳同霞,等.伊乐藻光合能力对三种生态因子的响应 [J]. 水生态学杂志, 2013,1(7)14-22.
[25] 眭晓蕾,张振贤,张宝玺,等.不同基因型辣椒光合及生长特性对弱光的响应 [J]. 应用生态学报, 2006,17(10):1877-1882.
[26] DI BENEDETTO A, GARCIA A. Adaptation of ornamental aroids to their indoor light environments. I. Spectral and anatomical characteristics [J]. Journal of horticultural science,1992,14(4):357-362.
[27] NYITRAI P, SARVARI E, KERESZTES A,et al. Organization of thylakoid membranes in low-light grown maize seedlings. Effect of lincomycin treatment [J]. Journal of plant physiology, 1994,144(3):370-375.
[28] 杜 威,江 萍,王彦苏,等.白僵菌施加对水稻三种抗氧化酶活力及叶际微生物多样性的影响 [J]. 生态学报, 2014,34(23):6975-6984.
[29] 张摇蒙.叶绿酸铁对亚适温条件下黄瓜幼苗渗透调节物质及抗氧化酶活性的影响 [J]. 应用生态学报, 2014,25(12):3527-3532.
[30] Dhindsa R, Plumb-dhindsa P, Thorpe T. Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase [J]. Journal of Experimental botany, 1981,32(1):93-101.
[31] Velikova V, Yordanov I, Edreva A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants: protective role of exogenous polyamines [J]. Plant Science, 2000,151(1):59-66.
[32] Hojati M, Modarres-sanavy S A M, Karimi M, et al. Responses of growth and antioxidant systems in Carthamus tinctorius L. under water deficit stress [J]. Acta physiologiae plantarum, 2011,33(1):105-112.
[33] 武晓飞,李大鹏,汪 明,等.反复扰动下加藻对不同形态磷相互转化的影响 [J]. 中国环境科学, 2015,35(4):1187-1196.
[34] CHAMBERS P A. Light and nutrients in the control of aquatic plant community structure. II. In situ observations [J]. Journal of Ecology, 1987,621-628.
[35] BEKLIOGLU M, MOSS B. Existence of a macrophytedominated clear water state over a very wide range of nutrient concentrations in a small shallow lake [J]. Hydrobiologia, 1996, 337(1-3):93-106.
[36] 马 婷.水体营养盐对菹草生长的影响 [D]. 南京:南京师范大学, 2007.
The effects of different concentrations of algal blooms on the two submerged macrophytes.
DAI Liang-liang1,2, GUO Liang-liang1,2, WU Zhong-kui1, ZHOU Wei-cheng1,2, LI Gen-bao1*(1.State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China;2.University of Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2016,36(9):2765~2773
In order to examine the effects of the amount of algal blooms on the restoration of submerged vegetations, we carried out the simulated experiments to study the growth and physiological responses of Potamogeton pectinatus and Elodea nuttallii to different concentrations (0, 6.25×108, 2.5×109, 1010cell/L) of algal blooms. The results showed that the dry weight of E. nuttallii at the low concentration (6.25×108cell/L) of algal blooms was less than that of the control group,whereas the dry weight of P. pectinatus was not less than that of control group until the concentration of algal blooms reaches 1010cell/L. Compared with other treatments, the height of P. pectinatus was the shortest, while the height of E. nuttallii was the highest at the high concentration (1010cell/L) of algal blooms. It was showed that the photosynthetic activity of P. pectinatus decreased from 0.77 to 0.50 at the high concentration (1010cell/L) of algal blooms. However, the change of photosynthetic activity of E. nuttallii was not significant, ranging from 0.72 to 0.79. The antioxidant enzymes activity of submerged macrophytes decreased with increasing amount of algal blooms. These studies suggest that the effect of algal blooms on the growth of aquatic plants is dose-dependent. Although submerged plants can tolerate short-term stress of low concentrations of algal blooms, the high concentrations of algal blooms affect the resistance physiology of submerged macrophytes. The high concentrations of algal blooms greatly affect the growth of submerged plants over a long time, thereby affecting the restoration of submerged vegetations.
algal blooms;submerged macrophytes;growth
X172
A
1000-6923(2016)09-2765-09
2016-01-08
水专项(2013ZX0712-005);国家自然基金(31370472);FEBL项目(2016FBZ07)
* 责任作者, 副研究员, ligb@ihb.ac.cn
代亮亮(1991-),男,贵州安顺人,中国科学院水生生物研究所硕士研究生,主要从事藻类环境生物学研究.
