N2H4抑制好氧氨氧化及亚硝酸盐氧化动力学参数
2016-12-01肖芃颖张代钧重庆理工大学化学化工学院重庆400054重庆大学煤矿灾害动力学与控制国家重点实验室重庆40000重庆工程职业技术学院矿业与环境工程学院重庆40007
肖芃颖,张代钧,蔡 庆(1.重庆理工大学化学化工学院,重庆 400054;.重庆大学煤矿灾害动力学与控制国家重点实验室,重庆 40000;.重庆工程职业技术学院,矿业与环境工程学院,重庆 40007)
N2H4抑制好氧氨氧化及亚硝酸盐氧化动力学参数
肖芃颖1*,张代钧2,蔡 庆3(1.重庆理工大学化学化工学院,重庆 400054;2.重庆大学煤矿灾害动力学与控制国家重点实验室,重庆 400030;3.重庆工程职业技术学院,矿业与环境工程学院,重庆 400037)
为联氨(N2H4)强化全自养脱氮(CANON, completely autotrophic nitrogen removal over nitrite)工艺性能研究提供基础数据,本研究将好氧氨氧化过程动力学表达分为两步,于氨(NH4+)氧化生成羟胺(NH2OH)步添加启动函数ae-bSNH2OH用于模拟好氧氨氧化启动加速阶段,建立N2H4抑制好氧氨氧化与亚硝酸盐(NO2-)氧化过程动力学模型;采用呼吸测量法进行硝化污泥呼吸批次试验,分别得到 NH2OH氧化生成NO2-和NH4+氧化生成NO2-的好氧氨氧化菌(AOB)产率系数[YN H2OH=(0.437±0.129)mgCOD/mgN,YNH4+=(0.324±0.0123)mgCOD/mgN]及亚硝酸盐氧化菌(NOB)产率系数[YNO=(0.222±0.0112)mgCOD/mgN];基于N2H4抑制动力学模型模拟硝化污泥外源性呼吸剖面线首次得到N2H4好氧氧化半饱和常数[KS,N2H4=(7.96±0.811)mgN/L],N2H4抑制好氧氨氧化和亚硝酸盐氧化的动力学常数[KI,HON=(7.88±0.783)mgN/L, KI,NO=(1.223±0.555)mgN/L].
N2H4;好氧氨氧化;亚硝酸盐氧化;呼吸测量;动力学参数估计
联氨(N2H4)作为厌氧氨氧化菌(AnAOB)代谢中间产物,能够强化厌氧氨氧化[1-2].但是,在全自营养脱氮(CANON)系统中,投加微量N2H4对好氧氨(NH4+)氧化及亚硝酸盐(NO2-)氧化存在抑制作用[3].N2H4抑制好氧氨氧化及亚硝酸盐氧化动力学类型分别为竞争性与非竞争性[4].添加N2H4抑制纯培养硝化细菌菌株发现,抑制75%好氧氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)活性的N2H4浓度分别为1.8×10-3mol和1.5×10-3mol,N2H4对 NOB的毒性作用较 AOB相比更为强烈
[5].
呼吸测量方法已被广泛运用于废水生物处理过程动态监测及动力学参数的测定[6-10],也被利用于定量评估基质毒性或者研究抑制动力学等[11-12].本研究采用呼吸测量方法进行硝化污泥呼吸批次试验,研究微量 N2H4抑制好氧氨氧化及亚硝酸盐氧化动力学参数估计,为微量N2H4强化CANON过程动力学,优化CANON反应器运行参数与条件提供基础数据,即通过控制CANON系统内N2H4水平,强化厌氧氨氧化 (ANAMMOX) 和抑制亚硝酸盐氧化同时降低对好氧氨氧化的负面影响,提高CANON反应器脱氮性能.
1 材料与方法
1.1 试验装置,污水及污泥
呼吸试验污泥取自实验室稳定运行的硝化序批式反应器(SBR). 反应器以(NH4)2SO4为基质,NaHCO3为无机碳源,C:N:P为 65:5:1[13]配制合成废水. 1L合成废水加入1mL微量元素液,微量元素液主要组分为:ZnSO4·7H2O,0.43g/L; CoCl2·6H2O,0.24g/L;FeSO4·7H2O,5.0g/L;CaCl2· 2H2O,4.2g/L;MnCl2·4H2O,0.99g/L;CuSO4·5H2O,0.25g/L;MgSO4·7H2O,5.0g/L;(NH4)6Mo7O24·4H2O,1.1g/L;NiSO4.6H2O,0.21g/L;H3BO4,0.014g/L;EDTA,15.0g/L.硝化SBR运行过程pH只通过在配水中加入NaHCO3控制在7.0~8.5范围内, DO浓度通过转子流量计控制空气曝气速率保持≥2mg/L,水浴加热使反应器内温度保持在(25±1)℃.
1.2 呼吸批次试验
本研究呼吸试验中氧消耗速率(OUR)由实验室自行研发的新型混合呼吸测量仪[9]测定.设计9组呼吸批次试验,表1为试验条件.为保证试验结果稳定可靠,每次呼吸试验开始前向反应池中加入硝化反应器出水阶段污泥,打开呼吸测量仪好氧曝气至硝化污泥进行稳定內源呼吸后开始试验.呼吸试验过程中,分别加入0.35gNaHCO3,0.25mLKH2PO4储备液和0.5mL微量元素溶液及每组试验对应的基质与抑制剂.呼吸试验过程保持DO浓度≥4mg/L;初始pH值通过滴加1mol/L的HCl或NaOH调节为7.5±0.5;温度通过呼吸仪装置水浴加热功能控制在(26±0.5)℃.
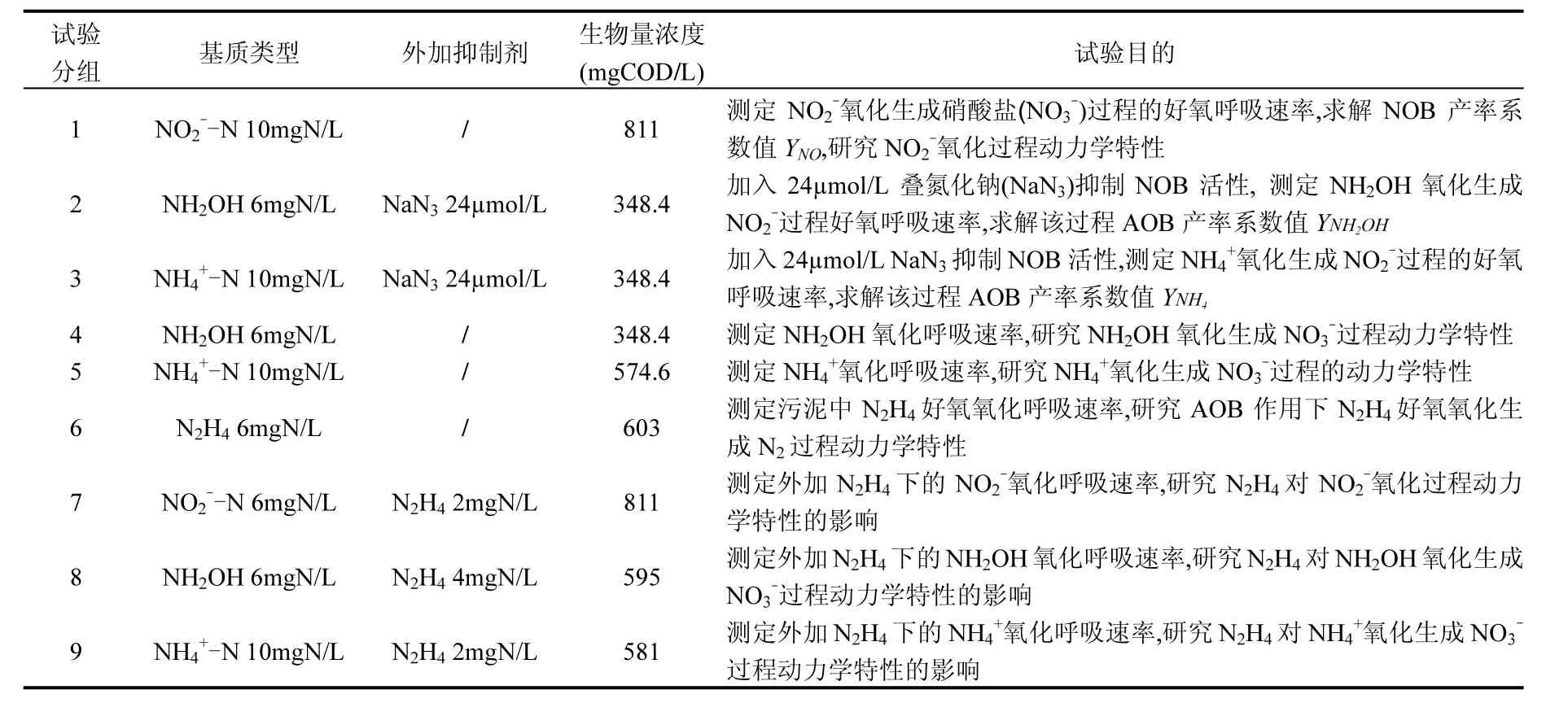
表1 呼吸批次试验条件Table 1 Respirometric experimental conditions
1.3 动力学模型建立
好氧氨氧化过程是在氨单加氧酶(AMO)和羟胺氧化还原酶(HAO)催化作用下进行的两步生物反应过程:AMO催化 NH4+氧化为羟胺(NHOH), HAO进一步催化NHOH氧化为NO-.
222后一步反应过程释放的4个电子中,一部分回流至AMO酶为NH4+氧化分步提供能量,另一部分则用于维持细胞合成[14-15].Chandran等[7]通过硝化污泥间歇试验证明好氧氨氧化过程中,NH4+氧化分步与 NH2OH氧化分步紧密相连,其假设催化NH2OH氧化过程的HAO酶通过提供一个驱动AMO酶活性的还原当量致使AMO能够最大程度加速催化NH4+氧化分步的进行.已有学者提出将好氧氨氧化过程动力学考虑为与NH2OH关联的两步表达形式[16].本研究基于上述文献分析,结合实验视角,于NH4+氧化生成NH2OH过程动力学表达中添加一项启动函数ae-bSNH2OH模拟好氧氨氧化过程启动加速阶段,建立好氧氨氧化两步及亚硝酸氧化动力学模型(见表2).好氧氨氧化初始阶段,SNH OH=0mgN/L,此时ae-bSNH2OH=a (a≠0)
2为一个常数,NH4+氧化生成NH2OH过程启动;随着 反 应 进 行 ,SNH2OH≠0mgN/L,a e-bSNH2OH<a,NH2OH 浓度增加,ae -bSNH2OH值逐渐减小,此时NH4+氧化分步速率受 NH2OH氧化分步速率的影响;当NH2OH浓度累积足够大时,ae -bSNH2OH趋近于0.在此基础上,基于N2H4竞争性抑制好氧氨氧化以及非竞争性亚硝酸盐氧化[4],建立N2H4抑制好氧氨氧化及亚硝酸盐氧化过程动力学模型(见表 3).采用 AQUASIM软件[17]进行模型拟合及动力学参数估计.

表2 未添加N2H4下好氧氨氧化及亚硝酸盐氧化动力学模型Table 2 Kinetics models of aerobic ammonium oxidation and nitrite oxidation without N2H4addition
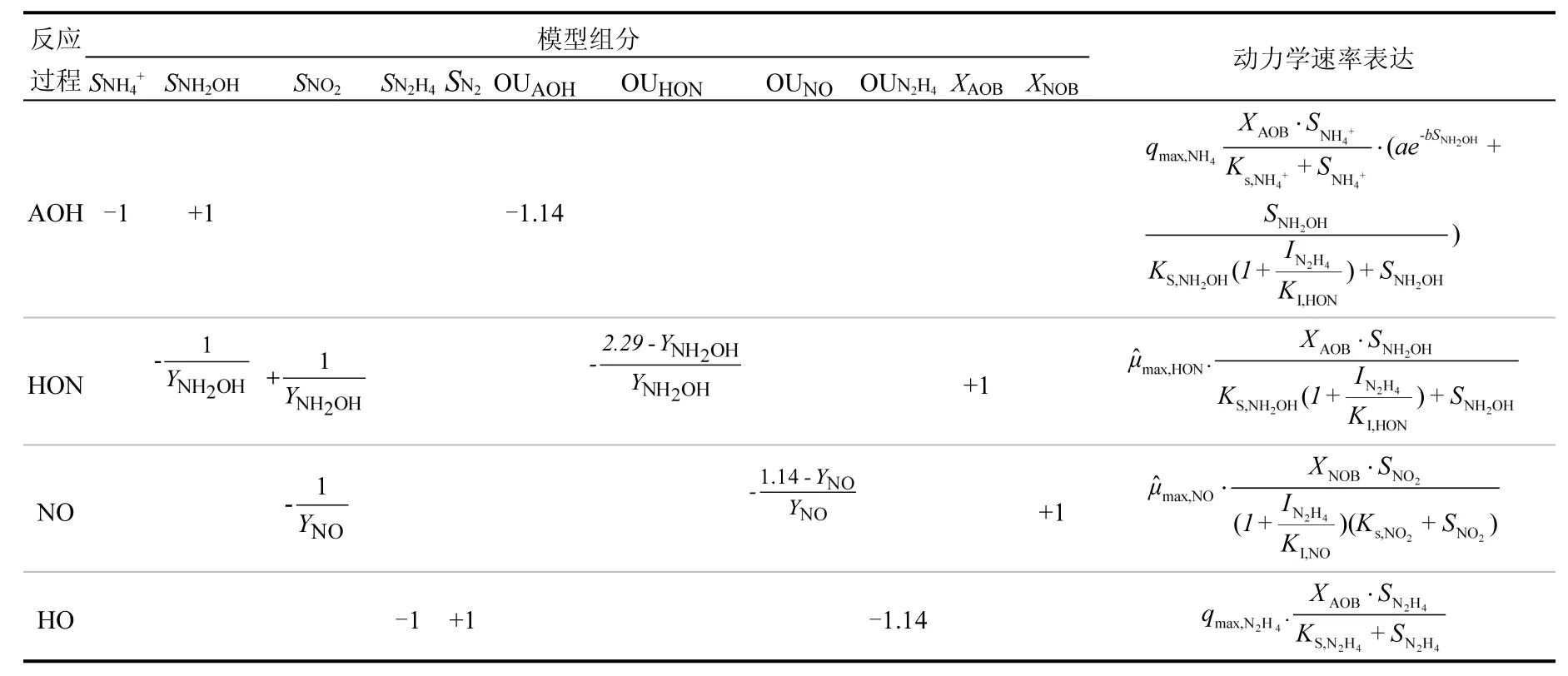
表3 添加N2H4下好氧氨氧化及亚硝酸盐氧化动力学模型Table 3 Kinetics models of aerobic erobic ammonium oxidation and nitrite oxidation with N2H4addition
1.4 取样与分析
呼吸批次试验的外源OUR值等于呼吸测量仪测得的总OUR值减去內源OUR值.每组呼吸试验均重复3次.每组呼吸试验测定的挥发性污泥浓度(MLVSS)用于表征试验污泥的总生物量浓度,每组呼吸试验的AOB或NOB生物量浓度(XAOB,XNOB)根据已测得的总生物量浓度参照文献[18]报道的方法估算求得(表 1).模型模拟依据表1中试验顺序进行.
2 结果与讨论
2.1 模型模拟及参数估计
基于呼吸试验1,2,3所得外源性OUR曲线,参考文献[19]报道的方法,得到 NH4+氧化生成NO2-过程与NH2OH氧化生成NO2-过程的AOB产率系数(YNH4+,YNH2OH), NOB产率系数YNO,模拟硝化污泥批次试验外源呼吸剖面线得到各反应过程动力学参数估计值均见表4所示.图1为实测与拟合的OUR剖面线.
其中,图1(a)~图1(c)表示未添加N2H4下好氧氨氧化及亚硝酸盐氧化过程外源性OUR曲线:图1(a)为NO-氧化过程;图1(b)为NHOH氧化生成NO-
223过程;图1(c)为NH4+氧化生成NO3-过程.图1(d)~图1(g)表示添加 N2H4下好氧氨氧化及亚硝酸盐氧化过程外源性OUR曲线:图1(d)为N2H4好氧氧化过程;图1(e)为N2H4影响下NO2-氧化过程;图1(f)为N2H4影响下NH2OH氧化生成NO3-过程;图1(g)为N2H4影响下NH4+氧化生成NO3-过程.
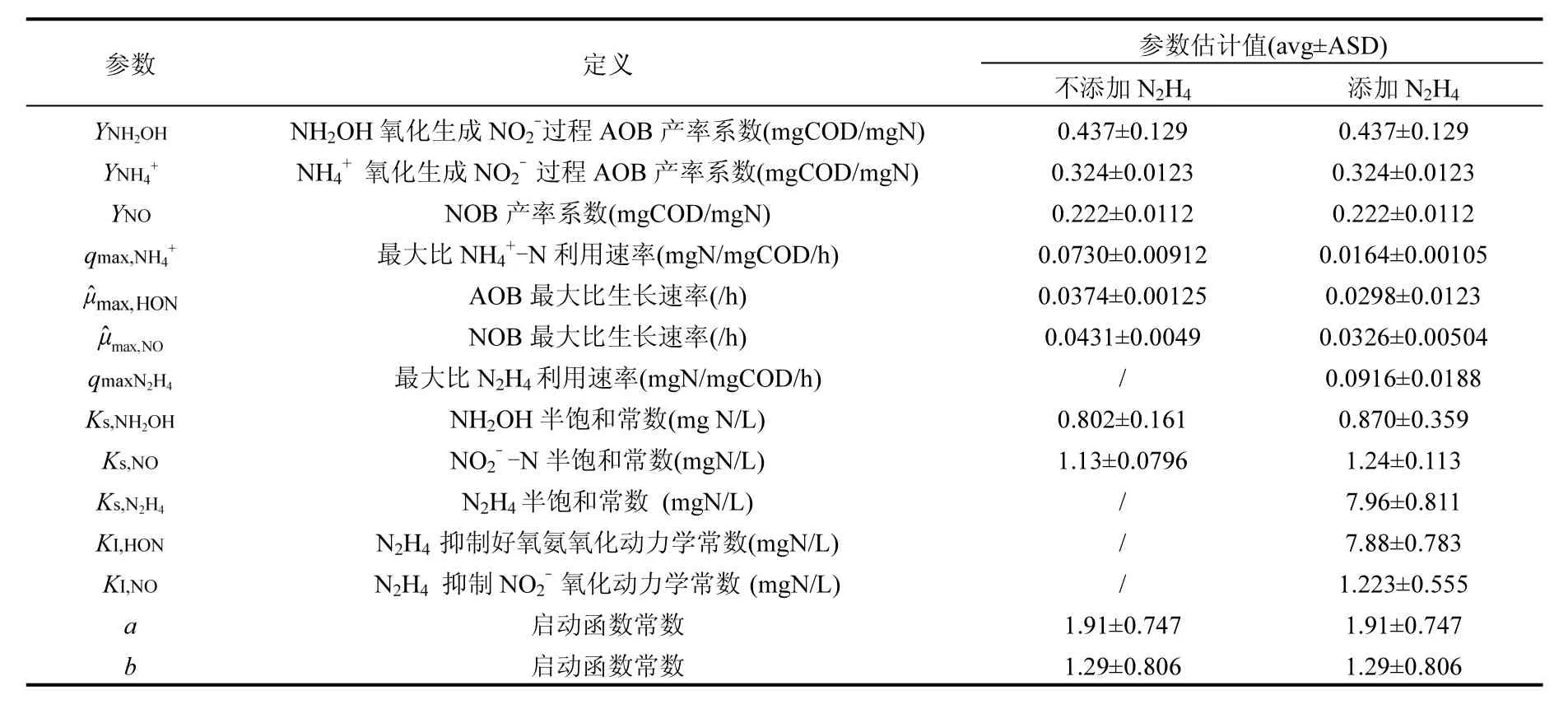
表4 计量学及动力学参数估计值Table 4 Estimated stoichiometry and kinetics parameters
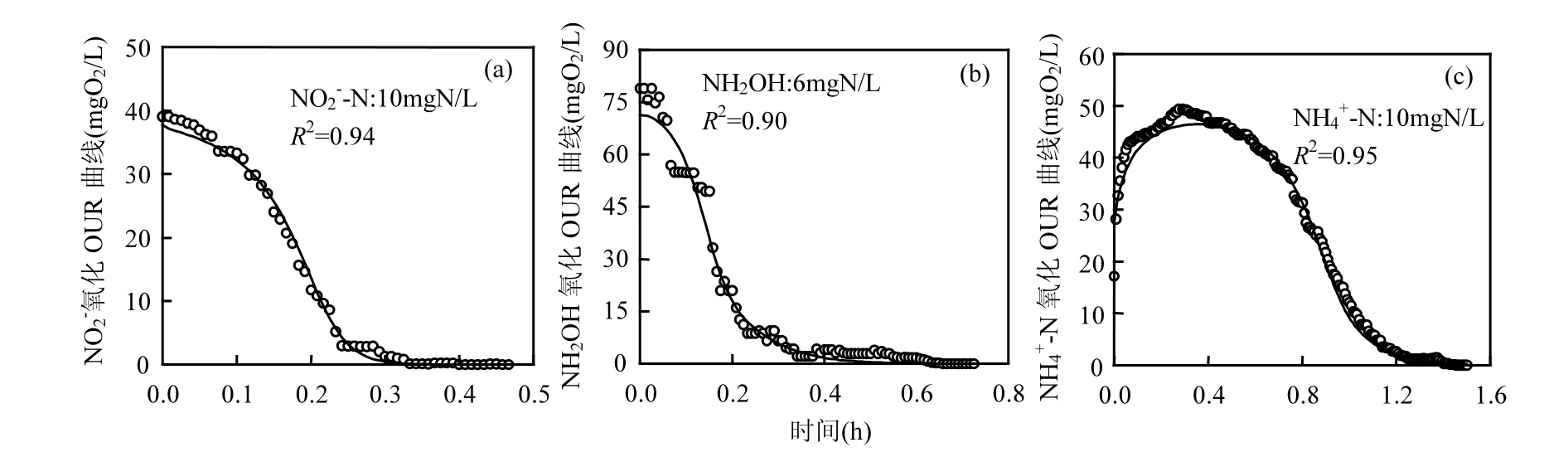
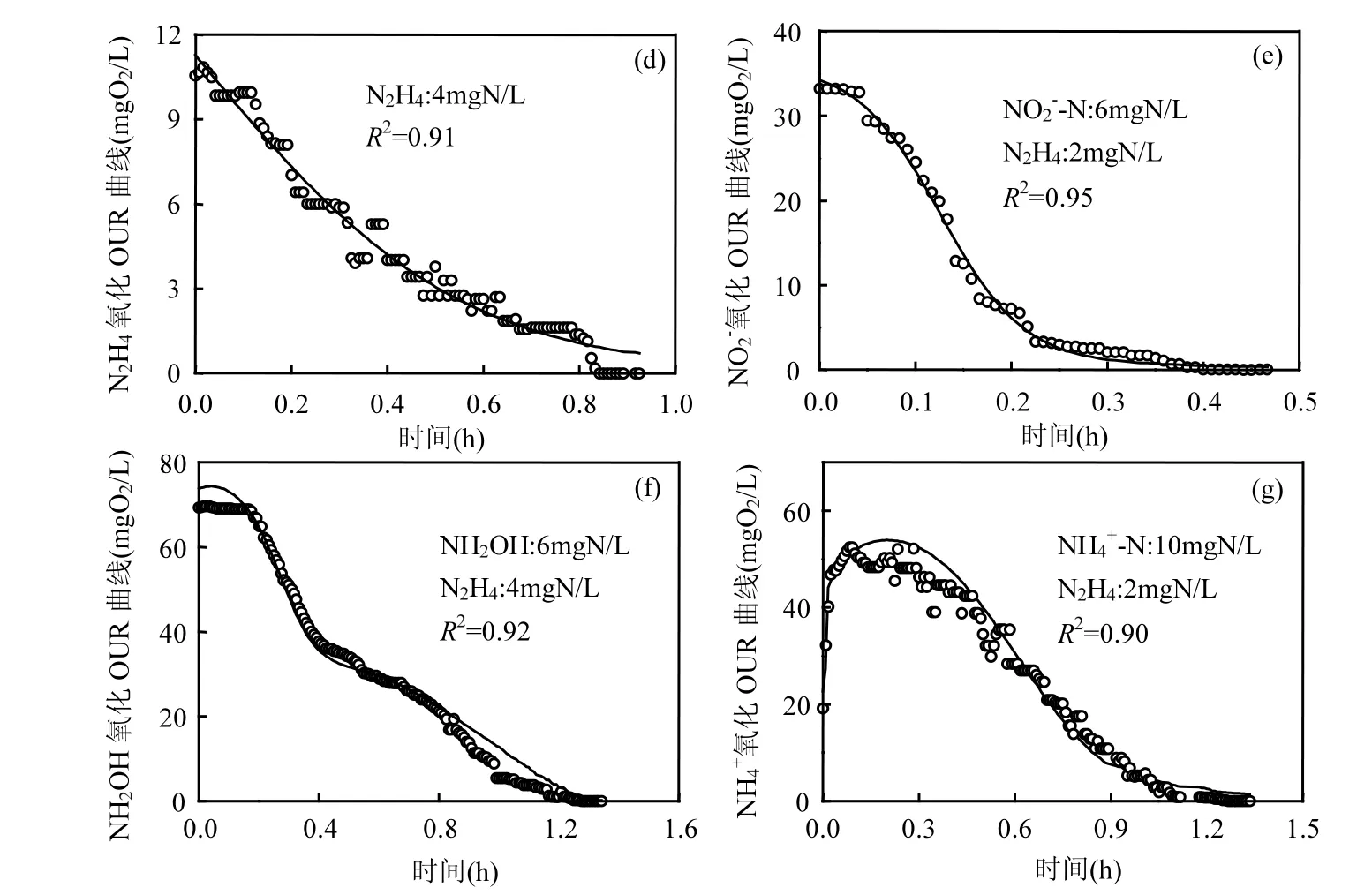
图1 实测及模拟的呼吸批次试验外源性OUR曲线Fig.1 Measured and simulated exogenous OUR profiles for respirometric tests

2.2 参数估计值分析
本研究将好氧氨氧化过程分为两步,基于呼吸测量法分别得到NH2OH氧化为NO2-和NH4+氧化为NO2-的AOB产率系数YNH2OH和YNH4+(表4).YNH4+
值虽大于文献报道的范围(0.03~0.13mgVSS/mgN)[20],但与其余部分报道结果在同一浓度水平[8,18].本研究YNH2OH值与Ni等[15]报道的结果在同一浓度水平.NOB产率系数YNO(表4)与 Sharma等[21]报道的 0.1mgCOD/ mgNOD(0.114mgCOD/mgN)这一结果在同一浓度水平,但大于文献报道的范围(0.02~ 0.07mgVSS/ mgN)[22].理论上AOB和NOB的实际产率是一个较为稳定的值,若微生物生长环境存在差异,会导致分配于细胞生长和维持细胞代谢的能量有所不同,测得的表观产率系数就会在很大的范围内波动[22].本研究采用较高浓度的 NH4+-N(500mgN/L)基质运行硝化反应器,致使富集的AOB及 NOB可能在分解代谢中获得的能量大部分用于了细胞生长,少部分利用于维持细胞代谢,故测得的细菌细胞产率系数略高于文献报道值.当NH2OH替代NH4+-N作为基质时,由于缺少 AMO活性,使得呼吸过程中可以获得更多NH2OH氧化途径产生的有效电子[7].因此本研究中YNH2OH值大于YNH4+值,NH4+-N为基质的好氧氨氧化过程存在NH2OH的部分流失.
添加N2H4前后,NH4+氧化生成NH2OH过程的最大比 NH4+-N 利用速率 qmax,NH4均小于Chandran等[18]报道的结果.微生物自身生长条件(如温度,碱度等对于微生物生长影响较直接的因素),污泥微生物用于保持细胞活性所需能量的不同均会导致微生物比生长速率出现差异[23].好氧氨氧化过程添加 N2H4,竞争性抑制 NH2OH氧化,导致NH2OH累积减少了回流至NH4+氧化分步的电子,间接抑制了AMO活性,最终降低NH4+氧化速率[24].由表4可以看出,添加N2H4后的qmax,NH4+小于未添加N2H4条件下的该参数估计值, NH2OH氧化生成NO2-过程的AOB最大比生长速率 µˆmax,HON值均在文献报道范围内(0.019~0.092h-1)[20,25],添加 N2H4后的 µˆmax,HON值略小于未添加 NH时的该参数估计值;NO-氧
242
化过程的NOB最大比生长速率 µˆmax,NO值均在文献报道范围内(0.012~0.06h-1)[26];N2H4非竞争性抑制NO2-氧化,微生物比生长速率降低,故添加N2H4后的 µˆmax,NO值小于未添加 N2H4时的该参数估计值.
本研究添加 N2H4前后,好氧氨氧化两步生物反应过程的NH2OH半饱和常数KS,NH2OH分别为(0.802±0.161)mgN/L 和(0.870±0.359)mgN/L,均小于Ni等[16]报道的结果,但大于Chandran等[7]报道的 NH2OH半饱和常数估算值.NO2-氧化过程的NO2--N 半饱和常数 KS,NO2分别为(1.13± 0.0796) mgN/L和(1.24±0.113) mgN/L,均小于Wiesmann[27]报道的结果,但大于 Chandran等[19]报 道 的 NO2--N 半 饱 和 常 数 值 [(0.73± 0.1)mgNOD/L,即(0.64±0.09) mgN/L].
AOB及 NOB生长的动力学参数值波动范围广泛,反应器运行条件及废水性质的不同均会造成微生物生长环境相异,影响微生物反应过程各动力学参数的测定及模拟结果[24].本研究目的是为了更好阐述 N2H4对高 NH4+-N条件下CANON系统中好氧氨氧化及亚硝酸盐氧化动力学特性的影响,所以运行高 NH4+-N硝化反应器富集AOB和NOB,致使本研究中部分动力学参数估计值与文献报道结果有所区别.理论上,N2H4竞争性抑制好氧氨氧化,添加N2H4前后的 µˆ 不变,KS,NHOH变小;非竞争性抑制NO-
max,HON22氧化,添加N2H4前后的 µˆ 变小,KS,NO不变[28].
max,NO2但是本研究实际模拟的上述动力学参数估计值与理论分析不尽相同,可能的原因是:本研究中呼吸试验过程外加N2H4抑制剂浓度与基质浓度接近,使得抑制剂浓度相对较高,过分抑制了基质氧化过程,给相关动力学参数估计带来一定误差.
本研究首次模拟得到N2H4抑制好氧氨氧化和亚硝酸盐氧化过程动力学常数KI,HON, KI,NO以及N2H4好氧氧化过程半饱和常数KS,N2H4与最大比N2H4利用速率qmax,N2H4的估计值(表4),为N2H4在强化CANON过程中的应用提供了基础数据.有研究报道部分亚硝化过程中出现N2H4浓度增加的现象,推测与 AOB生长代谢过程有关,AnAOB可能不是N2H4产生的唯一来源[29].N2H4影响AOB细胞生长有待进一步研究.
本研究在NH4+氧化生成NH2OH过程动力学表达式中添加启动函数 ae-bSNH2OH,基于动力学参数灵敏度分析结果[30]可知,启动函数中常数a,b对N2H4抑制条件下NH4+氧化生成NH2OH过程动力学模拟没有显著影响.所以,添加 N2H4条件下,启动函数中的 a,b常数作为经验值直接引用未添加N2H4下的结果(见表4).启动函数的提出为硝化及 CANON过程的动力学研究提供基础数据和新思路.
3 结论
3.1 将好氧氨氧化过程动力学表达分为两步,于NH4+氧化生成NH2OH过程动力学表达式中添加启动函数ae-bSNH2OH模拟好氧氨氧化过程启动加速阶段,建立 N2H4抑制好氧氨氧化及亚硝酸盐氧化动力学模型.
3.2 采用呼吸测量法得到NH2OH氧化为NO2-和NH4+氧化为NO2-的 AOB产率系数 YNH2OH,YNH4+分别为(0.437±0.129)mgCOD/mgN和(0.324± 0.0123)mgCOD/mgN,以及 NOB产率系数 YNO=(0.222±0.0112) mgCOD/mgN.
3.3 基于 N2H4抑制动力学模型,拟合硝化污泥外源性呼吸剖面线,首次获得以下动力学参数估计值:N2H4好氧氧化过程的N2H4半饱和常数 KS,N2H4
=(7.96±0.811)mgN/L,最大比 N2H4利用速率 qmax,N2H4=(0.0916±0.0188)mgN/mgCOD/ h,N2H4抑制好氧氨氧化和亚硝酸盐氧化过程动力学抑制常数 KI,HON=(7.88±0.783)mgN/L,KI,NO=(1.223±0.555)mgN/L,以及启动函数常数a=1.91± 0.747, b=1.29±0.806.
[1] Zakker I, Kroon K, Rikmann E, et al. Accelerating effect of hydroxylamine and hydrazine on nitrogen removal rate in moving bed biofilm reactor [J]. Biodegradation, 2012,23(5):739—749.
[2] Yao Z B, Zhang D J, Xiao P Y, et al. Long-term addition of micro-amounts of hydrazine enhances nitrogen removal and reduces NO and NO3−production in a SBR performing Anammox[J]. Journal of Chemical Technology and Biotechnology, 2016,91(2):514—521.
[3] Yao Z B, Cai Q, Zhang D J, et al. The enhancement of completely autotrophic nitrogen removal over nitrite (CANON) by N2H4addition [J]. Bioresource Technology, 2013,146(10):591—596.
[4] 肖芃颖,张代钧,姚宗豹,等.N2H4抑制好氧氨氧化及亚硝酸盐氧化动力学类型 [J]. 环境工程学报, 2015,9(2):513—518.
[5] Tomlinson T G, Boon A G and Trotman C N A. Inhibition of nitrification in the activated sludge process of sewage disposal [J]. Journal of Applied Microbiology, 1966,29(2):266—291.
[6] Guisasola A, Jubany I, Baeza J A, et al. Respirometric estimation of the oxygen affinity constants for biological ammonium and nitrite oxidation [J]. Journal of Chemical Technology and Biotechnology, 2005,80(4):388—396.
[7] Chandran K, Smets B F. Biokinetic characterization of the acceleration phase in autotrophic ammonia oxidation [J]. Water Environment Research: a research publication of the Water Environment Federation, 2008,80(8):732—739.
[8] Fang F, Ni B J, Li X Y, et al. Kinetic analysis on the two-step processes of AOB and NOB in aerobic nitrifying granules [J]. Applied Microbiology and Biotechnology, 2009,83(6):1159—1169.
[9] 张 欣,张代钧,卢培利,等.应用呼吸-滴定测量监测硝化动态过程 [J]. 中国环境科学, 2010,30(10):1316—1322.
[10] 张 欣,张代钧,张 天.基于HPR在线监测控制SBR曝气历时实现短程脱氮 [J]. 中国环境科学, 2014,34(3):617-622.
[11] King E F, Dutka B J. Respirometric techniques [A].//Bitton G,Dutka BJ.Toxicity Testing Using Microorganisms [C]. Florida:CRC Press, 1986:75—113.
[12] Kong Z, Vanrolleghem P A and Verstraete W. An activated sludge-based biosensor for rapid IC50estimation and on-line toxicity monitoring [J]. Biosensors and Bioelectronics, 1993,8(1):49—58.
[13] Bollmann A, French E, Laanbroek H J. Isolation, cultivation, and characterization of ammonia-oxidizing bacteria and archaea adapted to low ammonium concentrations [J]. Methods in Enzymology, 2011,486:55—88.
[14] Hooper A B, Vannelli T, Bergmann D J, et al. Enzymology of the Oxidation of Ammonia to Nitrite by Bacteria. Antonie van Leeuwenhoek, 1997,71(1/2):59—67.
[15] Hooper A B. Biochemistry of the Nitrifying Lithoautotrophic Bacteria [J]. Autotrophic Bacteria, 1989,239—265.
[16] Ni B J, Ruscalleda M, Pellicer-Nacher C, et al. Modeling nitrous oxide production during biological nitrogen removal via nitrification and denitrification: extensions to the general ASM models [J]. Environmental Science and Technology, 2011,45(18):7768—7776.
[17] Reichert P. Aquasim 2.0-user manual, computer program for the identification and simulation of aquatic systems [M]. Swizerland:Swiss Federal Institute for Environmental Science and Technology (EAWAG), 1998:137—151.
[18] Chandran K, Smets B F. Single-step nitrification models erroneously describe batch ammonia oxidation profiles when nitrite oxidation becomes rate limiting [J]. Biotechnology and Bioengineering, 2000,68(4):396—406.
[19] Chandran K, Smets B F. Estimating biomass yield coefficients for autotrophic ammonia and nitrite oxidation from batch respirograms [J]. Water Research, 2001,35(13):3153—3156.
[20] De Kreuk M K, Picioreanu C, Hosseini M, et al. Kinetic model of a granular sludge SBR: influences on nutrient removal [J]. Biotechnology and Bioengineering, 2007,97(4):801—815.
[21] Sharma B, Ahlert R C. Nitrification and nitrogen removal [J]. Water Research, 1977,11(10):897—925.
[22] Vadivelu V M, Yuan Z, Fux C, et al. Stoichiometric and kinetic characterisation of Nitrobacter in mixed culture by decoupling the growth and energy generation processes [J]. Biotechnology and Bioengineering, 2006,94(6):1176—1188.
[23] Lackner S, Smets B F. Effect of the kinetics of ammonium and nitrite oxidation on nitritation success or failure for different biofilm reactor geometries [J]. Biochemical Engineering Journal,2012,69:123—129.
[24] Anderson J H. Studies on the oxidation of ammonia by Nitrosomonas [J]. Biochemical Journal, 1965,95:688—698.
[25] Moussa M S, Hooijmans C M, Lubberding H J, et al. Modelling nitrification, heterotrophic growth and predation in activated sludge [J]. Water research, 2005,39(20):5080—5098.
[26] Jubany I, Baeza J A, Carrera J, et al. Respirometric calibration and validation of a biological nitrite oxidation model including biomass growth and substrate inhibition [J]. Water Research, 2005,39(18):4574—4584.
[27] Wiesmann U. Biological nitrogen removal from wastewater [J]. Advances in Biochemical Engineering/biotechnology,1994,51(51):113—154.
[28] Bruce E R, Perry L M.环境生物技术:原理与应用 [M]. 北京:清华大学出版社, 2002.
[29] Choi J, Jung S, Ahn Y H. Increased hydrazine during partial nitritation process in upflow air-lift reactor fed with supernatant of anaerobic digester effluent [J]. Korean Journal of Chemical Engineering, 2013,30(6):1235—1240.
[30] 肖芃颖.外加微量联氨影响全自养脱氮的机制:功能微生物群落与N2O产生 [D]. 重庆:重庆大学, 2014.
致谢:本论文的动力学模拟由重庆工程职业技术学院蔡庆博士协助完成,在此表示感谢;同时也感谢重庆大学卢培利教授、姚宗豹博士、彭淑婵博士、曾善文博士等在实验中给予的帮助.
Respirometric estimation of kinetics parameters for ammonium and nitrite oxidation under inhibition by N2H4.
XIAO Peng-ying1*, ZHANG Di-jun2, CAI Qing3(1.School of Chemical Engineering, Chongqing University of Technology, Chongqing 400054, China;2.State Key Laboratory of Coal Mine Disaster Dynamics and Control, Chongqing University, Chongqing 400030, China;3.Mining and Environmental Engineering, Chongqing Vocational Institute of Engineering, Chongqing 400037, China). China Environmental Science, 2016,36(9):2709~2715
The kinetic of CANON (completely autotrophic nitrogen removal over nitrite) process strengthened by trace hydrazine (N2H4) was investigated to provide fundamental data for further research and engineering application. Aerobic ammonium (NH4+) oxidation was divided into two steps, NH4+oxidation to hydroxylamine step and hydroxylamine oxidation to nitrite step, and a startup function ae-bSNH2OHwas added to the former step to describe the kinetic process of statup phase. Kinetics models for NH4+and nitrite (NO2-) oxidation under N2H4inhibition was established and calibrated with the oxygen uptake rate (OUR) obtained in the respirometric tests. The biomass yield coefficients of AOB for NH2OH oxidation to NO2-(YN H2OH) and NH4+oxidation to NO2-(YNH4+) are estimated as (0.437±0.129)mgCOD/mgN and(0.324±0.0123)mgCOD/mgN, respectively. The biomass yield coefficient of NOB (YNO) is estimated as(0.222±0.0112)mgCOD/mgN. The half-saturation coefficient for N2H4oxidation [KS,N2H4=(7.96±0.811)mgN/L], and kinitic inhibitor coefficients for NH4+and NO2-oxidation by N2H4[KI,HON=(7.88±0.783)mgN/L,KI,NO=(1.223± 0.555)mgN/L, respectively] were first obtained by simulating the exogenous OUR profiles obtained in respirometric tests of nitrifying sludge at first time.
N2H4;ammonium oxidation;nitrite oxidation;respirometry;kinetics parameters estimation
X703
A
1000-6923(2016)09-2709-07
2016-01-19
重庆市自然科学基金(CSTC2013JJB20002);重庆理工大学科研启动项目(2014ZD36);重庆理工大学科研星火计划项目(2015XH22)
* 责任作者, 讲师, xiaopengying36@163.com
肖芃颖(1987-),女,重庆涪陵人,讲师,博士,主要从事废水生物处理技术等研究.发表论文8篇.
