稳定表达人源α2A-肾上腺素受体细胞系的建立
2016-12-01李玉蕾周培岚苏瑞斌宫泽辉
杨 怿,李玉蕾,刘 梦,周培岚,苏瑞斌,宫泽辉
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850)
·实验方法·
稳定表达人源α2A-肾上腺素受体细胞系的建立
杨 怿,李玉蕾,刘 梦,周培岚,苏瑞斌,宫泽辉
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850)
目的建立稳定表达人源α2A-肾上腺素能受体(α2A-AR)的细胞系。方法将带有潮霉素B(Hygro)抗性的α2A-AR(pcDNA3.1/Hygro-HA-α2A-AR)重组质粒通过脂质体介导转染至已表达增强型绿色荧光蛋白(EGFP)标记的蛋白激酶A催化亚基(PKAcat)的中国仓鼠卵巢(CHO)细胞(以Hygro 200 mg·L-1进行压力筛选后,采用PKA重分布实验筛选阳性克隆),然后使用实时定量PCR验证α2A-AR受体在转录水平的表达,最后以时间分辨荧光共振能量转移免疫实验检测cAMP含量以鉴定受体功能。结果PKA重分布实验结果表明,CHO-PKAcat-α2A-AR 7号克隆反应性良好;与CHO-PKAcat-EGFP细胞相比,该细胞系α2A-AR mRNA表达水平较高(P<0.01),且多次传代能保持稳定;在α2A-AR激动剂作用后,能显著抑制forskolin引起的cAMP水平升高(P<0.01)。结论成功构建稳定表达α2A-AR的CHO-PKAcat-α2A-AR细胞系,可用于药物筛选及机制研究。
中国仓鼠卵巢细胞;受体,肾上腺素α2A;蛋白激酶A;cAMP
位于交感神经节前和节后的α-肾上腺素受体(α-adrenoceptor,α-AR)对一系列激动剂或拮抗剂表现不同效应,其分型包括α1-AR和α2-AR。α2-AR主要分布于突触前,在中枢和外周神经系统的肾上腺素和非肾上腺素能神经元上反馈调节递质释放[1],进而介导多种生理或药理作用。基因测序又将α2-AR分为3个亚型,分别位于10,2和4号染色体上,依次命名为α2A-AR,α2B-AR和α2C-AR[2]。目前已逐渐证实多数α2-AR激动剂的效应是由α2A-AR介导,如可乐定、右美托咪定(dexmedetomidine,DMED)、莫索尼定和利美尼定的降血压及心动过缓效应仅依赖于α2A-AR[3-4],而DMED在α2A-AR基因敲除小鼠模型上不再发挥镇痛效应[5-6]。α2A-AR的主导地位源自其在中枢和外周神经系统尤其是脑内广泛而大量的分布,如脑干、大脑皮质、下丘脑、海马、杏仁核、基底前脑和蓝斑等脑区[7-8]。目前对α2-AR 3个亚型的生理功能仍不完全清楚。尽管多数研究认为α2A-AR具有主要作用,但由于缺乏亚型选择性药物,尚无法排除α2B-AR和α2C-AR是否参与介导激动剂的作用,且无法深入分析α2A-AR调节生理功能的分子机制。近年来,靶向α2A-AR选择性配体的研究逐渐增加,但在动物模型上无法筛选受体亚型选择性配体。因此,必须在体外建立快速有效的药物筛选细胞模型,对于发现靶向α2A-AR的新药具有重要意义。α2A-AR是经典的A类G蛋白偶联受体,主要通过偶联并激活Gi/o蛋白产生生物学功能,激活α2A-AR后可抑制腺苷酸环化酶(adenylate cyclase,AC)活性,抑制三磷酸腺苷向环磷酸腺苷(cAMP)转化,进而抑制蛋白激酶A(protein kinase A,PKA)的活性[10],基于受体激活可以抑制AC-cAMP-PKA通路的原理,本研究拟在中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞上建立稳定表达人源α2A-AR的细胞系〔CHO-PKA催化亚基(PKAcat)-α2A-AR〕,用于靶向α2A-AR的药物筛选及分子机制研究。
1 材料与方法
1.1 药物、试剂和仪器
增强型绿色荧光蛋白(enhanced green fluo⁃rescent protein,EGFP)标记的CHO-PKAcat细胞(CHO-PKAcat-EGFP)由本研究所王莉莉教授提供;带有潮霉素B(hygromycin B,Hygro)抗性的质粒(pcDNA3.1/Hygro)由本研究所丛玉文教授惠赠;人源α2A-AR质粒购自北京西美杰科技有限公司;KOD FX高保真聚合酶购自东洋纺(上海)生物科技有限公司;质粒提取试剂盒、DNA凝胶回收试剂盒、E.coli DH5α菌株和D2000 DNA分子质量标志购自北京天根生化科技有限公司;Hygro购自瑞士Roche公司;F-12基础培养基(粉剂)购自美国Gibco公司;F-12液体培养基购自美国HyClone公司;T4DNA连接酶、RNA酶抑制剂、dNTP混合物和Oligo d(T)18引物购自日本TaKaRa公司;琼脂糖、脂质体LipofectaminTM2000、Hoechst33342、M-MLV逆转录酶和2×Power SYBR Green PCR Master Mix购自美国Life Technologies公司;LANCE cAMP 384试剂盒购自美国Perkin Elmer公司;forskolin购自美国Sigma Aldrich公司;限制性内切酶EcoRⅠ、XhoⅠ及HindⅢ购自美国Fermentas公司;DMED购自济南德信佳生物科技有限公司;美托咪定(medetomidine,MED)购自济南凤山恒坤化工科技有限公司。
凝胶成像仪购自美国KODAK公司;荧光定量PCR仪购自美国Applied Biosystems公司;Envision 2104 MultilabelReader购自美国Perkin Elmer公司;基因扩增仪购自北京东胜创新生物科技有限公司;In CellAnalyzer1000购自美国GE Healthcare公司。
1.2 pcDNA3.1/Hygro-HA-α2A-AR重组质粒构建
PCR法在α2A-AR基因片段引入酶切位点,引物序列正向:CGGAATTCATGCGTTCATGTTCC⁃GC;反向:CCTCGAGATCACACGATCCGCTTCC;扩增条件为:步骤1 94℃2 min;步骤2 94℃30 s;步骤3 65℃30 s;步骤4 72℃60 s;步骤5 72℃10 min,步骤2~4循环30次,琼脂糖凝胶电泳分离目的基因并进行凝胶回收,产物与pCMV-HA载体均用EcoRⅠ和XhoⅠ双酶切后进行连接并转化至E.coli DH5α感受态细菌,接种于固体LB培养基(氨苄青霉素抗性),挑取单克隆扩大培养并提取质粒,经EcoRⅠ和XhoⅠ双酶切验证,并对重组质粒进行目的基因测序比对。
PCR法获得带有酶切位点HindⅢ、XhoⅠ和HA标签的目的基因序列,引物序列正向:CAAGCTTGATGTACCCATACGATGTTC;反向:CCTCGAGATCACACGATCCGCTTCC;扩增条件同前。再对pcDNA3.1/Hygro载体与目的基因双酶切及连接,后续方法同上,重组质粒经酶切验证及测序比对。
1.3 脂质体法转染建立CHO-PKAcat-α2A-AR稳定表达细胞系
CHO-PKAcat-EGFP细胞接种至培养皿,用含有10%胎牛血清的F-12基础培养基培养,细胞密度达80%进行转染,先将LipofectamineTM2000与pcDNA3.1/Hygro-HA-α2A-AR重组质粒进行混合孵育,其后加入培养皿中转染。24 h后将培养基换成含有Hygro(200 mg·L-1)的培养基,抗生素压力筛选10 d,采用有限稀释法对细胞进行克隆化培养。
1.4 PKA重分布实验筛选阳性细胞株
细胞克隆接种到96孔板,待密度达80%时,用新鲜F-12培养基洗细胞1次,加入F-12培养基每孔100μL,先后加入激动剂DMED和forskolin每孔各50μL,至终浓度分别为10和100μmol·L-1,37℃培养箱中孵育10 min,每孔加入100μL 4%甲醛,室温固定20 min,PBS缓冲液洗细胞2次,每孔加入PBS配制的Hoechst33342(1μmol·L-1)100μL进行染色,避光反应30 min后用In CellAnalyzer 1000获取细胞荧光图像,利用多靶点分析模块进行分析,计算颗粒形成指数反映PKA重分布程度。颗粒形成指数=(颗粒荧光强度-背景荧光强度)×颗粒荧光总面积,受体功能活性(%)=(DMED组颗粒形成指数-forskolin组颗粒形成指数)/(对照组颗粒形成指数-forskolin组形成指数)×100%,筛选活性高的细胞株。
采用计算Z′因子的方法评价该细胞模型的可靠性,此法在评价高通量筛选、高内涵分析实验体系的稳定性和可靠性中应用广泛,公式为Z′=1-(3σc++3σc-)/|μc+-μc-|,式中σ为标准差,μ为平均值,c+为阳性对照,c-为阴性对照,当Z′在0.5~1之间时,说明体系稳定性,可靠性良好。事先将CHO-PKAcatα2A-AR细胞接种到96孔板,待细胞密度达80%时,用F-12基础培养基洗细胞(每孔100μL)。阴性对照组加入forskolin每孔50μL(终浓度10μmol·L-1),阳性对照组加入DMED每孔50μL(终浓度100 nmol·L-1)与forskolin每孔50μL(终浓度10μmol·L-1)共孵育,加入F-12培养基补足反应体系200μL,培养箱中孵育10 min,加入甲醛(终浓度4%)孵育20 min,PBS缓冲液洗细胞2次,加入PBS配制的Hoechst33342(1μmol·L-1)进行染色,避光反应30 min后利用In CellAnalyzer 1000获取细胞图像。重复3次实验,计算各组的颗粒形成指数,按公式计算Z′因子。
1.5 实时定量-PCR检测α2A-AR mRNA水平
细胞接种于6孔板中,细胞密度达90%后,用Trizol法提取细胞总RNA,以CHO-PKAcat-EGFP细胞为对照,以总RNA为模板,按如下体系反应:总RNA1.5μg,5×逆转录酶缓冲液4μL,dNTP混合物(10 mmol·L-1)2μL,RNA酶抑制剂(20 U)0.5μL,Oligo dT(18)引物(50 pmol)1μL,M-MLV逆转录酶0.75μL,加无RNA酶的水至总体积20μL。反应条件:42℃1 h,70℃5 min,逆转录合成α2A-AR的cDNA。
qRT-PCR反应体系为:模板cDNA 0.6μL,无RNA酶的H2O 4.0μL,2×Power SYBR Green PCR Master Mix 5μL,上下游引物(10μmol·L-1)各0.2μL。人α2A-AR引物序列正向:GTCGTGCATC⁃GGCTCCTT;反向:CGACGCTTGGCGATCTG。大鼠β肌动蛋白引物序列正向:CGCCAGGTCAT⁃CACTATTG;反向:CAGGTCTTTACGGATGT⁃CAAC。反应条件为:95℃2 min;95℃15 s,62℃10 s,70℃30 s,40个循环;72℃5 min。
反应结束后获得2株细胞相关基因的Ct值,通过内参基因β肌动蛋白得出α2A-AR的相对表达量△Ct,然后计算2株细胞间α2A-AR的△△Ct,最后采用2-△△Ct法计算CHO-PKAcat-α2A-AR和CHOPKAcat-EGFP细胞间的α2A-AR表达差异。
1.6 检测cAMP含量验证CHO-PKAcat-α2A-AR中的受体功能
使用LANCE cAMP 384试剂盒检测胞内cAMP含量,实验基于一个竞争免疫反应,铕标的cAMP示踪复合物与反应体系中的cAMP竞争结合标有荧光染料的cAMP抗体。当抗体与示踪剂结合时,340 nm的激发光可以激发铕标分子,使能量转移到荧光染料上,从而产生665 nm的发射光;而未结合抗体的铕标分子则会逃逸615 nm的荧光,因此反应体系中的cAMP含量与激发的荧光强度成反比。CHO-PKAcat-EGFP细胞和CHO-PKAcatα2A-AR细胞分别接种到6孔板中,待细胞密度达90%后,加入Versene消化液消化细胞,细胞分散后用HBSS缓冲液吹打重悬细胞,800×g离心5 min,弃上清后用200μL刺激缓冲液(含HBSS,0.5 mol·L-1IBMX,7.5%BSA)重悬细胞,计数细胞,将细胞密度调至6×108L-1,在白色OptiPlate-384孔板中加样,细胞-抗体复合物5μL,forskolin和(或)DMED 5μL,室温孵育30 min后加入检测复合物10μL,混合后室温孵育1 h,用Envision 2104 Multilabel Reader测定发射波长665 nm的读数。
1.7 采用构建的CHO-PKAcat-α2A-AR评价药物活性
CHO-PKAcat-α2A-AR细胞接种到96孔板,待细胞密度达80%时,用F-12基础培养基洗细胞每孔100μL;阴性对照组加入forskolin每孔50μL(终浓度10μmol·L-1),测量组加入DMED/MED每孔50μL(终浓度1×10-7~1×10-11mol·L-1)与forskolin每孔50μL(终浓度10μmol·L-1)孔共孵育,加入F-12培养基补足反应体系200μL,培养箱中孵育10 min,加入甲醛(终浓度4%)孵育20 min,PBS缓冲液洗细胞2次,加入PBS配制的Hoechst33342(1μmol·L-1)进行染色,避光反应30 min后利用In Cell Analyzer 1000获取细胞图像,并计算药效强度(%)=(DMED各浓度组颗粒形成指数-forskolin组颗粒形成指数)/(DMED最高浓度组颗粒形成指数-forskolin组形成指数)×100%,反映药物量效关系。
1.8 统计学分析
实验数据结果以表示,软件GraphPad Prism 5.0,用one-way ANOVA,Tukey t检验进行统计学分析。
2 结果

2.1 构建pcDNA3.1/Hygro-HA-α2A-AR重组质粒
图1结果显示,PCR扩增获得带有酶切位点EcoRⅠ和XhoⅠ的目的基因α2A-AR,琼脂糖凝胶电泳验证扩增产物条带在目的基因1398 bp附近(图1A),表明扩增成功。目的基因与pCMV-HA载体进行酶切连接,提取质粒后酶切鉴定,可见载体和目的基因双条带(图1B),证明连接成功。测序结果表明,扩增序列与GenBank BC035047.1序列完全吻合。

Fig.1 PCR product ofα2A-adrenoceptor(α2A-AR)(A)and recombinant plasmid pCMV-HA-α2A-AR digested with EcoRⅠand XhoⅠ(B)by agarose gel electrophoresis.M:marker.Lane 1 was construction ofα2A-AR product in A and recombinantplasmid pCMV-HA-α2A-AR in B,respectively.
PCR扩增获得带有酶切位点HindⅢ和XhoⅠ的目的基因HA-α2A-AR,电泳条带位置正确(图2A)。目的基因与pcDNA3.1/Hygro载体酶切后进行连接,提取质粒后酶切鉴定,可见载体和目的基因双条带(图2B),证明连接成功。测序结果表明,扩增序列与GenBank BC035047.1序列完全吻合,证明重组质粒构建成功。

Fig.2 PCR product of HA-α2A-AR(A)and recombinant plasmid pcDNA3.1/hygromycin B(Hygro)-HA-α2A-AR digested with HindⅢand XhoⅠ(B)by agarose gel elec⁃trophoresis.M:marker;lane 1:PCR product of HA-α2A-AR in A and recombinant plasmid pcDNA3.1/Hygro-HA-α2A-AR in B,respectively.
2.2 PKA重分布实验筛选阳性细胞株
pcDNA3.1/Hygro-HA-α2A-AR重组质粒转染CHO-PKAcat-EGFP细胞后先经Hygro 200 mg·L-1压力筛选,共获得24株细胞克隆;采用PKA重分布实验,经初筛和多代培养复筛,最终选出对PKA重分布抑制程度高且状态良好的细胞株-7号克隆(图3A,B);经计算,7号克隆的Z′因子在0.5~1之间(图3C),表明细胞株稳定。后续采用的CHO-PKAcat-EGFP-α2A-AR均为7号克隆。
2.3 α2A-AR mRNA在CHO-PKAcat-α2A-AR细胞中的表达
连续传代1~20代,采用qRT-PCR方法检测发现(图4),与CHO-PKAcat-EGFP细胞相比,CHOPKAcat-α2A-AR细胞α2A-AR mRNA表达水平显著增加(P<0.01),且多次传代均有高水平表达,表明α2A-AR在该细胞中已稳定表达。
2.4 α2A-AR激动剂对CHO-PKAcat-α2A-AR细胞cAMP含量的影响
图5表明,forskolin(10μmol·L-1)刺激CHOPKAcat-EGFP和CHO-PKAcat-α2A-AR细胞后,均可显著增加cAMP含量,表现为LANCE信号强度(665 nm)明显降低,DMED(1×10-8~1×10-4mol·L-1)对CHO-PKAcat-EGFP的cAMP含量无显著影响,但DMED(1×10-6~1×10-4mol·L-1)可显著抑制CHO-PKAcat-α2A-AR中的cAMP生成。进一步证明α2A-AR已在该细胞中稳定表达。
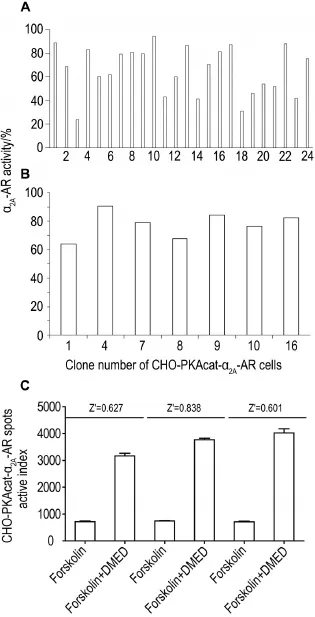
Fig.3 Screening clone of CHO-PKAcat-α2A-AR cells by protein kinase A(PKA)redistribution assay.A:the primary screening of clones of CHO-PKAcat-α2A-AR cells;B:the second screening of clones of CHO-PKAcat-α2A-AR cells;C:the values of Z′in experiments independently replicated three times.
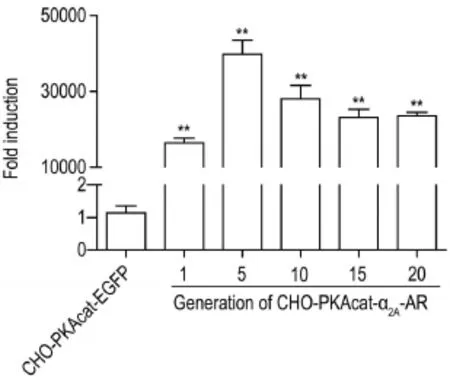
Fig.4α2A-AR mRNA expression in CHO-PKAcat-α2A-AR cells.**P<0.01,compared with CHO-PKAcatenhanced green fluorescent protein(EGFP)cells.

Fig.5 Effect of forskolin and dexmedetomidine(DMED)on cAMP content in CHO-PKAcat-EGFP cells and CHOPKAcat-α2A-AR cells.**P<0.01,compared with corresponding controlgroup;#P<0.05,##P<0.01,compared with forskolin group.
2.5 采用构建的CHO-PKAcat-α2A-AR细胞评价药物活性
使用DMED和MED(1×10-7~1×10-11mol·L-1)作用于CHO-PKAcat-α2A-AR细胞,通过PKA重分布实验,两者对α2A-AR表现出浓度依赖性的激动活性(图6),二者均能抑制PKA激活,DMED的EC50为(1.03±0.66)nmol·L-1,MED的EC50为(1.95± 0.08)nmol·L-1。
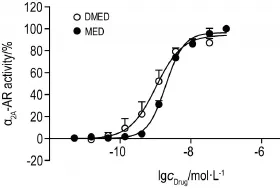
Fig.6 Concentration response curve of DMED and medetomidine(MED)in CHO-PKAcat-α2A-AR cells by PKA redistribution assay.
3 讨论
本模型采用的工具细胞为CHO-PKAcat-EGFP,基础状态下PKAcat荧光颗粒聚集,AC-cAMP-PKA通路激活后,PKAcat活化并解离[10],表现为荧光颗粒弥散;α2A-AR激活后可抑制AC-cAMP-PKA通路,即可抑制荧光颗粒弥散过程,用In CellAnalyzer 1000获得细胞荧光图像,分析荧光颗粒弥散程度即可量化药物对受体的激活程度,从而分析α2A-AR的表达量及药物的作用强度。本研究结果表明,α2A-AR激动剂DMED可显著抑制forskolin引起的cAMP含量增多,与PKA重分布实验的结果一致。
DMED是强效的α2A-AR激动剂,1999年美国FDA批准上市,用于重症监护患者和非插管患者术前及术中短期镇静,临床使用非常广泛。在分子水平,研究者用[35S]GTPγS结合实验表明,DMED作为部分激动剂激活α2A-AR,介导受体偶联并激活Gi蛋白[11],且可有效抑制AC活性,其EC50均在纳摩尔水平[12]。相较于其余多种α2A-AR激动剂,DMED表现出较高的效价强度。在本细胞模型上对DMED的药效学评价结果与文献报道一致。由于DMED是MED的右旋体有效成分,理论上DMED药效强度应为MED的2倍,研究结果也表明二者的EC50值符合这一推论。对不表达α2A-AR的细胞,DMED和MED均不表现抑制作用。通过以上实验验证,本研究成功构建了细胞模型CHO-PKAcat-α2A-AR,并采用多种方法验证了细胞中α2A-AR的表达和功能,均表明本细胞模型稳定可靠,用于化合物活性筛选操作方便快捷,为筛选靶向α2A-A R的选择性配体及探讨其作用的分子机制奠定基础。
[1]Starke K.Presynaptic autoreceptors in the third decade:focus onα2-adrenoceptors[J].J Neuro⁃chem,2001,78(4):685-693.
[2]Bylund DB,Eikenberg DC,Hieble JP,Langer SZ,Lefkowitz RJ,Minneman KP,et al.International Union of Pharmacology nomenclature of adrenoceptors[J].PharmacolRev,1994,46(2):121-136.
[3]Altman JD,Trendelenburg AU,Macmillan L,Bernstein D,Limbird L,Starke K,et al.Abnormal regulation of the sympathetic nervous system in α2A-adrenergic receptor knockout mice[J].Mol Pharmacol,1999,56(1):154-161.
[4]Macmillan LB,Hein L,Smith MS,Piascik MT,Limbird LE.Central hypotensive effects of theα2aadrenergic receptor subtype[J].Science,1996,273(5276):801-803.
[5]Hunter JC,Fontana DJ,Hedley LR,Jasper JR,Lewis R,Link RE,et al.Assessment of the role of α2-adrenoceptor subtypes in the antinociceptive,sedative and hypothermic action of dexmedetomidinein transgenic mice[J].Br J Pharmacol,1997,122(7):1339-1344.
[6]Lakhlani PP,Macmillan LB,Guo TZ,Mccool BA,Lovinger DM,Maze M,et al.Substitution of a mutantα2a-adrenergic receptor via″hit and run″gene targeting reveals the role of this subtype in sedative,analgesic,and anesthetic-sparing responses in vivo[J].Proc Natl Acad Sci USA,1997,94(18):9950-9955.
[8]Scheinin M,Lomasney JW,Hayden-Hixson DM,Schambra UB,Caron MG,Lefkowitz RJ,et al. Distribution ofα2-adrenergic receptor subtype gene expression in rat brain[J].Brain Res Mol Brain Res,1994,21(1-2):133-149.
[9]Talley EM,Rosin DL,Lee A,Guyenet PG,Lynch KR.Distribution ofα2A-adrenergic receptorlike immunoreactivity in the ratcentralnervous system[J].J Comp Neurol,1996,372(1):111-134.
[10]Limbird LE.Receptors linked to inhibition of adenylate cyclase:additional signaling mechanisms[J]. FASEB J,1988,2(11):2686-2695.
[11]Nigg EA,Hilz H,Eppenberger HM,Dutly F.Rapid and reversible translocation of the catalytic subunit of cAMP-dependent protein kinase typeⅡfrom the Golgi complex to the nucleus[J].EMBO J,1985,4(11):2801-2806.
[12]Peltonen JM,Pihlavisto M,Scheinin M.Subtypespecific stimulation of[35S]GTPγS binding by recombinantα2-adrenoceptors[J].Eur J Pharmacol,1998,355(2-3):275-279.
[13]Pohjanoksa K,Jansson CC,Luomala K,Marjamäki A,Savola JM,Scheinin M.Alpha2-adrenoceptor regulation of adenylyl cyclase in CHO cells:dependence on receptor density,receptor subtype and current activity of adenylyl cyclase[J].Eur J Pharmacol,1997,335(1):53-63.
Establishment of recombinant cellline stably expressing humanα2A-adrenoceptor
YANG Yi,LIYu-lei,LIU Meng,ZHOU Pei-lan,SU Rui-bin,GONG Ze-hui
(State Key Laboratory of Toxicology and MedicalCountermeasures,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTIVE To establish a new cellline thatcan stably express humanα2A-adrenoceptor(α2A-AR).METHODS Recombinant plasmid ofα2A-AR with hygromycin B(Hygro)resistance(pcDNA3.1/Hygro-HA-α2A-AR)was stably transfected into Chinese hamster ovary(CHO)cells which had expressed protein kinase A catalytic subunits(PKAcat)with labeling of enhanced green fluorescent protein(EGFP)by a Lipofectamine based method.A single positive clone expressingα2A-AR was selected through cultivation in the presence of 200 mg·L-1hygromycin B followed by PKA redistribution assay. The transcriptionalexpression ofα2A-AR was detected by quantitative real-time PCR(qRT-PCR).Timeresolved fluorescence resonance energy transfer immunoassay was used to identify the function of inhibiting cAMP accumulation ofα2A-AR.RESULTS The CHO-PKAcat-α2A-AR cell line No.7 exhibited stable response in PKA redistribution assay.qRT-PCR analysis demonstrated that the high expression of α2A-AR in the cellline remained stable after a few generations compared with CHO-PKAcat-EGFP cells(P<0.01).The cAMP accumulation caused by forskolin was significantly inhibited byα2A-AR agonist in CHO-PKAcat-α2A-AR cells(P<0.01).CONCLUSION CHO-PKAcat-α2A-AR cell line is constructed successfully,which provides an effective modelfordrug screening and studies ofmechanisms.
Chinese hamster ovary cells;receptors,adrenergicα2A;protein kinase A;cAMP
The projectsupported by NationalScience and Technology Major Projectof China(2012ZX09301003-003)
SU Rui-bin,E-mail:ruibinsu@126.com,Tel:(010)66931607;ZHOU Pei-lan,E-mail:zhoupeilan0502@sina.com,Tel:(010)66931612
R965.1
A
1000-3002-(2016)05-0576-06
10.3867/j.issn.1000-3002.2016.05.015
2015-12-25接受日期:2016-03-30)
(本文编辑:乔 虹)
国家科技重大专项(2012ZX09301003-003)
杨怿,女,硕士研究生,Tel:(010)66874604,E-mail:murongjiuyy@126.com;苏瑞斌,男,研究员,博士生导师,主要从事神经精神药理学研究。
苏瑞斌,E-mail:ruibinsu@126.com,Tel:(010)66931607;周培岚,E-mail:zhoupeilan0502@sina.com,Tel:(010)66931621
