低剂量全氟异丁烯致大鼠急性肺损伤及清开灵早期治疗长期效果观察
2016-12-01张东泉许兴兴邹春平胡祖良柳月珍丁日高
刘 芳,张东泉,许兴兴,邹春平,胡祖良,柳月珍,赵 建,4,丁日高,4
(1.军事医学科学院毒物药物研究所,北京100850;2.中央军委联合参谋部信息通信局门诊部,北京100840;3.浙江省衢州市衢化医院,浙江衢州324004;4.毒理学与抗毒药物研究国家重点实验室,北京100850)
低剂量全氟异丁烯致大鼠急性肺损伤及清开灵早期治疗长期效果观察
刘 芳1,2,张东泉3,许兴兴1,邹春平3,胡祖良3,柳月珍3,赵 建1,4,丁日高1,4
(1.军事医学科学院毒物药物研究所,北京100850;2.中央军委联合参谋部信息通信局门诊部,北京100840;3.浙江省衢州市衢化医院,浙江衢州324004;4.毒理学与抗毒药物研究国家重点实验室,北京100850)
目的观察低剂量全氟异丁烯(PFIB)单次暴露诱发大鼠急性肺损伤(ALI)及清开灵注射液早期救治的长期效应。方法雄性Wistar大鼠224只,随机分为正常对照组(空气暴露后ip给予生理盐水10 mL·kg-1)、清开灵对照组(空气暴露后ip给予清开灵注射液10 mL·kg-1)、PFIB染毒组(PFIB 280 mg·m-3,染毒5 min,1 h后ip给予生理盐水10 mL·kg-1)和清开灵救治组(PFIB染毒后1 h ip给予清开灵注射液10 mL·kg-1),分别于染毒后24 h和3,6,12,24,36和48周随机处死8只,检测动脉血气、肺功能、肺系数、支气管肺泡灌洗液(BALF)中蛋白含量、肺组织和血浆中羟脯氨酸(HYP)含量等。结果与正常对照组相比,PFIB中毒组大鼠染毒后24 h肺系数和BALF中蛋白含量显著升高(P<0.01),动脉血氧分压PaO2(P<0.01)和氧饱和度SaO2显著降低(P<0.05),吸气时间、呼气时间、潮气量(TV)、呼气量(EV)、呼气末停顿和弛豫时间显著降低(P<0.01);上述指标从3周开始逐渐恢复至正常水平;至48周时,TV、EV和呼气峰流量(PEF)与正常对照组相比显著降低(P<0.05)。肺组织中HYP含量在染毒后24 h与正常对照组相比降低(P<0.05),之后至6周时显著高于正常对照组(P<0.05),12周后恢复至正常水平。血浆中HYP含量在染毒后24 h与正常对照组相比升高(P<0.05),之后逐渐恢复至正常水平。清开灵治疗组大鼠染毒后24 h BALF中蛋白含量显著低于PFIB中毒组(P<0.01);染毒后24 h至24周,TV、EV、吸气峰流量和PEF值与PFIB中毒组均无显著性差异,至48周时TV和EV均显著高于PFIB中毒组(P<0.05),恢复至正常对照组水平。结论低剂量PFIB致大鼠ALI的长期修复过程中,肺组织损伤得到代偿性修复,但肺容量和肺通气功能有所降低。清开灵早期救治可抑制PFIB-ALI急性期BALF中蛋白渗漏,并对后期肺功能恢复起到一定的作用。
全氟异丁烯;急性肺损伤;清开灵;肺功能;长期毒性
全氟异丁烯(perfluoroisobutylene,PFIB)是一种窒息性气体,列于《禁止化学武器公约》禁控化合物的二级清单中,毒性比光气强约10倍;作为聚氟工业生产和加工过程中的副产物,每年有上千吨的产量。吸入少量PFIB可诱发急性肺损伤(acute lung injury,ALI),严重者可导致死亡。本课题组近年来对PFIB引起的急性反应做了大量深入的研究,初步找到了对PFIB中毒特异性强的防治药物和干预措施[1-5],发现了可用于临床早期诊断的特异性方法[6],对其中毒机制的了解强调了从直接损伤与过度炎症反应两方面着手的重要性[7-9]。但对PFIB染毒后的长期效应所知甚少。清开灵注射液是以“安宫牛黄丸”为基础研制的一种纯中药制剂,主要成分为牛黄、水牛角、珍珠母、黄芩、金银花、栀子和板蓝根等,具有活血化瘀、清热化痰和凉血开窍的功效[10]。课题组前期以PFIB-ALI动物模型进行了“对抗肺水肿中药筛选研究”,发现清开灵对PFIBALI具有明显的治疗效果和剂量效应关系[11]。PFIB染毒后1 h ip给予清开灵10 mL·kg-1可明显改善PFIB-ALI大鼠的中毒症状[12]。进一步分析治疗成分和作用机制,发现清开灵对抗PFIB所致肺水肿的有效成分为总胆酸,清开灵具有非激素样的独特作用机制可能与其表面活性作用有关[11]。本研究通过低剂量PFIB单次暴露诱发大鼠ALI后连续48周的长期效应及清开灵早期治疗效果长期观察,阐明PFIB-ALI修复的规律性变化和清开灵早期治疗的长期效果,为窒息性毒剂肺损伤毒理学和抗毒药物防治及临床PFIB染毒患者急性期后的长期康复治疗提供实验依据。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级雄性Wistar大鼠224只,体质量180~200 g。北京维通利华实验动物技术有限公司提供〔许可证号SCXK(京)2012-0001〕。大鼠自由摄食、饮水。
1.2 试剂和仪器
PFIB,纯度为98%,购自上海有机氟材料研究所;清开灵注射液(每支10 mL),河北神威药业有限公司,批号130416C2;Bradford法蛋白含量测定试剂盒,北京普利莱基因技术有限公司。北分SP-3420型气相色谱仪,北京北分瑞利分析仪器有限公司;雷度ABL80系列血气仪,美国RADIOMETER公司;Universal16R型台式高速冷冻离心机,德国Hettucg公司;680型酶标仪,美国Bio-Rad公司;Vent2型全身体积描记系统及iox2V2.2数据采集和分析系统,法国Emka公司。
1.3 PFIB染毒剂量的确定
低剂量PFIB染毒剂量的确定主要考虑两点,一是染毒大鼠的死亡率要低,以保证观察期大鼠标本的数量;二是要出现显著的肺水肿和肺组织病理变化。基于以上要求,确定了以下3个观察指标,即染毒后24 h各组死亡大鼠数<1/10;染毒后24 h大鼠出现明显的肺水肿,即肺系数有显著改变;染毒后24 h大鼠肺组织出现明显的蛋白渗漏,即BALF中蛋白含量出现显著增高。通过整理以往实验数据,在280 mg·m-3染毒5 min条件下大鼠可达到上述标准。经过预实验发现,在280 mg·m-3染毒5 min条件下,染毒大鼠24 h的死亡率<1/10,肺系数和BALF中蛋白含量与正常组相比均出现显著变化。因此,低剂量PFIB染毒剂量确定为280 mg·m-3染毒5 min。
1.4 实验分组
大鼠称重,标记,以体质量分组因素随机分为4组:正常对照组(空气暴露后腹腔注射生理盐水10 mL·kg-1)、清开灵对照组(空气暴露后腹腔注射清开灵注射液10 mL·kg-1)、PFIB染毒组(采用自制的大鼠全身暴露动态吸入染毒系统[7],染毒后1 h腹腔注射生理盐水10 mL·kg-1)和清开灵治疗组(PFIB染毒后1 h腹腔注射清开灵注射液10 mL·kg-1)。每组56只大鼠,分别于染毒后24 h,3,6,12,24,36和48周各取8只大鼠,麻醉后经腹主动脉采集血液样本(肝素钠抗凝),用于动脉血气分析和血浆制备,然后放血处死,采集支气管肺泡灌洗液(bron⁃choalveolar lavage fluid,BALF)和肺组织标本。
1.5 肺系数测定
大鼠处死后,打开胸腔,取右前叶肺测定肺系数。小心剔除肺外组织,生理盐水漂洗,滤纸吸干后,称肺湿重。然后将标本置80℃烘烤24 h至恒重后,称肺干重,按下列公式计算肺系数:肺湿干比=湿肺净重/干肺净重;湿肺体比=湿肺净重/体质量× 10 000;干肺体比=干肺净重/体质量×10 000;肺含水量(%)=(湿肺净重-干肺净重)/湿肺净重× 100%。
1.6 BALF的制备和蛋白质含量检测
用止血钳夹住右侧4叶肺,气管插管后,以5 mL生理盐水反复灌洗左肺3~5次,每次在肺中停留5 s。然后将灌洗液置于10 mL离心管中离心(4℃,765×g,10 min),采用Bradford法蛋白含量测定试剂盒测定BALF中蛋白质含量。
1.7 肺功能检测
利用法国Emka公司Vent2型全身体积描记系统及iox2V2.2数据采集和分析系统,采集大鼠PFIB暴露前后不同时间的呼吸参数[13],并进行分析。
1.8 血气分析
利用雷度ABL80系列血气仪,测定PFIB染毒后不同时间点受试大鼠的动脉血氧分压(PaO2)、动脉血氧饱和度(SaO2)、动脉血二氧化碳分压(PaCO2)及pH值等参数。
1.9 肺组织和血浆羟脯氨酸(hydroxyproline,HYP)含量检测
采用HYP测定试剂盒,分别检测各时间点大鼠肺组织和血浆中HYP含量。
1.10 统计学分析
2 结果
2.1 染毒PFIB对大鼠体质量的影响
大鼠PFIB染毒后48周体质量变化如图1所示,各组大鼠体质量均逐渐递增,无显著性差异。
Fig.1 Change of body mass of rats within 48 weeks after perfluoroisobutylene(PFIB)exposure.Exposure to PFIB 280 mg·m-3lasted 5 min;Qingkailing(QKL)10 mL·kg-1was ip given 1 h after PFIB exposure.
2.2 染毒PFIB对大鼠肺系数的影响
大鼠PFIB染毒后不同时间点肺系数变化如图2所示。在染毒后24 h,PFIB中毒组大鼠肺湿干比、湿肺体比、干肺体比和肺含水量等各项肺系数均较正常对照组显著升高;清开灵对照组大鼠的各项肺系数均与正常对照组无显著性差异;清开灵治疗组大鼠的各项肺系数与PFIB中毒组相比无显著差异,但均有改善趋势。PFIB染毒后3~48周,各组大鼠肺系数均恢复至正常水平。
2.3 染毒PFIB对大鼠BALF中蛋白质含量的影响
大鼠PFIB染毒后不同时间点BALF中蛋白质含量变化如图3所示。在染毒后24 h,PFIB中毒组大鼠BALF中蛋白质含量较正常对照组显著升高(P<0.01);清开灵对照组大鼠BALF中蛋白质含量与正常对照组无显著性差异;清开灵治疗组大鼠BALF中蛋白质含量较PFIB中毒组显著降低(P<0.05,P<0.01)。PFIB染毒后3~48周,各组BALF中蛋白质含量均恢复至正常水平。
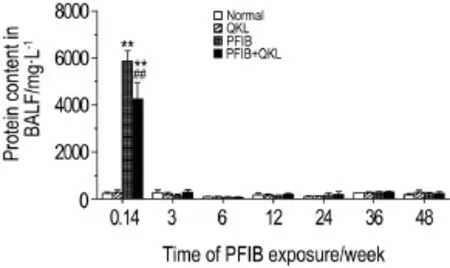
Fig.2 Change of lung coefficients of rats within 48weeks after PFIB exposure.See Fig.1 for the rat treatment. *P<0.05,**P<0.01,compared with normalcontrolgroup.
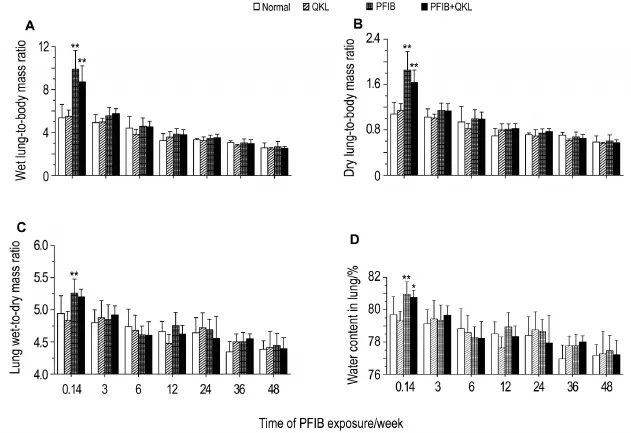
Fig.3 Change of protein contents in BALF of rats within 48 weeks after PFIB exposure.See Fig.1 for the rat treatment.**P<0.01,compared with normalcontrolgroup;##P<0.01,compared with PFIB group.
2.4 染毒PFIB对大鼠血气的影响
大鼠PFIB染毒后不同时间点血气指标变化如图4所示。在染毒后24 h~3周,PFIB中毒组大鼠血气PaO2值(P<0.01)和SaO2值(P<0.05)较正常对照组显著下降。清开灵治疗组大鼠PaO2值和SaO2值与正常对照组相比无显著性差异,与PFIB中毒组相比有改善趋势。PFIB染毒后6~48周,各组血气指标均恢复至正常水平。
2.5 染毒PFIB对大鼠肺功能的影响
大鼠PFIB染毒后不同时间点肺功能变化如图5所示。在染毒后24 h,PFIB中毒组大鼠的吸气时间(Ti)、呼气时间(Te)、潮气量(TV)、呼气量(EV)、呼气末停顿(EEP)和弛豫时间(RT)较正常对照组显著降低(P<0.01);从3周开始以上指标逐渐恢复至正常水平。吸气峰流量(PIF)、呼气峰流量(PEF)与正常对照组相比无显著性差异;但至48周时,TV,EV和PEF较正常对照组显著降低(P<0.01)。清开灵对照组大鼠的各项肺功能指标与正常对照组相比均无显著性差异。在染毒后24 h,清开灵治疗组大鼠与正常对照组相比,Ti,Te,TV,EV,EEP和RT显著降低(P<0.05,P<0.01),呼吸频率(f)显著升高(P<0.01),PIF和PEF无显著性差异,各项指标与PFIB中毒组相比均无显著性差异;从3周起,各项指标均逐渐恢复至正常水平,其中TV,EV和PIF值在48周时显著高于PFIB染毒组(P<0.05)。
2.6 染毒PFIB对大鼠肺组织和血浆中羟脯氨酸含量的影响
大鼠PFIB染毒后不同时间点肺组织和血浆中HYP含量变化如图6所示。与正常对照组相比,PFIB中毒组大鼠在染毒后24 h肺组织中HYP含量显著降低(P<0.05),而血浆中HYP含量显著升高(P<0.05);染毒后3周,肺组织中HYP含量逐渐恢复至正常对照组水平,至6周时显著高于正常对照组(P<0.05),之后至48周逐渐恢复至正常水平。清开灵对照组大鼠肺组织和血浆中HYP含量与正常对照组相比无显著性差异。清开灵治疗组大鼠与PFIB中毒组大鼠变化相似,两组相比无显著性差异。
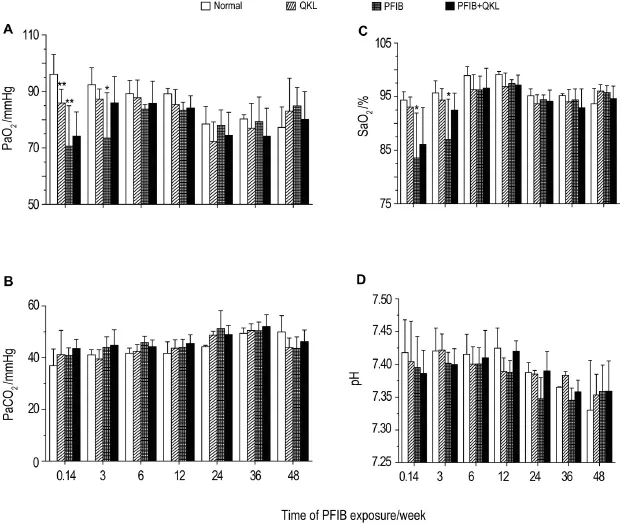
Fig.4 Change of arterial blood gases of rats within 48 weeks after PFIB exposure.See Fig.1 for the treatment.x±s,n=6.*P<0.05,**P<0.01,compared with normalcontrolgroup.
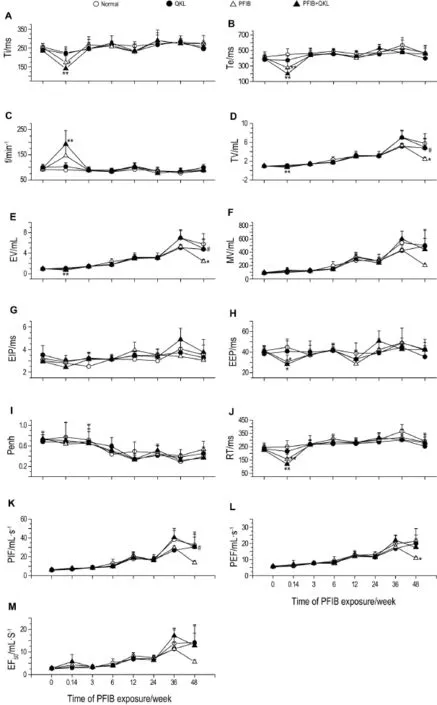
Fig.5 Change of pulmonary function of rats within 48 weeks after PFIB exposure.See Fig.1 for the rat treatment.Ti:inspiratory time;Te:expiratory time;f:frequency of breathing;TV:tidalvolume;EV:expired volume;MV:minute ventilation;EIP:peak inspiratory flow;EEP:peak expiratory flow;Penh:enhanced pause;RT:relaxation time;PIF:peak inspiratory flow;PEF:peak expiratory flow;EF50:50%of expiratory flow.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,compared with PFIB group.
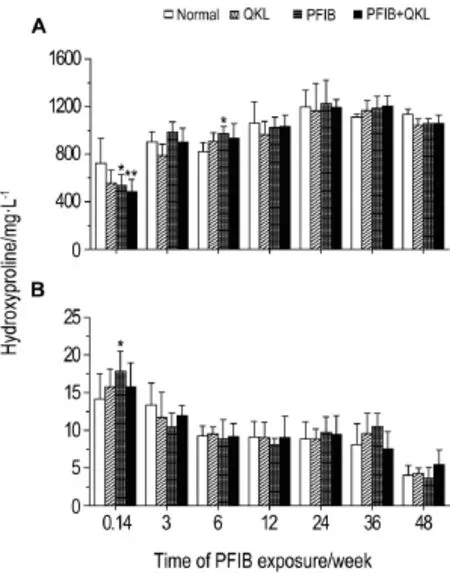
Fig.6 Change of hydroxyproline contents in lung tissue(A)and plasma(B)of rats within 48 weeks after PFIB exposure.See Fig.1 for the rat treatment.**P<0.01,compared with normalcontrolgroup.
3 讨论
3.1 PFIB-ALI长期效应观察
在整个48周观察过程中,各组大鼠的体质量均呈逐渐上升趋势,且各组体质量增长无显著差异,提示观察期间大鼠均处于青壮年期,单次低剂量PFIB暴露对大鼠一般健康状况无明显影响。
PFIB染毒后24 h,中毒组大鼠的肺系数和BALF中蛋白含量均较正常对照组显著升高,血气中PaO2和SaO2指标较正常对照组显著降低,肺功能也发生了显著变化。各项指标显示,大鼠在PFIB染毒后24 h肺组织发生了急性肺水肿,致使肺的气体交换功能和呼吸功能均有所降低,大鼠PFIB-ALI模型建立成功。
染毒后3~48周,PFIB中毒组大鼠的肺系数、BALF中蛋白含量及各项血气指标均逐渐恢复至正常水平。提示大鼠的急性炎症反应和肺组织损伤得到代偿性修复。
在染毒后24 h,PFIB中毒组大鼠的Ti,Te,TV,EV,EEP和RT与正常对照组相比显著降低,这些变化与ALI大鼠的肺功能特点一致[13];PIF和PEF值与正常对照组相比无显著性差异。以上指标从染毒后3周起逐渐恢复至正常水平。至染毒后48周,PFIB中毒组大鼠的TV,EV和PEF显著降低。EV和TV是反映大鼠肺容量的重要指标,而PEF是反映肺通气功能的重要指标。肺通气功能正常与否受到呼吸中枢及其支配神经通路、呼吸肌肉功能(主要为膈肌)、气道通畅性、肺顺应性(肺泡可扩张及可回缩性)和胸廓顺应性等因素的影响,任何一方面功能的下降都可导致通气功能异常[14]。本研究结果提示,低剂量PFIB染毒大鼠ALI的长期修复过程中,虽然肺组织损伤得到代偿性修复,但肺容量和肺通气功能较正常大鼠会有所降低,可能与ALI引起的小气道病变损伤、呼吸肌功能降低及肺泡上皮细胞损伤引起的肺顺应性降低有关。
染毒后24 h,PFIB中毒组大鼠和清开灵治疗组大鼠肺组织中HYP含量显著降低,而血浆中HYP含量显著升高,此结果与课题组前期观察结果一致[15],提示ALI大鼠肺组织中的HYP可能会由于肺组织病理改变、肺气血屏障通透性增加和蛋白渗漏等原因而到血液中。至6周时,中毒组大鼠肺组织中HYP含量显著高于正常对照组,这一现象与PFIBALI后肺的代偿性修复有关,一度引起肺泡上皮细胞的过度修复与成纤维细胞的过度激活。但这种修复在6周之后即恢复至正常对照组水平,可能是由于单次低剂量PFIB暴露,使这种肺泡上皮细胞的过度异常修复与成纤维细胞的过度激活不够严重或不能持续较长时间。HYP是组成机体胶原蛋白的一种特有氨基酸,除了弹性蛋白含有少量HYP(1%)外,几乎所有HYP都存在于胶原中[16]。此结果提示大鼠PFIB-ALI的长期修复过程中可能未发生肺纤维化(pulmonary fibrosis,PF)。原因可能有2个:①由于PFIB诱导的ALI与其他化学毒性物质,如博莱霉素、野百合碱和百草枯等诱发的ALI发病机制有所不同,后者在2~4周后通常伴有PF的发生。PFIB诱导的ALI可能与组胺类药物中毒引起肺损伤病例相似,多表现为单纯性肺水肿,常较易修复[17],后期无PF的发生。②可能是由于单次低剂量PFIB暴露,不足以引起肺泡上皮细胞的过度异常修复与成纤维细胞的过度激活[18]。因此,有必要在后期研究中增大PFIB的染毒剂量,并通过增加组织病理学观察及肺泡炎和纤维化评分等实验方法,进一步观察高剂量PFIB染毒后ALI的长期修复过程中有无PF的生成。
3.2 清开灵早期治疗效果观察
本研究观察到清开灵对PFIB-ALI大鼠的早期治疗有几以下几方面效果。
第一,可改善低剂量PFIB-ALI引起的肺水肿并显著抑制肺组织蛋白渗漏。在染毒后24 h,清开灵治疗组大鼠BALF中蛋白质含量较PFIB中毒组显著下降;各项肺系数与PFIB中毒组大鼠相比无显著性差异,但均有下降趋势,可能是PFIB染毒剂量较低,症状不严重,大鼠的个体差异较大所致。提示清开灵早期治疗可改善低剂量PFIB-ALI大鼠的肺水肿,抑制肺组织蛋白渗漏。本课题组前期研究结果表明,清开灵对PFIB所致肺水肿和炎性渗出具有肯定的抑制作用,总胆酸是清开灵对抗PFIBALI的有效成分,具体机制可能与其表面活性作用有关[10-12]。清开灵治疗组大鼠肺组织蛋白渗漏的减少,可能与该组大鼠后期肺功能几无降低的结果密切相关。
第二,可改善PFIB-ALI气体交换功能。在染毒后24 h,PFIB中毒组大鼠和清开灵治疗组大鼠PaO2与正常组相比均显著降低,但染毒后3周,PFIB中毒组大鼠PaO2依然显著低于正常对照组,而清开灵治疗组大鼠PaO2已恢复至正常组水平。PFIB中毒组大鼠SaO2在染毒后24 h~3周均显著低于正常对照组,而清开灵治疗组大鼠SaO2自染毒后24 h至观察结束,均保持在正常水平。这一结果提示,早期清开灵治疗可显著改善PFIB-ALI大鼠的气体交换功能。
第三,对PFIB-ALI肺功能的恢复有一定的作用。在本研究中,染毒后24 h清开灵治疗组大鼠的TV,EV,PIF和PEF值与PFIB中毒组大鼠相比无显著性差异,均显著低于正常对照组;从染毒后3~48周,清开灵治疗组大鼠以上指标均恢复至正常水平,而染毒后48周时PFIB中毒组大鼠上述指标较正常对照组和清开灵治疗组显著降低,提示清开灵对PFIB-ALI大鼠的肺功能具有一定的保护作用,使其在急性反应期后的修复过程中逐渐恢复至正常水平。这种作用可能与清开灵早期治疗能显著对抗肺组织蛋白渗漏、改善肺水肿和气体交换功能有关,具体的机制尚有待于后期的进一步研究。
总之,清开灵的PFIB-ALI的早期治疗效果主要与清开灵中的胆酸成分的表面活性作用有关。PFIB中毒早期,胆酸的表面活性作用可屏蔽肺组织蛋白的带电基团,抑制肺组织蛋白水解和蛋白磷酸化,保护气血屏障的完整性,从而起到对抗PFIBALI的作用。化学吸入性肺损伤具有独特的临床特点,一旦能安全度过急性期,即可进入恢复期,很少有后遗症。因此,在中毒早期进行有效治疗是化学吸入性肺损伤治疗的关键。
本研究是窒息性气体PFIB单次暴露诱发大鼠ALI长期效应观察研究的一部分,研究结果对开展高剂量PFIB单次暴露诱发大鼠ALI长期效应观察奠定基础,为进一步优化实验设计并改进实验条件提供了一定的理论依据和实验基础,也为临床PFIB暴露后ALI患者急性期后的长期康复治疗提供参考。
[1]Zhang T,Zhang X,Shao Z,Ding R,Yang S,Ruan J,et al.The prophylactic and therapeutic effects of cholinolytics on perfluoroisobutylene inhalation induced acute lung injury[J].J Occup Health,2005,47(4):277-285.
[2]Zhao J,Shao Z,Zhang X,Ding R,Xu J,Ruan J,et al.Suppression of perfluoroisobutylene induced acute lung injury by pretreatment with pyrrolidine dithiocarbamate[J].J Occup Health,2007,49(2):95-103.
[3]Zhao J,Ding RG,Ruan JX,Zhang XC,Sun XH,Huang CQ,et al.Effects of pyrrolidine dithiocarba⁃mate and tetracycline hydrochloride on acute lung injury induced by perfluoroisobutylene inhalation in mice[J].Chin J Ind Med(中国工业医学杂志),2007,20(6):370-372.
[4]Zhao J,Ding RG,Ruan JX,Zhang XC,Sun XH,Huang CQ,et al.Effects of chemical modified tetracyclines on acute lung injury induced by perflu⁃oroisobutylene inhalation in mice[J].Chin Occup Med(中国职业医学),2008,35(1):7-9.
[5]Shao ZH,Zhao J,Xu J,Sun XH,Hu LZ,Huang CQ,et al.Effects of ulinastain on acute lung injury induced by perfluoroisobutylene inhalation in mice[J].Chin J Clin Res(中国临床研究),2013,26(1):1-4.
[6]Xu J,Nie ZY,Shao ZH,Zhao J,Zhang XC,Sun XH,et al.Change of blood fluoride ion concentration in rabbits and rats inhaling perfluoroisobutylene[J]. Chin J Ind Hyg Occup Dis(中华劳动卫生职业病杂志),2007,25(6):367-368.
[7]Wang HM,Ding RG,Ruan JX,Yuan BL,Sun XH,Zhang XC,et al.Perfluoroisobutylene-induced acute lung injury and mortality are heralded by neutrophil sequestration and accumulation[J].J Occup Health,2001,43(6):331-338.
[8]Wang HM,Huang CQ,Zhang XC,Qu WS,Sun XH,Ding RG,et al.The time-course effect of perfluo⁃roisobutylene inhalation on endogenous nitric oxide and its synthase activity in rats[J].Bull Acad Mil Med Sci(军事医学科学院院刊),2010,34(6):560-562.
[9]Meng G,Zhao J,Wang HM,Ding RG,Zhang XC,Huang CQ,et al.Cellinjuries of the blood-air barrier in acute lung injury caused by perfluoroisobutylene exposure[J].J Occup Health,2010,52(1):48-57.
[10]Shao ZH,Wang HM,Chen JB,Zhu XX,Zhao J,Zhang TH,et al.The therapeutic effect of Qingkailing injection on perfluoroisobutylene-inhalation induced acute edema in mice[J].Chin Occup Med(中国职业医学),2006,33(4):241-243.
[11]Zhang TH,Shao ZH,Lin J,Xu J,Ding RG,Ruan JX,et al.A study of mechanism and effective ingredients of Qingkailing for PFIB inhalation induced pulmonary edema[J].Chin J Chin Mater Med(中国中药杂志),2007,32(1):53-57.
[12]Sun XH,Shao ZH,Zhang TH,Xu J,Zhao J,Hu ZL,et al.Inhibitive effect of Qingkailing on acute lung injury induced by perfluoroisobutylene inhalation[J].J Chem Defense(防化学报),2005,90(4):41-43.
[13]Sun XH,Zhang XC,Huang CQ,Meng G,Fu LY,Zhao J,et al.Application of pulmonary function test system in the study of perfluoroisobutylene inhalation toxicology[J].J Int Pharm Res(国际药学研究杂志),2011,38(6):445-447.
[14]Zhen JP.Pulmonary function test[M]∥Zhong NS,Liu YN.Respiratory Medicine(呼吸病学).2nd. Beijing:People′s Medical Publishing House,2012:218-235.
[15]Meng G,Wang HM,Zhao J,Ding RG,Zhang XC,Huang CQ,et al.Long-term effect of a single perfluoroisobutylene exposure induced acute lung injury in mice[J].Chin J PharmacolToxicol(中国药理学与毒理学杂志),2011,25(6):525-531.
[16]Yang CL,Zhou YP.Prevention and treatment of pulmonary fibrosis by Lifei Huaxian prescription and its influence on lung function and content of hydroxyproline[J].Chin J Exp Tradit Med Formulae(中国实验方剂学杂志),2011,17(9):194-198.
[17]Dai YM,Lu GC,Mao Y,Sun NL,Zhao Y.Respi⁃ratory System Toxicity Pathology(呼吸系统毒理学基础与临床)[M].Shanghai:the Second Mlitary MedicalUniversity Press,2012:67-94.
[18]Jiang DH.Molecular mechanisms of pulmonary fibrosis:what we know,what we don′t know[M]// Wang C.Respiratory and Critical Care Medicine 2010-2011(呼吸与危重症医学2010-2011). Beijing:People′s Medical Publishing House,2011:158-170.
Long-term toxicity to respiratory system of rats by low-dose perfluoroisobutylene exposure once and possible beneficial effect of early intervention via Qingkailing injection
LIU Fang1,2,ZHANG Dong-quan3,XU Xing-xing1,ZOU Chun-ping3,HU Zu-liang3,LIU Yue-zhen3,ZHAO Jian1,4,DING Ri-gao1,4
(1.Institute of Pharmacology and Toxicology,Academy of Military MedicalSciences,Beijing 100850,China;2.Clinic of the Information and Communication Bureau of Joint Staff Department,Central Military Commisson,Beijing 100840,China;3.Zhejiang Quhua Hospital,Quzhou 324004,China;4.State Key Laboratory of Toxicology and MedicalCountermeasures,Beijing 100850,China)
OBJECTIVE To clarify the long-term toxicity to the respiratory system in a rat model of acute lung injury(ALI)induced by a single low-dose of perfluoroisobutylene(PFIB)inhalation expo⁃sure,and observe the possible beneficial effect of early intervention via Qingkailing(QKL)injection. METHODS Totally 224 male Wistar rats were randomly divided into 4 groups:normalcontrolgroup in which air exposure was followed by a saline 10 mL·kg-1(ip),QKL control group in which QKL 10 mL·kg-1was ip given after air exposure,PFIB exposure group in which rats were exposed to PFIB 280 mg·m-3for 5 min only,and QKL treatmentgroup in which QKL 10 mL·kg-1was given ip at1 h after PFIB exposure. Lung functions of rats were measured at 24 h,3,6,12,24,36 and 48 weeks after exposure.Thearterialblood gas,lung coefficient,protein content in bronchoalveolar lavage fluid(BALF),hydroxy⁃proline(HYP)content in lung tissue and plasma,and other indicators were detected or analyzed. RESULTS Within 24 h after PFIB exposure,the lung coefficient and protein content in BALF were increased significantly(P<0.01),whereas the PaO2(P<0.01)and SaO2(P<0.05)indices in arterial blood decreased significantly in PFIB group compared with normal control.The inhalation time,exhalation time,tidalvolume(TV),expired volume(EV)and relaxed time were reduced significantly(P<0.01).However,all the above indicators returned to normal in 3 weeks,but TV,EV and peak expiratory flow were significantly lower than in normalgroup at 48 weeks(P<0.05).HYP contents in lung tissues,compared with normalcontrol(P<0.05),were reduced significantly within 24 h after PFIB exposure,increased significantly in 6 weeks(P<0.05),then returned to normal in 12 weeks.HYP contents in plasma increased significantly compared with normal control(P<0.05)within 24 h after PFIB exposure but returned to normal in 3 weeks.The protein contents in BALF of QKL treatment group were significantly lower than those in PFIB group(P<0.01)within 24 h after PFIB exposure. From 24 h to 24 weeks after PFIB exposure,changes of pulmonary functions were similar to those in PFIB group.At 48 weeks,TV and EV in QKL treatment group were more significantly increased than those in PFIB group(P<0.05).CONCLUSION Rats with ALI induced by a single low dose of PFIB exposure undergo compensatory repair except for pulmonary capacity and pulmonary ventilation functions. Early treatment with QKL reduces protein content of BALF and alleviates pulmonary edema,and has some beneficialeffecton lung function recovery later.
perfluoroisobutylene;acute lung injury;Qingkailing injection;pulmonary function;long-term toxicity
The projectsupported by NaturalScience Foundation of Zhejiang Province(Y13H240001)
ZHAO Jian,Tel:(010)66931646,E-mail:jian_zhao@126.com;DING Ri-gao,Tel:(010)66874561,E-mail:dingrigao@bmi.ac.cn
R827.12,R285.5
A
1000-3002-(2016)05-0517-09
10.3867/j.issn.1000-3002.2016.05.006
2015-08-06接受日期:2016-03-21)
(本文编辑:齐春会)
浙江省自然科学基金(Y13H240001)
刘芳,女,博士研究生,主管药师,主要从事化学毒物毒理学和抗毒药物药理学研究,E-mail:liufangtxb@ 163.com
赵建,E-mail:jian_zhao@126.com,Tel:(010)66931646;丁日高,E-mail:dingrigao@bmi.ac.cn,Tel:(010)66874561
