青海固沙草根际微生态体系中微生物多样性分析
2016-11-30李红晓张殿朋郝雅荞赵洪新
李红晓, 张殿朋, 郝雅荞, 赵洪新,4
(1. 沈阳师范大学 生命科学学院, 沈阳 110034;2. 北京市农林科学院 植物保护环境保护研究所, 北京 100097;3. 浙江理工大学 生命科学学院, 杭州 310018;4. 浙江省植物次生代谢重点实验室, 杭州 310018)
青海固沙草根际微生态体系中微生物多样性分析
李红晓1,2, 张殿朋2, 郝雅荞1,3, 赵洪新1,3,4
(1. 沈阳师范大学 生命科学学院, 沈阳 110034;2. 北京市农林科学院 植物保护环境保护研究所, 北京 100097;3. 浙江理工大学 生命科学学院, 杭州 310018;4. 浙江省植物次生代谢重点实验室, 杭州 310018)
青海固沙草(Orinuskokonorica)是生长于干旱、高海拔极端环境,特产于青海的一种优势种禾本科植物。从青海固沙草根际采集土壤,对样品中的微生物进行了分离鉴定及微生物多样性分析。共分离得到纯培养菌株 232株,隶属于15个属、23个种。数量和种类较多的是细菌,共112株,分别隶属于9个属的12个种,占可培养微生物的70%,单胞菌属占绝大部分;其次为放线菌43株,6个种,占总微生物量的27%;另含有1株酵母菌和4株真菌。该根际微生态体系中,可培养微生物Simpson多样性指数D=0.703,Shannon-Wiener指数H=13.877,Shannon-Wiener均匀度指数E=1.766,多样性等级为Ⅰ级以上。该研究结果表明:青海固沙草极端生境微生态中的可培养微生物,不仅丰富多样,而且具有对极端环境的应变机制为寻找和开发极端生境微生态的功能微生物资源提供了参考。
青海固沙草(Orinuskokonorica); 可培养微生物; 微生物多样性; 极端环境
0 引 言
微生物多样性是群落生态组成水平的主要特征之一,是群落生态环境优劣的重要指标。物种多样性越丰富,微生态系统受到外界干扰时的反馈调节能力越强,生态系统稳定性就越高[1]。1904年德国微生物学家Lorenz Hiltner提出“根际(Rhizosphere)”的概念[2],指出根际微生物(Rrhizosphere microbe)的组成、数量与植物营养类型与分泌物密切相关,而且植物对环境的适应能力也与根际微生物组成相关,形成了根际微生态体系内微生物与植物相互依存、互相和谐共生的关系[3]。植物根脱落的细胞及分泌物含有各种氨基酸、有机酸、碳水化合物等,对微生物生长十分有利,使根际微生态体系内的微生物数量比根际以外高几倍、几十倍甚至上千倍。根际微生态的微生物具有分解土壤中难溶性物质,增加矿质元素吸收,分泌生长刺激素的特征,微生物代谢分泌物及分解环境中营养物质,被植物吸收利用,提高了植物的抗逆性,形成了土壤-植物-微生物之间的养分和矿质元素良性循环,实现了植物—微生物之间的互利机制[4],所以对植物根际微生态微生物组成的解析,不仅可以得到更多的微生物资源信息,还可探究特定植物与其根际微生物之间的依存关系,是环境微生物研究的重要方向之一。
根际微生物具有多方面作用,除与植物体形成互利共生关系以外,大多数根际微生物具有促植物生长和抑制植物病原菌的作用。促植物生长作用机制可总结如下:1)产生植物激素类,植物激素是植物本身产生的一种化合物,在很低的浓度下就能够调节植物生长、发育和组织分化,许多细菌都发现具有产植物激素的能力,而大约有80%以上的从植物根际分离的细菌均具有产植物激素的能力,比如细胞分裂素、赤霉素、乙烯等;2)分泌某种酶调节植物生长和发育,如通过合成1-氨基环丙烷-1-羧酸盐脱氨酶(ACC)减少乙烯的水平;3)增强非共生固氮作用,除共生固氮菌以外,一些非共生根际微生物也能增加植物对N营养的吸收能力;4)增加植物所需的磷和其他微量元素的溶解和吸收能力,磷是植物生长和发育的必需元素,微生物能促进植物根际对磷的吸收率,增加土壤中可利用磷的的量,许多根际细菌通过分泌活性磷酸酯酶(有利于有机磷释放)溶解植物不能利用的矿物磷,或者产生有机酸而促使无机磷的释放;5)合成嗜铁素来增加植物根际可溶性铁的含量。除了以上5种直接刺激植物生长的机制以外,根际微生物还能通过减少或阻止植物病原菌对植物的侵害作用来间接发挥作用辅助植物生长,主要抑菌机理体现在:1)抗生作用,根际微生物能产生大量的次级代谢产物,被称为抗生素,在体外实验中被作为具有生物活性物质的指示剂;2)空间竞争和营养竞争;微生物按照其对环境的适应性和对植物脱落物的特定性依附作用而迅速增殖,抢先占据生态位,控制了病原菌的生长和增殖;拮抗菌通过释放嗜铁素和磷酸酯酶溶解环境中植物和病原菌无法利用的铁和磷等元素供植物利用,增加自身抵抗力。3)系统诱导抗性(ISR);根际微生物能诱导植物自身抗性的增强,研究表明诱导抗性与病原菌侵染过程中植物超微结构和细胞化学结构变化相关。
青海省位于我国青藏高原东北隅(31°39′-39°19′N,89°35′-104°4′E),全省面积约72万km2,平均海拔4000m以上,属高海拔的省份。禾本科(Gramineae)植物分布广泛,野生禾本科植物有55属,246种,31变种或亚种,青海特有种10种2变种[5-6]。草地植被组成每平方米牧草种类约为10~17 种,以旱生丛生禾草青海固沙草、芨芨草、疏花针茅等为优势种[7]。青海固沙草(Orinuskokonorica)是禾本科(Poaceae),画眉草族(Eragrostideae),三齿稃亚族(Tridentinae),固沙草属( Orinus)的1种多年生草本植物。1933年Hitchcock发现并命名[8]。1968年Tzvelev新增了1新种组合青海固沙草(O. kokonorica (Hao)Tzvel)[9],1994年赵南先等又在云南植物研究上报道了1 新种西藏固沙草( O. tibeticus N.X. Zhao)[10],至此, 整个固沙草属记载6 个物种,均分布在青藏高原[11]。
固沙草属(Orinus)是禾本科具有重要经济价值的高山特有属,具有较强的抗逆特性。目前有关青海固沙草的研究多集中在植物分类、牧草种植资源和对根际土壤的改良作用等方面[12-14]。本研究旨在了解青海固沙草根际微生物的群落结构,通过对其根际微生物多样性分析及菌种研究现状分析,探究青海固沙草根际微生态微生物与植物及土壤环境的相互关系,为深入研究高海拔优势种植物与其微生物的相互作用关系,开发微生物资源提供参考。
1 材料与方法
1.1 材料
1) 供试植物。青海固沙草(Orinuskokonorica),采自青海省境内G214自玛多至西宁沿途的天然草地中的土砾质荒漠草地,采集其根系及根际土壤。
2) 主要药品及仪器。KH2PO4、K2HPO4、MgSO4·7H2O、Na Cl、KNO3、Fe2(SO4)3、蛋白胨、葡萄糖、虎红、牛肉膏、可溶性淀粉、酵母提取物、琼脂;PCR仪、高压灭菌锅、无菌操纵台。
3) 培养基。马丁培养基:KH2PO41 g ,MgSO4·7H2O 0.5 g,蛋白胨5 g,葡萄糖10 g,琼脂20 g,孟加拉红0.033 g;牛肉膏蛋白胨培养基:牛肉膏5 g,蛋白胨10 g,Na Cl 5 g,琼脂16 g;高氏改良Ⅱ号培养基:可溶性淀粉20 g,Na Cl 0.5 g,KNO31 g,Fe2(SO4)30.01 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,琼脂20 g,pH 7.2~7.4;YPD培养基:酵母提取物10 g,蛋白胨20 g,葡萄糖20 g,琼脂16 g;PDA培养基:新鲜去皮土豆200 g,葡萄糖20 g,琼脂16 g。以上均为1 L固体培养基的用量。
1.2 方法
1.2.1 可培养微生物的分离纯化
可培养微生物多样性采用平板涂布法[15],固沙草根际及土壤5g用无菌水分别稀释10-2、10-3、10-4、10-5、10-65个浓度梯度均匀涂布于改良的高氏Ⅱ号、马丁氏、YPD加硫酸链霉素、PDA和牛肉膏蛋白胨培养基,依据常规培养经验及采集地的特殊环境条件确定培养条件为10 ℃、25 ℃、28 ℃培养。将所有的单菌落分别挑取至相应的培养基至纯化,20%甘油于-80 ℃下保藏备用。
1.2.2 菌种鉴定
分离纯化出的可培养微生物按照表1中的引物序列及PCR反应条件分类鉴定,PCR产物用1%琼脂糖凝胶电泳检测,样品送与北京市中美泰和生物技术公司测序。

表1 PCR扩增基因片段及反应条件
1.2.3 系统发育树构建
分子鉴定结果结合形态学特征分析,将确定为一属的菌株合并一类,利用MEGA6.06软件绘制简单系统发育树。
1.2.4 多样性分析
采用Simpson多样性指数(D)、Shannon-Wiener指数(H)和Shannon-Wiener均匀度指数3个指标衡量多样性及相关指标,
E=H/log2S
式中:S为菌种数;Pi为第i种的多度比例,可以用Pi=Ni/N求出;Ni是第i种的菌株数;N是所有菌株数总和。
2 结果与分析
2.1 根际微生物分离鉴定结果
牛肉膏蛋白胨、PDA、YPD、高氏改良Ⅱ号、马丁5种培养基分别分离得到51、19、50、74、38株,共232株。经分子鉴定后,已确定物种中细菌占总数70%(112株),其中单胞菌属53株,1株嗜麦芽窄食单胞菌,其余为鞘氨醇单胞菌;假单胞菌31株,其中6株恶臭假单胞菌,1株绿脓假单胞菌;节杆菌属13株;泛菌属9株,全部为成团泛菌;地杆菌属3株;类芽孢杆菌1株;枯草芽孢杆菌1株;表皮短杆菌1株;抗生素溶杆菌1株。放线菌占总数27%(43株),其中链霉菌属22株,分别为细黄链霉菌16株、栗褐链霉菌2株、蓝微褐链霉菌2株、三色链霉菌1株、双重轮纹链霉菌1株。酵母菌1株,占总数1%,为兰久浩酵母。真菌4株占总数2%,分别为高山被孢霉、外生菌根菌、大孢枝孢和细极链格孢。从微生物的种类及含量等方面分析,青海固沙草根际微生物种类丰富,囊括了真菌、细菌、放线菌和酵母菌在内的4种微生物,从含量上分析,单胞菌属和链霉菌属占据绝大多数,这两种菌在生物防治领域的应用上已有研究并效果良好,推测这两种菌在青海这种极端环境下为植物的生长和抗病方面起到了一定的促进作用。
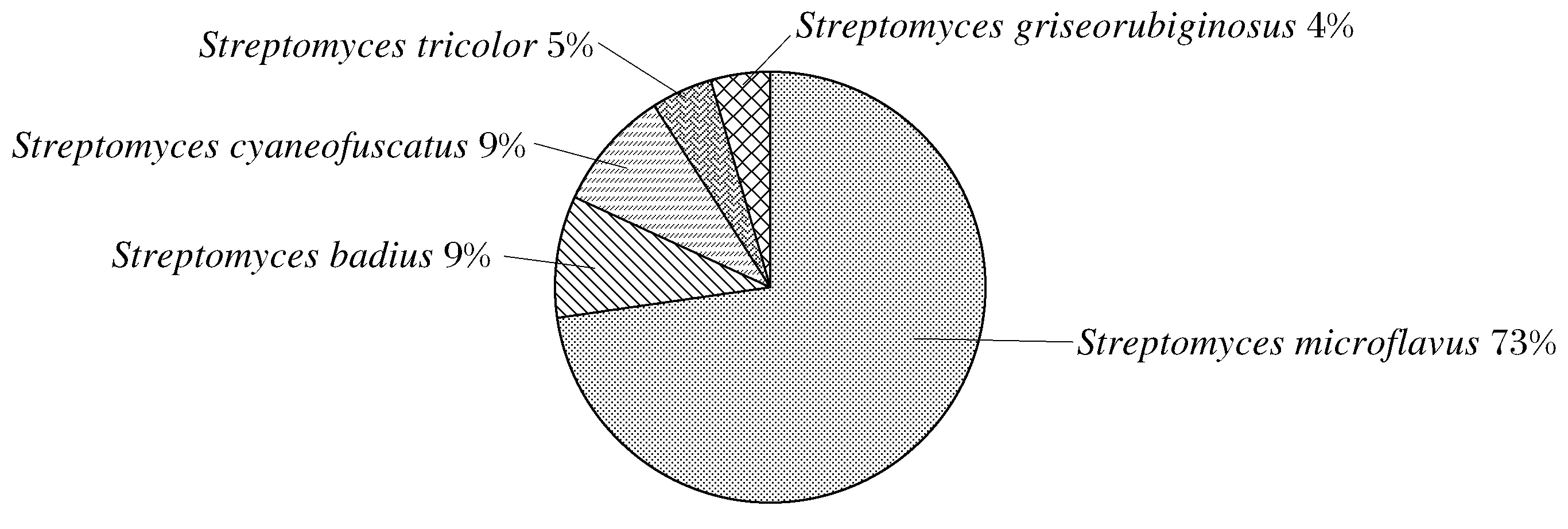
图1 青海固沙草根际细菌群落结构图

图2 青海固沙草根际放线菌群落结构图
2.2 根际微生物的多样性分析
根据2.2.4中的多样性衡量指标计算其数据分别为,Simpson多样性指数D=0.703,Shannon-Wiener指数H=13.877,Shannon-Wiener均匀度指数E=1.766。Simpson多样性指数主要关注局域均匀生境下的某物种数目的比例,Shannon-Wiener多样性指数主要指种类的丰富度和平均度,Shannon-Wiener均匀度指数是指一个生境中全部物种个体数目的分配状况,它反映的是各物种个体数目分配的均匀程度。Simpson多样性指数比Shannon-Wiener指数对物种均匀度更敏感,而Shannon-Wiener指数对物种丰富度更敏感,所以二者结合才能更好的呈现出合理的多样性解释,该多样性指数结果表明,青海固沙草根际微生物丰富度按照王兵等人划分的等级标准[16]属Ⅰ级以上,而Shannon-Wiener指数越高,生态系统的物种越丰富,生态系统越稳定,充分证明了青海固沙草根际含有丰富且均匀的微生物群落,相信这也与逆境环境下植物的生长有密切关系。
2.3 根际微生物系统发育树分析
结合菌落形态及显微镜检结果,参照Waalwijk等人[17]的方法将分子鉴定得到的序列剪切和对比后,菌株形态学相似、保守区序列相似度在99%以上的视为同一种类,保留其一。分析得到的25株典型微生物用MEGA6.06中的NJ(Neighbor-joining)方法构建系统发育树如图3。其中112株细菌隶属于9个属12种,43株放线菌均属于链霉菌属共包含6种,一株酵母菌为Guehomyces pullulans,4株真菌分别属于4个不同的种。充分印证了该生态系统的微生物物种的丰富度和均匀度,有待进一步探究此结果与特殊环境下植物的生长的关系,为后期研究做铺垫。
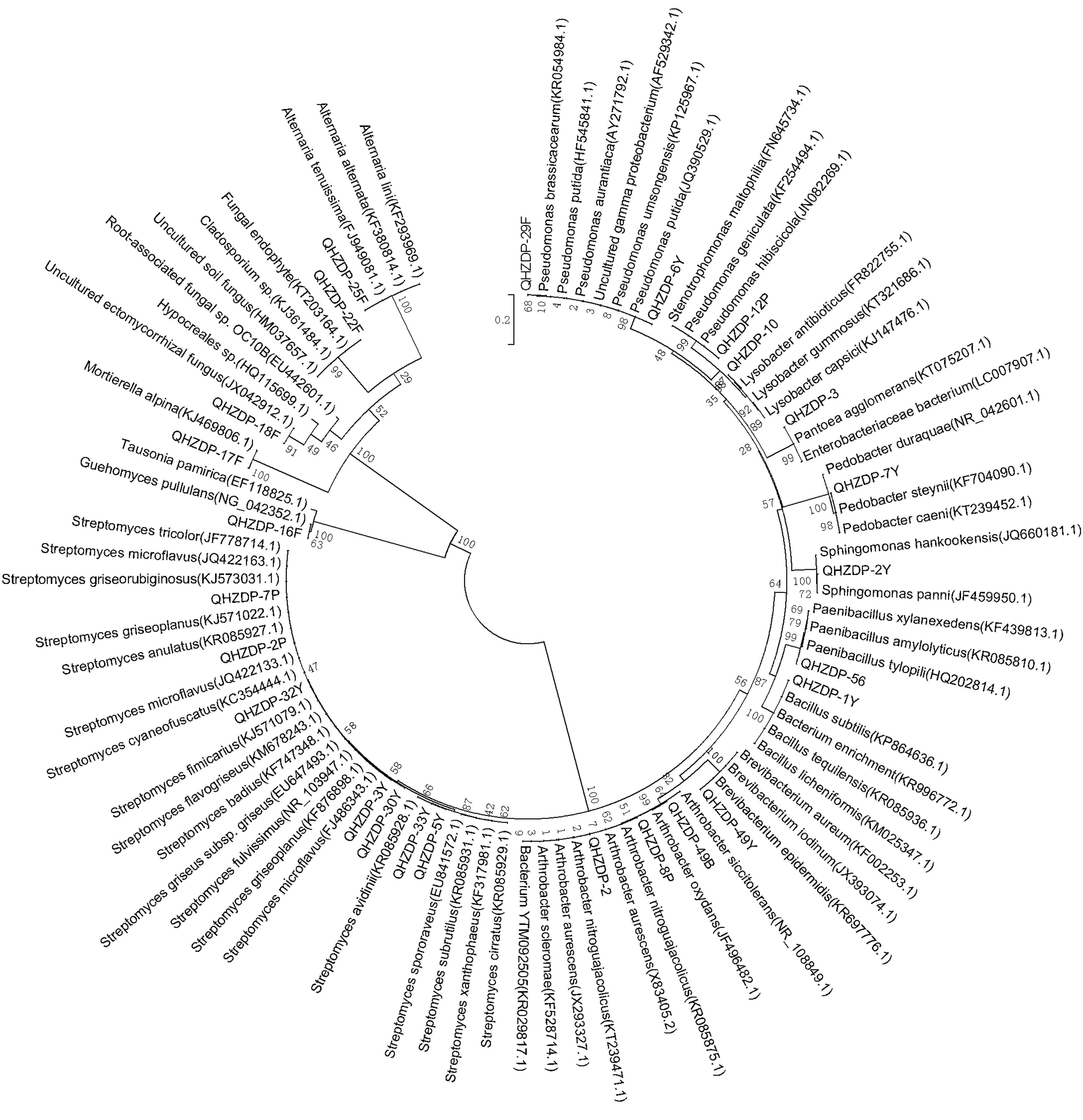
图3 青海固沙草根际微生物简单系统发育树
3 结 论
根际是指土壤中围绕着植物根的一个狭窄的区域,是植物根系与土壤微生物之间相互作用所形成的独特的微生态环境,也是植物-土壤-微生物相互作用的场所。植物根际富含糖类、有机酸、核苷酸、生长素等有机分泌物和根际脱落物,为根际微生物的生长繁殖提供了坚实的营养来源和物质基础,以致根际与根际外土壤相比有着数量更大、生物活性更强的微生物区系[18]。其次,细菌对各种根分泌物的利用率和敏感性远远超过放线菌、真菌等,所以细菌是数量最多的一类根际微生物。本研究中细菌总数占可培养微生物的70%,足以证明了细菌对根际营养物质的强烈利用率和根际定植力。杨尚东等也总结证明了土壤中可培养微生物数量均表现为:细菌>放线菌>真菌[19]。青海固沙草根际微生物共包括15个属的23个种,显示出较为丰富的微生物种群多样性,且由于根系分泌物的选择作用和环境因素,主要以假单胞菌、单胞菌和链霉菌属为主,占分离得到菌总数的78.4%。
迄今为止,分离得到的纯培养微生物约有10万种,据估计只占地球上实际存在的微生物总数的20%,而在人类仅开发利用了已发现微生物种数的1%[20]。运用可培养法获得的微生物种类在土壤微生物中只占有极小的一部分, 只有将可培养与未培养方法结合起来才能真正反映微生物的多样性。自1904年根际概念提出的100多年以来,有关根际微生物的研究不断发展。人们能从基因水平上了解微生物多样性,并证实环境中的微生物比预想的更加丰富。其研究方法大致可分为传统和现代两大类,前者包括菌群培养计数、菌体观察鉴别及土壤生物过程强度测定等,其最大弊端是大量的不可培养微生物[21-22];而现代分子生物学技术的应用极大地推动了根际微生物的研究,比如变性梯度凝胶电泳(DGGE)、温度梯度凝胶电泳(TGGE)、末端限制性片段长度多态性(T-RFLP),以及扩增rDNA限制酶分析(ARDRA)等[23-26]。肖炜等人同时应用PCR-DGGE和rRNA分析法对昆明盐矿古老岩盐沉积中的原核生物多样性进行了深入探究,结果表明昆明盐矿古老岩盐沉积含有大量未知的、未培养或不可培养的原核生物, 纯培养所得菌株并非该环境中的优势类群,在原核生物物种组成和丰度上, 已培养与此前的纯培养研究结果也存在一定差异[27]。因此,只有结合使用两类方法才能较全面地认识根际微生物真实的多样性,有必要应用现代分子生物学技术和多项分类系统,并结合植物学、土壤学、矿物学等基础研究手段,阐明微生物多样性与植物生长、代谢产物、矿物风化和污染物高效修复技术等的相互关系, 对土壤-植物-微生物之间的关系探究具有深远意义。
土壤微生物多样性与植物土传病害抑制水平密切相关,其中根际微生物具有重要的作用[28]。青海固沙草根际分离的微生物,如芽孢杆菌,由于芽孢的特殊结构,不仅具有稳定高效的抗菌作用,还是植物根际促生菌;抗生素溶杆菌有效控制魔芋软腐病, 还可增产14.30%[29];丛枝菌根真菌与植物共生可以增强植物的抗逆性、抗病性及耐病能力[30];链霉菌参与聚ε-L-赖氨酸(ε-PL)的生物合成[31],使该菌对细菌、酵母菌及真菌等均有良好的抑制效果,且已证实为对人体无害的营养物质,在人体内只降解为人体必需氨基酸[32];鞘氨醇单胞菌,近年来被认为是一类具有代谢多样性的微生物资源,与单胞菌和芽孢杆菌混合使用可以将浓度为200μg·L- 1的MC-RR完全降解[33]。成团泛菌是泛菌属的模式菌株,同时是人类的条件致病菌,研究表明,成团泛菌中基因yhfK可调控其对植物致病性,能够在玉米上引起细菌性干茎腐病[34];目前对兰久浩酵母的研究主要集中在其嗜冷耐低温方面,其在逆境时可以通过海藻糖的含量、Tps1酶活、Tps1基因的相对表达量以增强细胞组分抵抗极端恶劣环境的能力[35];高山被孢霉是α-亚麻酸、二高-γ-亚麻酸、花生四烯酸和二十碳五烯酸的主要生产菌株[36];外生菌根菌可增加895杨对矿质营养的吸收[37];大孢枝孢是番茄煤污病的致病菌,目前尚未报道对此病有预防措施;极细链格孢菌的遗传转化系统在2008年已经成功的建立[38],其还对水产养殖病原菌鳗弧菌有良好的抑菌效果,李冬梅更是首次从中分离了其8种代谢物质[39]。
综上分析,青海固沙草根际微生物共包含15个属的23种微生物种类,具有很好的物种丰富度和均匀度;其次,通过以往报道总结了该根际微生物对环境的营养固定与吸收,进而促进植物生长、生物抗菌活性、极端环境下的应变机制等各方面的作用,证明了植物与微生物之间的互利共生关系;第三,自青海固沙草根际分离得到的微生物在极端环境生长不仅有极强的生存适应能力,还在促生长、对污染物的修复和环境优化等方面各具特色,为极端环境功能微生物的寻找和筛选提供有益信息。
[ 1 ]刘振国,李镇清. 退化草原冷蒿群落13年不同放牧强度后的植物多样性[J]. 生态学报, 2006,26(2):475-480.
[ 2 ]HILTNER L. Über neuere Erfahrungen und probleme aufdem Gebiete der Bodenbakteriologie unter besonderer Berücksichtigung der Gründüngung und Brache[J]. Arb DLG, 1904,98:59-78.
[ 3 ]ANTON H, MICHAEL R, MICHAEL S. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research[J]. Plant and soil, 2008,312(1/2):7-14.
[ 4 ]徐文静,靳晓东,杨秋生. 植物根际微生物的影响因素研究进展[J]. 河南农业科学, 2014,43(5): 6-12.
[ 5 ]卜海燕,任青吉,徐秀丽,等. 青藏高原东部高寒草甸54种禾本科植物种子的萌发特性[J]. 植物生态学报, 2006,30(4):624-632.
[ 6 ]才红梅,吴阿迪. 青海省土砾质荒漠草地分布及基本特征[J]. 青海草业, 2011,20(2):16-19.
[ 7 ]辛玉春. 青海省温性草原类草地的分布特征[J]. 青海草业, 2014,23(1):35-42.
[ 8 ]HITCHCOCK A S. New grasses from Kashmir[J]. WAS, 1933,23:134-136.
[ 9 ]TZVELEV N N. Planta asiae centralium[J]. Aedibus: Nauka, 1968,4:43.
[10]赵南先,李名非. 西藏禾本科植物新分类群与新记录种[J]. 云南植物研究, 1994,16(3):228-230.
[11]苏旭,岳伟,刘建全. 青藏高原固沙草属种质资源收集和保存[J]. 植物分类与资源学报, 2013,35(3): 343-347.
[12]刘玉萍,苏旭,周勇辉,等. 固沙草属的分类现状及主要存在的问题[J]. 草地学报, 2015,23(3):453-456.
[13]铁生年,马晓芳,王宁峰. 青藏高原沙漠化地区植物特性与分布状况分析[J]. 价值工程, 2015,34(26):163-167.
[14]辛玉春. 青海天然草地牧草营养成分分析[J]. 青海草业, 2011,20(1):26-31+9.
[15]陆俊锟. 华南三地红树林土壤微生物区系及PGPR 多样性研究[D]. 南宁: 广西大学, 2008.
[16]王兵,郑秋红,郭浩. 基于Shannon-Wiener指数的中国森林物种多样性保育价值评估方法[J]. 林业科学研究, 2008(2):268-274.
[17]WAALWIJIK C, BAAYEN R P, DE KONING J R A, et al. Ribosomal DNA analyses challenge the status of fusarium sections liseola and elegans[J]. Sydowia, 1996,48(1):90-104.
[18]陆雅海,张福锁. 根际微生物研究进展[J]. 土壤, 2006,38(2):113-121.
[19]杨尚东,吴俊,谭宏伟,等. 南方红壤区西南桦和马尾松人工林土壤微生物活性及细菌多样性比较[J]. 生态环境学报, 2014,23(3):415-422.
[20]沈萍,陈向东. 微生物教程[M]. 北京:高等教育出版社, 2006:3-10.
[21]林先贵,胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报, 2008,45(5):892-900.
[22]林先贵. 土壤微生物分子生态学与经典生物学的和谐发展[C]∥中国土壤学会第十一届全国会员代表大会暨第七届海峡两岸土壤肥料学术交流研讨会论文集(下). 北京:中国土壤学会, 2008:1.
[23]HELENA L P, ESTHER J, ANTONIO M B. PCR-DGGE assessment of the bacterial diversity in Spanish-style green table-olive fermentations[J]. Int J Food Microbiol, 2015,205(16):47-53.
[24]KRISHNA K. KADALI, ESMAEIL S, et al. RNA-TGGE, a tool for assessing the potential for bioremediation in impacted marine ecosystems[J]. J Mar Eng Technol, 2015,3(3):968-980.
[25]BLAUD A, DIOUF F, HERRMANN A M, et al. Analysing the effect of soil organic matter on bacterial communities using T-RFLP fingerprinting: different methods, different stories[J]. Biol Fert Soils, 2015,51(8):959-971.
[26]沙月霞. 污染土壤微生物多样性研究方法的比较[J]. 宁夏农林科技, 2014,55(3):24-28.
[27]肖炜,彭谦,刘宏伟,等. 昆明盐矿古老岩盐沉积中的原核生物多样性[J]. 微生物学报, 2007,47(2):295-300.
[28]GARBEVA P,VAN V J A,VAN E J D. Assessment of the diversity and antagonists towards rhizoctonia solani AG3 of Pseudomonas species in soil from different agricultural regimes[J].Microbiol RES, 2004,47(1):51-64.
[29]姬广海,吴亚鹏,白学慧,等. 抗生素溶杆菌对魔芋软腐病和根际微生物多样性的影响[J]. 江西农业大学学报, 2009,31(3):499-503.
[30]AKKOPRU A, DEMIR S. Biological control of Fusarium wilt in tomato caused by Fusarium oxysporumf sp. lycopersici by AMF glomus intraradices and some rhizobacteria[J]. J Phytopathol, 2006, 153(9):544-550.
[31]HIDEO H, MUNENORI T, MASAYUKI S, et al. Biosynthesis of poly(ε-L-lysine)s in two newly isolated strains ofStreptomycessp.[J]. Appl Microbiol Biot, 2006,73(2):321-331.
[32]CHANG S S, LU W Y, PARK S H, et al. Control of foodborne pathogens on ready-to-eat roast beef slurry byε-polylysine[J]. International journal of food microbiology, 2010,141(3):236-241.
[33]徐慧敏,闫海,马松,等. 鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解[J]. 中国环境科学, 2014,34(5):1316-1321.
[34]曹慧英,张力群,朱振东,等. 成团泛菌对玉米自交系PS056致病性基因fK的克隆[J]. 中国农业科学, 2011,44(2):299-306.
[35]ZHANG Xue, HUA Mingxia, SONG Chunli, et al. Occurrence and diversity of marine yeasts in antarctica environments[J]. J Ocean U China, 2012,11(1):70-74.
[36]JI Xiaojun, ZHANG Aihua, NIE Zhikui, et al. Efficient arachidonic acid-rich oil production by Mortierella alpina through a repeated fed-batch fermentation strategy[J]. Bioresource Technol, 2014,170: 356-360.
[37]宋微,吴小芹,叶建仁. 6种外生菌根真菌对895杨矿质营养吸收的影响[J]. 南京林业大学学报(自然科版), 2011,35(2):35-38.
[38]万英,张大军,黄云,等. 以G418为筛选标记的极细链格孢菌(Alternariatenuissima)原生质体转化体系的建立[J]. 安徽农业科学, 2008,36(29):12602-12604.
[39]李冬梅,武昕,季欣岑,等. 植物内生真菌AlternariatenuissimaSY-P-07次级代谢产物的研究[J]. 中国药学杂志, 2014,49(6):464-468.
Analysis of microbial diversity of root microecosystem ofOrinuskokonorica
LIHongxiao1,2,ZHANGDianpeng2,HAOYaqiao1,3,ZHAOHongxin1,3,4
(1. College of Life Science, Shenyang Normal University, Shenyang 110034, China; 2. Institution of Plant and Environment Protection, Beijing Academy of Agriculture and Forestry Science, Beijing 100097, China; 3. College of Life and Science, Zhejiang Sci-Tech University, Hangzhou 310018, China; 4. Key Laboratory of Plant Secondary Metabolism of Zhejiang Province, Hangzhou 310018, China)
The diversity and abundance of culturable microbiome in the root microecosystem ofOrinuskokonorica, a typical and representative plant in Qinghai area, was investigated in this study. Total 232 cultured microorganisms belonged to 15 genera and 23 species were isolated and identified. 112 bacteria, which was 70% cultured microorganisms, belong to 9 genera and 12 species. 43 actinomycetes which was 27% cultured microorganisms, belong to 6 species, and 1 yeast strain and 4 fungi strains were found. The microbial Simpson diversity index,D=0.703, Shannon-Wiener index,H=13.877, Shannon-Wiener Evenness index,E=1.766, and the level of species diversity was Ⅰ. These results are shown that culturable microorganisms isolated from the root microecosystem ofOrinuskokonoricais a very rich diversity of microbial taxa and has the mechanism for adapting extreme environment.
Orinuskokonorica; cultured microorganisms; microbial diversity; extreme environment
2015-12-20。
辽宁省科技厅科学事业公益研究基金资助项目(2014003020)。
李红晓(1989-),女,河北邯郸人,沈阳师范大学硕士研究生; 通信作者: 赵洪新(1967-),男,辽宁铁岭人,浙江理工大学教授,博士。
1673-5862(2016)02-0227-07
Q938.1
A
10.3969/ j.issn.1673-5862.2016.02.021
