中药提取物抗鸡传染性支气管炎病毒的体外活性研究
2016-11-30王玉堃山东迅达康兽药有限公司山东济南250300
李 丽 谷 颖 王玉堃 (山东迅达康兽药有限公司 山东 济南 250300)
试验研究
中药提取物抗鸡传染性支气管炎病毒的体外活性研究
李 丽 谷 颖 王玉堃 (山东迅达康兽药有限公司 山东 济南 250300)
将4种中药提取物稀释成安全浓度范围内的高、中、低3种浓度,分别与IBV以3种方式加入到培养成单层的鸡胚成纤维细胞(CEF)的培养体系中,用MTT法测定IBV感染细胞能力的变化。结果表明,B提取物在先加中药、后加中药,与病毒一起加,其A570值均高于病毒组,B具有较好的预防和治疗传染性支气管炎病毒的作用。
中药提取物 鸡胚成纤维细胞 传染性支气管炎病毒
传染性支气管炎(IB)是由病毒引起的一种仅发生于鸡的急性、高度接触性的呼吸道疾病[1]。以呼吸道症状、产蛋下降、肾脏病变等为特征。自1988年以来,IB在我国大部分地区相继流行,其发病率高达100%,死亡率10%~30%。国内每年由此病造成的经济损失超过10亿元[2]。在对病毒性疾病的治疗中,西药和中药都各自有其优缺点。西药虽然见效快但毒副作用大,易产生耐药性。现代药理学研究表明,许多中草药及其多种成分都有很好的抗病毒作用,且具有作用独特,抗病毒谱广、毒副作用小、疗效显著等优点正日益成为抗病毒新药研究的热点。为研究具有较好抗病毒能力的中药复方制剂,前期筛选确定了具有抗病毒活性最强的4味中药(板蓝根、大青叶、黄连、淫羊藿),将4味中药以不同比例配伍提取浓缩得到提取物A、B、C、D。本试验以传染性支气管炎病毒
(IBV)为研究对象,在测定A、B、C、D 4种提取物对鸡胚成纤维细胞(chickembryo fibroblast,CEF)生长均呈促进作用的基础上选取安全浓度范围内的高中低3种浓度,分别与IBV以3种方式加入到培养24h已长成单层的CEF中,测定他们对IBV病毒感染细胞能力的影响,选择药材的最佳配比,为研制抗IBV病毒的中药复方制剂提供理论依据。
1 材料与方法
1.1 试验药品 板蓝根、大青叶、黄连、淫羊藿购自济南中药批发市场,以上4味药材以(1∶1∶1∶1;1∶2∶1∶1;
1∶2∶2∶1;1∶1∶2∶1)不同比例,加水煎煮2次,2h/次,合并煎液,滤过,滤液浓缩至相对密度为1.20~1.25(70~80℃测)的清膏,冷至40℃时缓缓加入乙醇,充分搅拌,使含醇量为60%,静置12h使沉淀,滤取上清液,遗留沉淀再加60%乙醇适量,充分搅拌,静置12h,滤取上清液,合并二次上清液,回收乙醇至无醇味,浓缩至1ml含1g生药,收集浓缩液,滤过,灌装,灭菌,即得。以上不同比例中药提取浓缩得样品为A、B、C、D。根据对CEF细胞安全浓度的测定结果[3],用细胞维持液分别将A、B、C、D稀释成高、中、低3种浓度。
1.2 鸡胚 9d SPF鸡胚,购于山东家禽研究所。
1.3 病毒 IBV-M41株由中国农业大学某教授提供,本实验室自行传代保存。将病毒按常规方法接种9日龄SPF鸡胚,37℃恒温培养72h,收获尿囊液,连续鸡胚传代得IBV。按Reed-Muench法[4]测定IBV对CEF半数组织培养感染剂量(TCID50)为1×10-6/0.1ml,用细胞维持液配成100 TCID50浓度备用。
1.4 主要仪器和试剂 MEM细胞培养液,Gibco公司产品,按说明书配制,再加入犊牛血清(Gibco公司产品),达5%为细胞生长液、2%为细胞维持液,再按常规量加入谷胺酞氨和双抗;胰蛋白酶,进口分装,用PBS(pH值7.4)配制成0.25%溶液,0.22μm混合纤维素酯微孔滤膜过滤除菌,分装后-20℃保存备用;MTT(四唑溴盐)溶液,Sigma公司产品,按说明书配制,使终浓度为5mg/ml,0.22μm微孔滤膜过滤除菌,分装后4℃冰箱保存,1周内用完。MCO-15AC型CO2培养箱,37×B©型生物倒置显微镜,DG-5031型酶联免疫检测仪,BT125D型电子分析天平,MH-1型微量振荡器,24孔、96孔细胞培养板,细胞培养瓶等。
1.5 试验方法 根据文献[4]介绍的方法制备CEF,将细胞数调整至1×106个/ml后加入到96孔细胞培养板中,每孔100μl,37℃、5% CO2条件下培养24h,细胞长成均匀单层后,翻转细胞板于灭菌纱布上倾去生长液,用D-Hank′s液洗两次,按以下3种方式[5]开始分组加药。(1)先加中药后接种病毒(药物预防试验):相当于先加入中药对细胞进行预防,能否提高细胞抗病毒能力。于各孔中加入高、中、低3种不同浓度的中药100µl,每种浓度重复4孔,继续培养24h后,弃去各孔中药,再每孔加入100TCID50病毒液100µl;每种浓度分别设病毒对照组(细胞维持液100µl、病毒液100µl)、细胞对照组(只加200µl细胞维持液)和空白对照组(无细胞,仅在培养细胞时加100µl细胞生长液,后分别加细胞维持液100µl、细胞维持液100µl),继续培养,以加入病毒液后开始计算时间,每隔12h观察1次CPE变化,详细记录结果,直至病毒对照组出现典型的CPE病变记录为终点(一般为72h),用MTT法[6]测定570nm处A570值。(2)接种病毒后加中药(药物治疗试验):每孔加入100TCID50病毒液100µl,先每种稀释浓度重复4孔,同时设空白对照组、病毒对照组和细胞对照组,37℃、5%CO2培养箱中培养2h后,弃去各孔病毒液,再加入高、中、低不同浓度中药100µl/孔。(3)中药和病毒同时加入(直接作用试验):将100TCID50病毒液与各浓度中药成分4℃条件下感作2h,每孔100µl,做对照的病毒液以及细胞维持液4℃相同处理,同时设空白对照组、病毒对照组和细胞对照组。此外,设仅加维持液的无细胞孔作为测定时调零孔。(4)当药物的A570值显著大于病毒对照组时,表明有显著的抵抗传染性支气管炎病毒感染细胞的作用。
1.6 数据处理 计算4孔平均值和标准差,数据以Means±SD表示,用SPSS统计分析软件进行方差分析和多重比较。病毒抑制率通过方差分析比较不同加药方式间的差异性,显著性水平P<0.05。
2 结果
2.1 A组的变化 先加中药、后加病毒,125μg/ml和250μg/ml浓度A570值显著高于病毒对照组(P<0.05);先加病毒、后加中药,250μg/ml浓度A570值显著高于病毒对照组(P<0.05);中药与病毒同时加,250μg/ml浓度A570值显著高于病毒对照组(P <0.05)(表1)。

表1 A在先加、后加和与病毒同时加入时各组细胞A570值
2.2 B组的变化 先加中药、后加病毒时,31.25μg/ml、62.5μg/ml和125μg/ml浓度组的A570值显著高于病毒对照组(P<0.05);先加病毒、后加中药时,31.25μg/ml和62.5μg/ml浓度组A570值显著高于病毒对照组(P<0.05);与病毒同时加,125、62.5、31.25μg/ml浓度A570值显著高于病毒对照组(P<0.05)。31.25μg/ml A570值高于细胞对照组(表2)。
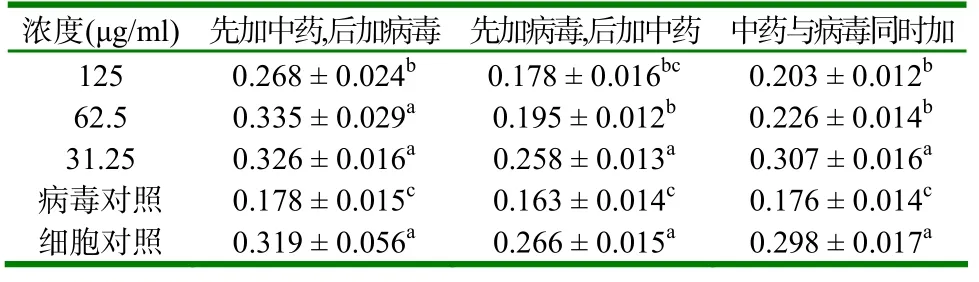
表2 B在先加、后加和与病毒同时加入时各组细胞A570值
2.3 C组的变化 先加中药、后加病毒,16μg/ml浓度A570值显著高于病毒对照组(P<0.05);先加病毒、后加中药,32μg/ml浓度A570值高于病毒对照组,但不显著,中、低浓度的A570值低于病毒对照组;中药与病毒同时加,32μg/ml和8μg/ml浓度组的A570值稍高于病毒对照组(表3)。
2.4 D组的变化 先加中药、后加病毒,250μg/ml和 125μg/ml浓度A570值显著高于病毒对照组(P<0.05);先加病毒、后加中药,125μg/ml浓度A570值高于病毒对照组,但不显著;与病毒同时加,250μg/ml浓度A570值显著高于病毒对照组(P<0.05)(表4)。

表3 C在先加、后加病毒和与病毒同时加入时各组细胞A570值

表4 D在先加、后加和与病毒同时加入时各组细胞A570值
3 讨论
3.1 中药复方提取物对IBV感染CEF能力的影响 从试验结果来看,先加药物后加病毒时,A的高、中浓度,B的高、中、低浓度,C的中、低浓度,D的高、中、低浓度,疗效都较好;先加病毒后加药物时,A的高浓度,B的中、低浓度,C的中、低浓度,效果较好;药物与病毒同时加,A的高浓度,B的高、中、低浓度,C的中浓度,D的高、中浓度效果较好。可见,A、B、C、D在先加药物后加病毒时疗效较好,即对IBV有较好的抑制作用,B对IBV还具有较好的治疗作用。先加药后加病毒的方式,和临床上的预防非常相似,故该试验的结果可以作为临床上预防用药的参考。中药复方不同提取成分都有不同程度的抗病毒作用,D值不但反应活细胞的多少,也反映细胞的病变程度,间接地反映病毒增殖的程度,细胞被病毒感染破坏或干扰了功能后,细胞受到损坏,线粒体的活性下降,可降低对四唑盐在细胞内形成晶体的能力,随着病毒在细胞内不断增殖,死亡的细胞越多,生成的甲簪结晶就越少,其D值就越低[7]。
3.2 中药提取物抑制病毒感染细胞能力与浓度关系 试验结果发现,先加药物后加病毒时,A的高、中浓度,B的高、中、低浓度,C的中、低浓度,D的高、中、低浓度,疗效都较好;先加病毒后加药物时,A的高浓度,B的中、低浓度,C的中、低浓度,效果较好;药物与病毒同时加,A的高浓度,B的高、中、低浓度,C的中浓度,D的高、中浓度效果较好;说明中药抗病毒需要有合适的浓度,并不是浓度越高疗效越好。
3.3 作用机理 该试验显示,提取物A、B、C、D对先加入病毒时起到显著的抑制作用,表明中药成分是通过改变细胞膜表面的病毒吸附蛋白受体或作用于细胞内而提高其抵抗能力,阻止病毒侵入细胞而发挥预防作用,或通过直接灭活病毒来保护细胞[8-9],B在先接种病毒及与病毒同时加入时也起到了抑制作用,说明B在细胞受病毒感染后也能发挥治疗作用。
本研究表明提取物B在预防和治疗方式中,对IBV感染CEF均有很好的抑制效果,故选板蓝根、大青叶、黄连、淫羊藿最佳比例为1∶2∶1∶1,为研制抗IBV病毒的中药复方提供理论依据。
[1] 甘孟候. 中国禽病学(第1版)[M]. 北京∶ 中国农业出版社, 1999∶43-49.
[2] 田占成, 孙永科, 王云峰等. 表达传染性支气管炎病毒S1基因重组鸡痘病毒的构建[J]. 中国预防兽医学报,2006, 4∶ 466-470.
[3] 刘家国, 胡元亮, 陈玉库等. 几种天然药物成分在体外CEF中最大安全浓度的测定[J]. 动物医学进展, 2002, 23(3)∶ 88-91.
[4] 殷震, 刘景华. 动物病毒学第2版[M]. 北京∶ 科学出版社, 1997∶204-246.
[5] Robert M K, Stephen M P, Marie B, et al. Consistencyof hemodynamic responses to cold stress in adoles-cents[J]. Hypertension, 2000, 36∶ 1013-1017.
[6] 程宝鸾. 动物细胞培养技术[M]. 广州∶ 华南理工大学出版社, 1999∶ 103-131.
[7] 孔祥峰, 胡元亮, 刘家国等. 10种中药成分对单层鸡胚成纤维细胞增殖的影响[J]. 南京农业大学学报, 2003, 26(2)∶ 84-87.
[8] 李继强, 陈萦匾, 曾民德等. 氧化苦参碱抗乙型肝炎病毒的体外实验研究[J]. 中华消化杂志, 2001, 21(9)∶ 550.
[9] 杨志伟, 周娅, 曹秀琴. 苦豆子生物碱体外抗柯萨奇B3病毒的作用[J]. 四川中医, 2003, 21(3)∶ 14.
S853.73+3
A
1007-1733(2016)11-0001-03
2016-08-10)
