不同麦区小麦品种穗发芽抗性及其与穗部性状的相关性
2016-11-30马文洁张传量宋晓朋崔紫霞孙道杰
马文洁,张传量,宋晓朋,冯 洁,崔紫霞,孙道杰
(西北农林科技大学农学院,陕西杨凌 712100)
不同麦区小麦品种穗发芽抗性及其与穗部性状的相关性
马文洁,张传量,宋晓朋,冯 洁,崔紫霞,孙道杰
(西北农林科技大学农学院,陕西杨凌 712100)
为探究不同麦区小麦品种的穗发芽抗性及其与穗部性状的相关性,以黄淮冬麦区(南片和北片)、北部冬麦区及长江中下游麦区的235份小麦品种为试验材料,选用2个能够有效用于穗发芽抗性筛选的分子标记Vp1B3和WMC104,结合整穗发芽试验,对各麦区小麦品种穗发芽抗性进行鉴定,并分析穗发芽抗性与穗部及籽粒性状间的相关性。结果表明,长江中下游麦区小麦穗发芽抗性显著高于其他三个麦区,其供试小麦品种60%以上达到抗性等级,其余三个麦区中达到抗性等级的品种均不超过30%;供试品种中,扬麦10号、荆麦103、川农16等15个品种为高抗穗发芽品种,发芽率均值为4.85%,是穗发芽抗性育种中的重要抗性资源。整穗发芽率与穗部及籽粒性状相关性分析表明,穗发芽率与籽粒颜色极显著正相关,与小穗密度、千粒重、籽粒宽度等显著正相关。在育种过程中,可将籽粒颜色、小穗密度、千粒重及籽粒宽度等作为抗穗发芽小麦品种的重要参考指标。
小麦;穗发芽;抗性鉴定;相关性分析
小麦收获前遇连续阴雨天气时,籽粒在穗上发芽的现象即为穗发芽(pre-harvest sprouting,PHS)。穗发芽引发籽粒内部储藏物质消耗,不仅降低小麦产量,且严重影响小麦的加工品质及种用价值[1-3]。我国长江中下游流域和西南麦区小麦收获前易发生连续降雨,因而穗发芽发生频繁。因此,阐明小麦穗发芽发生机理,提高品种穗发芽抗性尤为必要。
小麦的穗发芽是一个复杂的过程,受多因素影响,如小麦穗部及籽粒性状、籽粒休眠特性、α-淀粉酶活性及生长调节物等[2],其中有关籽粒休眠特性和籽粒颜色对穗发芽影响的研究居多。刘 莉等[4]指出,种子在休眠期时水解酶的产生受到抑制,种子萌发受阻;种子休眠期越长,穗发芽抗性越强。籽粒颜色对穗发芽抗性的影响与种皮中色素含量有关,种皮细胞中含有较多色素,使种皮细胞加厚,进而阻止内外气体交换,导致种子处于休眠状态[2]。粒色深的小麦休眠期一般较长,不易穗发芽,且粒色越深,穗发芽抗性越强。小麦穗发芽过程中,α-淀粉酶通过分解储藏物质,为籽粒萌发提供能量,可促进穗发芽,因此,α-淀粉酶活性低的品种穗发芽抗性更高。在小麦籽粒中,GA可促进α-淀粉酶合成,ABA抑制α-淀粉酶合成,二者通过调控α-淀粉酶的含量对穗发芽抗性产生影响。除此之外,穗子的大小、疏密、蜡质有无及籽粒大小、结构等对小麦穗发芽也有不同程度的影响[2]。探究穗部、籽粒形态与小麦穗发芽抗性的关系有利于更全面了解穗发芽抗性机理,但目前相关研究较少。
小麦穗发芽抗性鉴定方法有多种,应用较多的主要有籽粒发芽法、α-淀粉酶活性测定法及整穗发芽法等。籽粒发芽法仅能反应种子本身的休眠情况,不能反映小麦穗发芽的总体抗性[5];α-淀粉酶活性测定法检测过程相对繁琐,难以对大批量试验材料进行鉴定。整穗发芽法则更接近于生产实际,能较好的反应小麦穗发芽的综合抗性,且操作简单,适合大批量材料的综合测定,因此通常以整穗发芽率来鉴定小麦的穗发芽抗性。
近年来,与穗发芽抗性有关的QTL得到广泛关注,目前已知与穗发芽抗性有关的主效QTL在2A、3A、4A、4B、4D、6B、7D等染色体上都有分布,其中关于3A染色体的报道居多[6-10]。此外,与穗发芽抗性有关的分子标记也逐渐被开发出来。Yang等[11]根据玉米中控制籽粒休眠的转录子Vp1在小麦中开发了一个与种子休眠性相关的STS标记Vp1B3,并将其定位于3BL上。Roy等[10]利用重组自交系群体对穗发芽抗性标记进行筛选发现,位于6B上的STMS标记WMC104与穗发芽抗性紧密相关。经验证,Vp1B3和WMC104均可有效用于小麦穗发芽抗性筛选[12]。因此,将这两个分子标记与穗发芽试验结合起来对小麦穗发芽抗性进行综合鉴定,可以有效提高穗发芽抗性的选择效率。
鉴于此,本研究利用分子标记Vp1B3和WMC104并结合整穗发芽鉴定试验,对黄淮冬麦区、北部冬麦区、长江中下游麦区共235份小麦品种进行穗发芽抗性鉴定,并对穗发芽率与穗部及籽粒性状进行相关性分析,以期发现穗发芽抗性与穗部及籽粒性状之间的关系,促进小麦穗发芽抗性研究进展。
1 材料与方法
1.1 材 料
供试材料为黄淮冬麦区(南片和北片)、北部冬麦区及长江中下游麦区主栽及历史品种共235份,所有材料于2014年10月种植于陕西杨凌西北农林科技大学育种试验田(34°17′N,108°04′E),试验采用随机区组排列,3次重复,每小区2行,行长2 m,行距0.25 m,株距3 cm。常规田间管理。
1.2 方 法
1.2.1 相关性状调查
2015年6月小麦成熟期田间调查穗部农艺性状,相关性状与调查标准如下:
穗型:分纺锤形(穗子两端尖,中部稍大)、长方形(穗子上、下、正面、侧面基本一致)、圆锥形(穗部下大、上小,或分枝呈圆锥状)3种。
穗色:根据穗子表面蜡质的有无,分灰、白2色。
穗长:每份材料随机选10个穗子,分别测量穗基部第一个小穗到穗顶部(麦芒除外)的距离。
小穗密度:每份材料随机选10个穗子,分别测量小穗数,小穗密度=小穗数/穗长。
穗粒数:每份材料随机选10个穗子,分别脱粒计量籽粒数。
收获后室内调查籽粒相关性状,相关性状与调查标准如下:
籽粒颜色:目测,分红色和白色2种。
籽粒长度、宽度:每份材料随机选取30粒种子,用游标卡尺分别测其长度、宽度。
千粒重:每份材料随机数取2个500粒,称重,二者误差小于0.5 g时,其相加之和即为千粒重。
1.2.2 整穗发芽率(GP)的测定
参照Yang等[11]的方法,按照发芽率分别为0%~30%、31%~60%、61%~100%,将小麦穗发芽抗性分为抗穗发芽型、中间型、感穗发芽型3个等级。此外,发芽率低于10%者,定性为高抗穗发芽型。
于小麦蜡熟后期(麦穗、叶片及茎秆全部变黄)每小区选取成熟一致的主茎穗10个,室内风干2 d后置于-20 ℃冰箱内存放,以维持种子休眠性。待所有材料采集完毕进行整穗发芽试验。取每小区主茎穗2个,编号挂牌后分别置于不同的纸杯中,室温下加水至整穗完全浸没,10 h后将水倒出,此后每4 h喷水一次,以确保整穗完全湿润。7 d后统计穗发芽率,以胚部出现破裂迹象者为发芽,反之则为不发芽。
整穗发芽率=6个穗子的发芽籽粒数/6穗总籽粒数×100%
1.2.3 基因组DNA的提取及引物合成
用CTAB法[13-14]提取小麦基因组DNA。标记Vp1B3 和WMC104的引物分别参考文献10和11(表1),由生工生物工程(上海)有限公司合成。
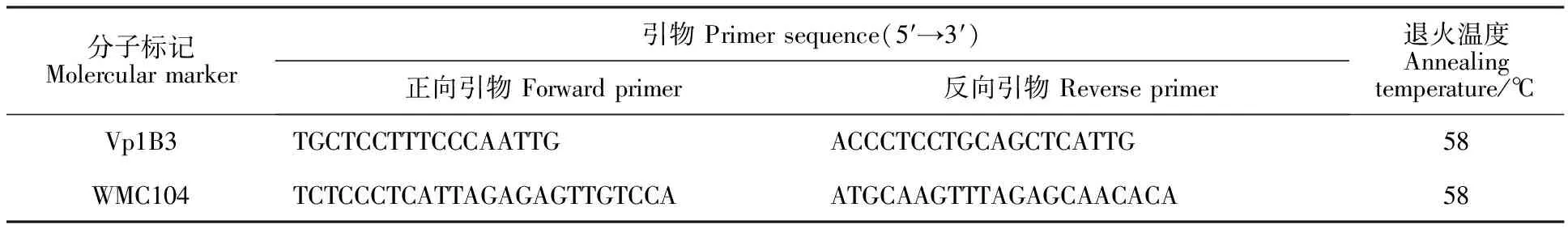
表1 与穗发芽抗性相关的标记
1.2.4 PCR检测
PCR反应体系为15 μL,包括2×Mix混合液7.0 μL,模板DNA 2.0 μL(200 ng·μL-1),上下游引物各1.0 μL(2 μmol·μL-1),ddH2O 4.0 μL。反应程序为95 ℃预变性5 min,95 ℃变性 1 min,退火1 min,72 ℃延伸 1 min,36个循环;72 ℃延伸10 min。PCR产物用6%聚丙烯酰胺凝胶电泳进行检测。
1.3 数据分析
用Excel进行数据统计,采用SPSS 2.0对数据进行方差及相关性分析。
2 结果与分析
2.1 供试小麦品种的整穗发芽率
由表2可知,4个麦区供试材料的整穗发芽率分别为6%~93%、0%~90%、1%~80%、0%~85%,除长江中下游麦区变异系数较高外,其余三个麦区变异系数均小于或等于0.60。长江中下游麦区整穗发芽率为28%,极显著低于其他麦区;黄淮冬麦区南片、北部冬麦区、黄淮冬麦区北片供试材料的整穗发芽率间无显著差异,分别为52%、49%、49%。

表2 4个麦区小麦品种整穗发芽率
Ⅰ:黄淮冬麦区南片; Ⅱ:北部冬麦区; Ⅲ:黄淮冬麦区北片; Ⅳ:长江中下游麦区。图1同。同列数据后不同大小写字母表示差异在0.01、0.05水平上显著。
Ⅰ:Southern of Yellow and Huai River Valley winter wheat region; Ⅱ: Northern winter wheat region; Ⅲ:Northern of Yellow and Huai River Valley winter wheat region; Ⅳ: Middle and Lower Yangtze Valley winter wheat region. The same as in figure 1.Values followed by different capital and small letters mean significantly different at 0.01 and 0.05 levels,respectively.
由图1可知,黄淮冬麦区南片和北片材料的穗发芽抗性分布趋势相似,均有20%左右的材料属于抗穗发芽型,感穗发芽型材料占40%左右。北部冬麦区中30%材料属于抗穗发芽型,感穗发芽型材料约占50%。长江中下游麦区中抗穗发芽材料超过60%,中间型和感穗发芽型材料均不足20%。
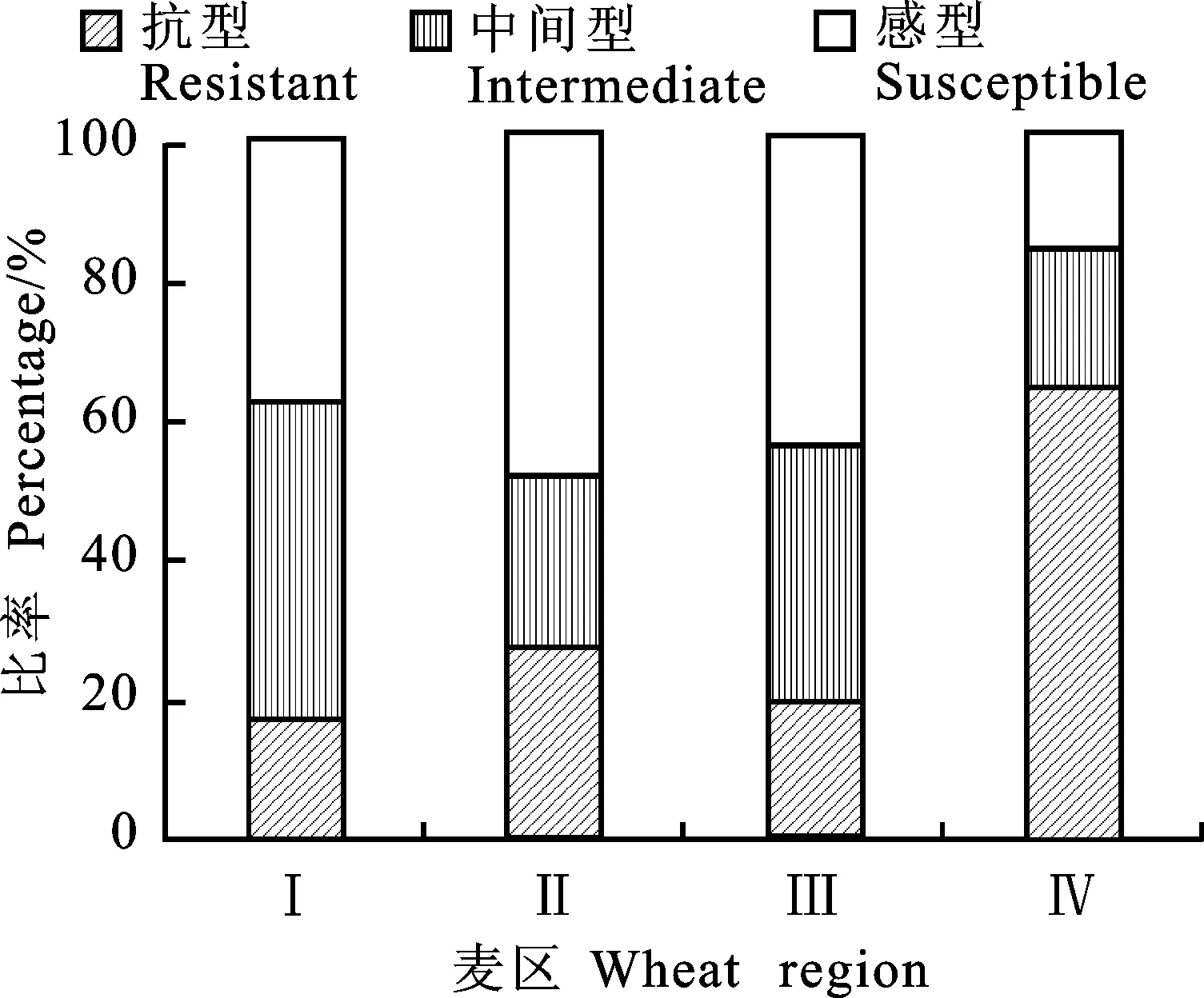
图1 4个麦区供试材料的穗发芽抗性分布
2.2 供试材料的穗发芽抗性标记鉴定结果
2.2.1 Vp1B3鉴定结果
在235份材料中共扩增出652 bp、845 bp、569 bp 3种Vp1B3类型,分别命名为Vp1Ba、Vp1Bb、Vp1Bc,图2为部分结果。其中Vp1Bb和Vp1Bc基因型为抗穗发芽类型,Vp1Ba基因型为感穗发芽类型。235份材料中,扩增出569 bp片段的有135个,占供试品种数的57.45%,平均发芽率为43.88%;扩增出652 bp片段的有97个,占品种总数的41.28%,平均发芽率为51.06%;仅3个品种扩增出845 bp片段,占品种数的1.28%,平均发芽率为42.19%。方差分析表明,扩增出569 bp片段的品种发芽率显著低于652 bp片段对应品种(P<0.05)。扩增出845 bp片段的品种发芽率虽低但数量较少,有待进一步检验。
2.2.2 WMC104鉴定结果
STMS标记WMC104在235份供试材料中共扩增出4种片段类型,如图3所示,分别记为A、B、C、D。其中扩增出A类片段的材料共26个,扩增出B类片段的品种有81个,扩增出C类片段的材料有100个,扩增出D类片段的材料有28个,分别占供试材料的11.07%、34.47%、42.57%、11.91%,对应发芽率依次为53.39%、40.59%、52.01%、40.30%。方差分析表明,扩增出B类片段的品种发芽率显著(P<0.05)或极显著(P<0.01)低于扩增出A类或C类片段的品种;扩增出D类片段的品种发芽率显著低于扩增出A类或C类片段的小麦品种。
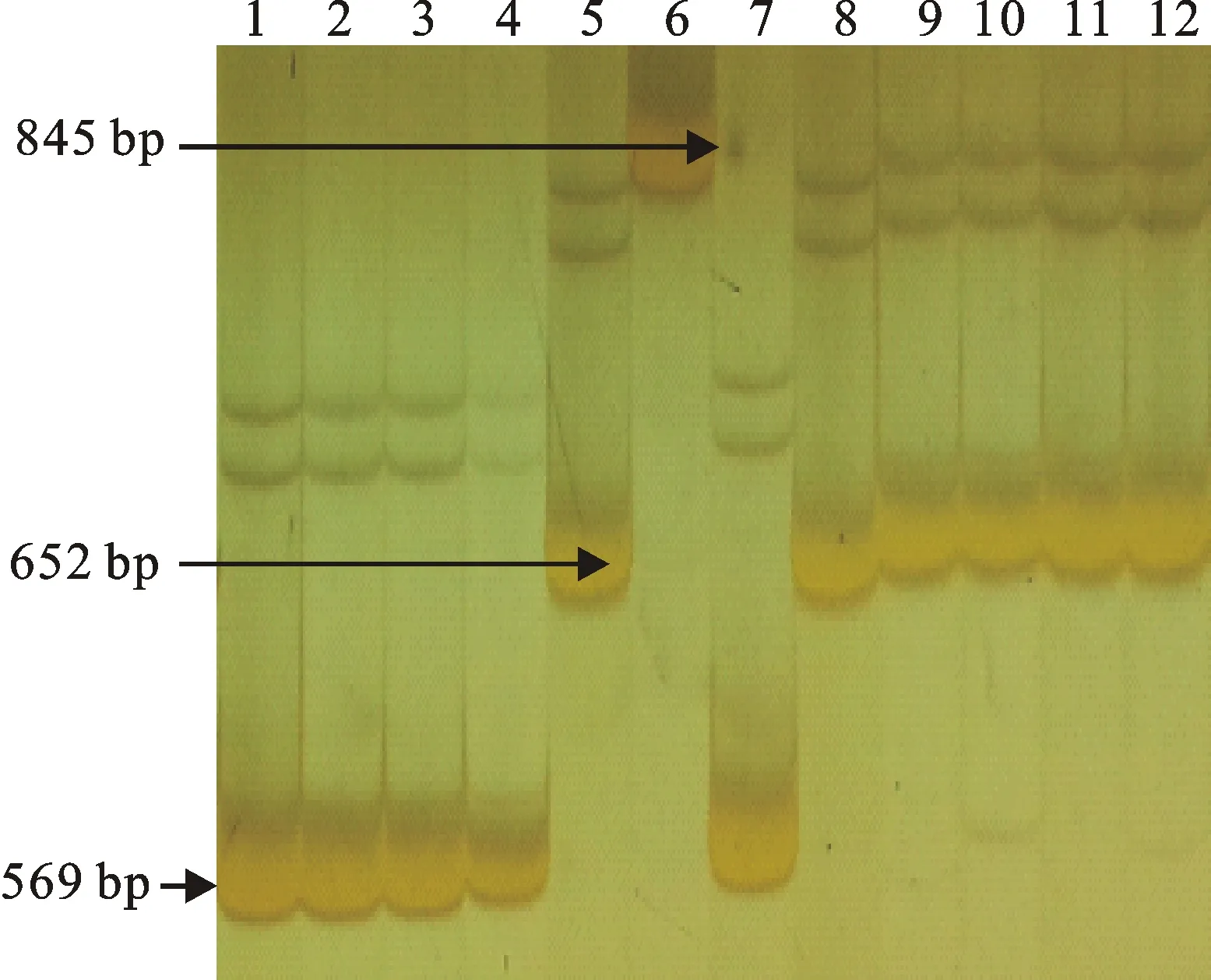
1:洛麦21 Luomai 21;2:淮麦21 Huimai 21;3:豫麦35 Yumai 35;4:淄麦12 Zimai 12;5:邯6172 Han 6172;6:中国春Chinese spring;7:襄麦81 Xiangmai 81;8:川麦49 Chuanmai 49;9:农大211 Nongda 211;10:CA 0998;11:新麦37 Xinmai 37;12:北京841 Beijing 841
图2 标记Vp1B3扩增的片段类型
Fig.2 PCR fragments amplified with the marker Vp1B3

1:豫麦13 Yumai 13;2:安1331 An 1331;3:烟农18 Yannong 18;4:西农2000-7 Xinong 2000-7;5:陕354 Shaan 354;6:中麦895 Zhongmai 895;7:周麦19 Zhoumai 19;8:冀师03-1 Jishi 03-1;9:阜936 Fu 936;10:烟农15 Yannong 15
图3 标记WMC104扩增的片段类型
Fig.3 PCR fragments amplified with the marker WMC104
2.3 整穗发芽试验和分子标记鉴定综合分析
供试材料中发芽率不超过10%的高抗穗发芽品种有28个,占总数的11.91%。标记基因型方差分析表明,Vp1B3和WMC104均与穗发芽抗性相关。28个高抗穗发芽品种中,用标记Vp1B3扩增出569 bp片段的品种有21个,扩增出652 bp片段的品种有6个,仅1个品种扩增出845 bp片段,分别占75.00%、21.43%、3.57%;标记WMC104分别扩增出A、B、C、D片段的品种数为1、13、9、5个,分别占3.57%、46.43%、32.14%、17.86%。用两种标记同时可检测到抗性条带(Vp1B3扩增569 bp片段,WMC104扩增B或D带型)的品种有15个,分别是扬麦10号、荆麦103、川农16、繁6、镇麦6号、秦农731、扬麦9号、碧玛1号、川育23、川麦43、丰产3号、镇麦168、襄麦55、川麦42和扬麦158,其发芽率均值为4.85%,可作为穗发芽抗性育种中的首选抗性资源。
2.4 整穗发芽率与小麦穗部及籽粒性状的相关性
相关性分析结果(表3)表明,整穗发芽率与穗部或籽粒不同性状的相关程度差异较大,其中与籽粒颜色呈极显著正相关,与小穗密度、千粒重、籽粒宽度呈显著正相关,与穗型、穗色、穗粒数、籽粒长度无显著相关性。在育种过程中可将籽粒颜色、小穗密度、千粒重及籽粒宽度等作为抗穗发芽小麦品种的重要参考指标。

表3 整穗发芽率与穗部性状的相关性分析
*:P<0.05; **:P<0.01;GP:Germination percentage.
3 讨 论
对4个麦区小麦品种整穗发芽率进行比较发现,长江中下游麦区供试材料中抗穗发芽型材料占60%以上,显著高于其余3个麦区。原因可能是长江流域在小麦成熟期阴雨天气频繁,穗发芽发生频率较高,部分品种在长期的适应过程中已经具有了一定的穗发芽抗性[15],加之育种过程中较为注重抗穗发芽性状的积累和筛选,因而长江中下游麦区小麦品种表现出良好的穗发芽抗性。在235份供试材料中,扬麦10号、荆麦103、川农16等15个品种表现出良好的穗发芽抗性,发芽率平均约4.85%,是穗发芽抗性育种中的重要资源。
本研究利用穗发芽抗性相关标记Vp1B3和WMC104对供试材料进行了穗发芽抗性鉴定,结果表明,Vp1B3扩增出的3种片段类型中,扩增出Vp1Bb片段的小麦品种整穗发芽率显著较低;WMC104共扩增出4种片段类型,其中扩增出B类或D类片段类型的小麦品种整穗发芽率极显著或显著低于其他2种类型。因此,Vp1B3和WMC104均可应用于小麦穗发芽抗性鉴定,这与已有研究结果[12]相同。
小麦的穗发芽抗性是受多基因控制的复杂性状,影响因素较多。目前研究一致认为,种子休眠特性与穗发芽抗性密切相关,除此之外种皮颜色、穗子大小、小穗密度、蜡质状态、籽粒大小及α-淀粉酶活性等诸多因素也会对穗发芽抗性产生影响[16]。本研究通过对整穗发芽率与小麦穗部及籽粒性状进行相关性分析发现,发芽率与籽粒颜色呈极显著正相关,与前人研究发现的红粒小麦一般比白粒小麦具有更强的穗发芽抗性研究结果一致[17-18]。目前籽粒颜色与小麦穗发芽抗性关系的分子机制虽不十分明朗,但已有研究表明,控制种皮颜色的基因具有多效性,红粒小麦种子的休眠性更高,因而可以有效抑制穗发芽的发生[19-21]。同时,穗发芽率与小穗密度呈显著正相关,即小穗密度越大,穗发芽率越高,对应穗发芽抗性越低。这可能是由于水分易于在高密度小穗的穗部积累,进而影响穗部吸水所致。肖世和等[2]认为,通过小穗之间对水的保持力,密穗小麦的穗型比普通穗子较疏松的小麦更有助于持水。
相关性分析结果显示,整穗发芽率与籽粒宽度、千粒重均呈显著正相关,即籽粒宽度越大,发芽率越高;千粒重越大,发芽率也越高。同时,籽粒宽度与千粒重呈极显著正相关,这与常 成等[22]的研究结果一致。由此推测,籽粒宽度和千粒重对发芽率的影响,可能与籽粒内部有机物含量有关。籽粒萌发需要消耗大量营养物质。籽粒宽度较大者,千粒重较高,其内部有机物含量丰富,可以为萌发提供充足的能量,因此发芽率较高,穗发芽抗性较差。
另外,已有研究表明,穗子的大小、蜡质状态(即穗色)对小麦穗发芽也有不同程度的影响[2]。King等[23]指出小穗外稃上蜡质的存在可有效减少水分的吸收,进而降低穗发芽的发生。在本研究中,整穗发芽率与穗长、穗色等的相关程度均不显著,这可能与所用材料有关,更明确信息还需更多材料的研究。
[1]HUMPHREYS D G,NOLL J.Methods for characterization of pre-harvest sprouting resistance in a wheat breeding program [J].Euphytica,2002,126:61.
[2]肖世和,闫长生,张海萍,等.小麦穗发芽研究[M].北京:中国农业科学技术出版社,2004:2-41,196.
XIAO S H,YAN C S,ZHANG H P,etal.Studies on Pre-harvest Sprouting of Wheat [M].Beijing:China Agriculture Science and Technology Press,2004:2-41,196.
[3]GROOS C,GAY G,PERRETANT R M,etal.Study of the relationship between pre-harvest sprouting and grain color by quantitative trait loci analysis in a white red grain bread-wheat cross [J].TheoreticalandAppliedGenetics,2002,104:39.
[4]刘 莉,王庆海,陈国志,等.小麦穗发芽研究进展[J].作物杂志,2013(4):6.
LIU L,WANG Q H,CHEN G Z,etal.Advances on resistance to pre-harvest sprouting in wheat [J].Crops,2013(4):6.[5]杨 燕,张春利,陈新民,等.穗发芽率和发芽指数及STS标记Vp1B3在小麦抗穗发芽基因型鉴定中的应用[J].麦类作物学报,2007,27(4):577.
YANG Y,ZHANG C L,CHEN X M,etal.Identification of wheat genotypes with pre-harvest sprouting tolerance by combinated analysis of spike germination rate,germination Index and molecular marker Vp1B3 [J].JournalofTriticeaeCrops,2007,27(4):577.
[6]CHEN C X,CAI S B,BAI G H,etal.A major QTL controlling seed dormancy and pre-harvest sprouting resistance on chromosome 4A in a Chinese wheat landrace [J].MolecularBreeding,2008,21(3):351.
[7]MOHAN A,KULWAL P,SINGH R,etal.Genome-wide QTL analysis for pre-harvest sprouting tolerance in bread wheat [J].Euphytica,2009,168:319.
[8]LIN M,CAI S B ,WANG S,etal.Genotyping-by-sequencing (GBS) identiied SNP tightly linked to QTL for pre-harvest sprouting resistance [J].TheoreticalandAppliedGenetics,2015,128:1385.
[9]KATO K,NAKAMURA W,TABIKI T,etal.Detection of loci controlling seed dormancy on group 4 chromosomes of wheat and comparative mapping with rice and barley genomes [J].TheoreticalandAppliedGenetics,2001,102:980.
[10]ROY J K,PRASAD M,VARSHNEY R K,etal.Identification of a microsatellite on chromosomes 6B and a STS on 7D of bread wheat showing an association withpreharvest sprouting tolerance [J].TheoreticalandAppliedGenetics,1999,99:336.
[11]YANG Y,ZHAO X L,XIAO L Q,etal.Development and validation of a Viviparous-1 STS maker for pre-harvest sprouting resistance in Chinese wheats [J].TheoreticalandAppliedGenetics,2007,115:971.
[12]张兆萍,周丽敏,宋小朋,等.小麦穗发芽抗性鉴定及相关分子标记的有效性验证[J].麦类作物学报,2015,35(3):300.
ZHANG Z P,ZHOU L M,SONG X P,etal.Identification of PHS tolerance in wheat varieties and validation [J].JournalofTriticeaeCrops,2015,35(3):300.
[13]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2005:533.
WaNG G L,FANG H J.Plant Genetic Engineering [M].Beijing:Science Press,2005:533.
[14]WANG M L,BARKLEY N A,YU J K,etal.Transfer of simple sequence repeat(SSR) marker from major cereal crops tominor grass species for germplasm characterization and evaluation [J].PlantGeneticReaources,2005,3(1):45.
[15]闫长生,张海萍,海 林,等.中国小麦品种穗发芽抗性差异的研究[J].作物学报,2006,32(4):580.
YAN C S,ZHANG H P,HAI L,etal.Differences of pre-harvest sprouting resistance among Chinese wheat cultivars [J].ActaAgronomicaSinica,2006,32(4):580.
[16]GROOS C,GAY.G,PERRETANT M R,etal.Study on the mechanism of the resistance to preharvest sprouting and inheritance in wheat [J].TheoreticalandAppliedGenetics,2002,104:39.
[17]杨 燕,张春利,陈新民,等.红粒春小麦穗发芽抗性鉴定及相关分子标记的有效性验证[J].麦类作物学报,2011,31(1):54.
YANG Y,ZHANG C L,CHEN X M,etal.Identification and validatation of molecular maker for PHS tolerance in red-grained spring wheat [J].JournalofTriticeaeCrops,2011,31(1):54.
[18]WARNER R L,KUDRNA D A,SPAETH S C,etal.Dormancy in white-grain mutants of Chinese spring wheat (TriticumaestivumL.) [J].SeedScienceResearch,2000,10(1):51.
[19]FLINTHAM J E.Different genetic components control coat-imposed and embryo-imposed dormancy in wheat [J].SeedScienceResearch,2000,10(1):43.
[20]HIMI E,MARES D J,YANAGISAWA A,etal.Effect of grain colour gene(R) on grain dormancy and sensitivity of the embryo to abscisic acid(ABA) in wheat [J].JournalofExperimentalBotany,2002,53(374):1569.
[21]HIMI E,NODA K.Red grain color gene(R) of wheat is a Myb-type transcription factor [J].Euphytica,2005,143:239.
[22]常 成,张海萍,张秀英,等.小麦PEBP-like基因等位变异与籽粒大小、粒重关系研究[J].分子植物育种,2009,7(1):23.
CHANG C,ZHANG H P,ZHANG X Y,etal.Study on relationship between allelic variation in PEBP-like gene and grain size and weight in common wheat [J].MolecularPlantBreeding,2009,7(1):23.
[23]KING R W,VON P.WETTSTEIN K.Epicuticular waxes and regulation of ear wetting and pre-harvest sprouting in barley and wheat [J].Euphytica,2000,112:157.
Pre-harvest Sprouting Resistance in Wheat from Different Wheat Regions and Its Correlation with Ear Characteristics
MA Wenjie,ZHANG Chuanliang,SONG Xiaopeng,FENG Jie,CUI Zixia,SUN Daojie
(College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China)
To identify the pre-harvest sprouting(PHS) resistance and its correlation with ear characteristics,the germination percentage(GP) was measured in the 235 wheat varieties from Yellow and Huai River Valley winter wheat region(includes the South and the North),Northern winter wheat region and Middle and Lower Yangtze Valley winter wheat region,and two molecular markers(Vp1B3 and WMC104) were selected for molecular screening.The results indicated that the wheat varieties from Yangtze River winter wheat region have significantly higher resistance to PHS than the other varieties,and more than 60% of them belonged to the resistance level,whereas,contrasting to the other varieties with 30%. Among 235 wheat varieties,Yangmai 10,Jingmai 103,Chuannong 16 and other twelve cultivars with the GP value 4.85% had higher resistance to PHS,which were important resources of PHS resistance in wheat breeding. Correlation analysis showed that GP was significantly positive associated with seed color,spikelet density,1 000-grain weight and seed width. So the seed color,spikelet density,1 000-grain weight and seed width can be used in wheat PHS resistance breeding as reference.
Wheat; Pre-harvest sprouting; Resistance identification; Correlation analysis
时间:2016-10-08
2016-04-08
2016-04-25
国家重点基础研究计划(973计划)项目(2014CB138100); 陕西省自然科学基金项目(2015JM3094); 陕西省重点科技创新团队项目(2014KCT-25)
E-mail:wenjie080600@163.com
孙道杰(E-mail:chinawheat@hotmail.com)
S512.1;S332.2
A
1009-1041(2016)10-1269-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160928.0918.002.html
