山西野生连翘及其土壤中微量元素及重金属的含量测定
2016-11-29刘晓青田海娇
张 敏,郭 捷,刘晓青,田海娇
(山西省分析科学研究院,山西太原030006)
山西野生连翘及其土壤中微量元素及重金属的含量测定
张敏,郭捷,刘晓青,田海娇
(山西省分析科学研究院,山西太原030006)
目的:测定山西14个县野生连翘及其土壤中微量元素与重金属的含量并对其安全性进行评价,为综合开发利用连翘资源提供实验依据。方法:采用原子吸收光谱法、原子荧光光谱法、电感耦合等离子发射光谱法及电感耦合等离子体质光谱法测定连翘及其土壤中微量元素与重金属元素Hg、As、Pb、Cd、Cr、Cu、Zn、Ni、Mg、Fe、Mn、Se、Ge的含量。结果:山西野生连翘是安全的,含有多种对人体有益和必需的微量元素,其中铁含量较高;连翘生长的土壤环境状况良好,连翘果实重金属含量均低于药用植物及制剂进出口绿色行业标准。结论:连翘土壤和果实之间重金属和微量元素的相关性不明显,有待加大采样量继续深入研究。
连翘;土壤;微量元素;重金属
连翘是山西省道地药材,具有清热解毒、散结消肿之功效,有“疮家圣药”之称的美誉[1]。连翘以野生为主,其中山西省连翘野生资源最为丰富,分布于太行山连翘带、中条山连翘带和太岳山连翘带,产量以安泽、陵川、沁水等最多。中药的有效成分主要是有机化合物,如生物碱、皂苷、黄酮、有机酸等,此外,还含有许多无机成分,包括许多微量元素和宏量元素[2-3]。微量元素进入人体后,有可能促进某些有效成分作用的发挥,并且有些微量元素本身就有疗效[4-6]。连翘中的铁元素是决定其功效的一个重要有效成分,在生命体内二价铁可以清除有害致癌物质(如氧自由基),减少脂质过氧化,因而,可以推测连翘有防止癌变发生和发展的潜在功效。然而也有一部分微量元素对生物体有双重效应或只具有毒性效应。另外,土壤的重金属含量及其分布规律也会影响药材的安全性。药材质量直接关系人体健康和安全,影响中药材出口,为了中药的现代化,并使中药走向国际市场,必须强化对中药微量元素的测定和分析。
目前,用于中药微量元素及重金属含量测定的分析方法主要有原子吸收光谱法(AAS)、原子荧光光谱法(AFS)、电感耦合等离子体原子发射光谱法(ICP-AES)、电感耦合等离子体质谱法(ICP-MS)等[7-8]。近年来对连翘及其产地土壤中微量重金属的分析研究比较薄弱,许多药材质量与产地土壤的相关性尚未揭示清楚。本文利用上述检测技术对山西主要连翘产区连翘果实及土壤中微量重金属元素的含量进行测定,为连翘相关研究提供参考数据。
1 材料与方法
1.1实验材料
1.1.1仪器与试剂原子吸收光谱仪(Perkin Elmer,AAnalyst 800),电感耦合等离子发射光谱仪(Perkin Elmer,OPTIMA 2100DV),电感耦合等离子体质谱仪(Perkin Elmer,NexION 300X),原子荧光光度计(海光,AFS-9760),全自动测汞仪(Milestone,DMA-80),电热消解仪(Lab Tech,Digi Block ED54),微波消解仪(CEM,MARS 5)。汞(Hg)、砷(As)、铅(Pb)、铬(Cr)、镉(Cd)、铜(Cu)、锌(Zn)、镍(Ni)、镁(Mg)、铁(Fe)、锰(Mn)、硒(Se)、锗(Ge)元素标准液均购自国家有色金属及电子材料分析测试中心,质量浓度为1 000 μg/mL,按所需浓度稀释备用;硝酸、盐酸、高氯酸、氢氟酸均为优级纯,实验室用水均为超纯水。所用玻璃仪器均用5%硝酸浸泡24 h,用去离子水冲净滴干,备用。
1.1.2实验药材从山西主要连翘产区选取14个县区采集,详细信息见表1。

表1 不同县区采集的连翘样品编号
1.2实验方法
1.2.1土壤样品前处理准确称取待测样品0.25 g于一次性塑料消解管中,加1 mL HCl,1 mL HNO3,1 mL HF,125℃电热消解1 h,赶酸1 h左右至体积小于1 mL,用超纯水定容至50 mL待上机检测Pb、Cd、Cr、Cu、Zn、Ni。取待测样品0.40 g于25 mL比色管中,加HCl:HNO3(9∶1)10 mL沸水浴2 min,冷却30 min,加硫脲5 mL(100 g/L),定容至50 mL后静置,待上机检测Hg和As。
1.2.2连翘果实样品前处理准确称取样品0.5 g于玻璃消解管中,分别加入5 mL浓硝酸和2 mL高氯酸,盖上盖子后,置于电热消解仪上,浸泡过夜后消解,消解程序如表2。程序结束后,揭掉盖子,拿蒸馏水冲洗盖子,赶酸至近干,定容至25 mL,同时做空白,用于上机检测表3和表4中Hg以外的其他元素。Hg的测定用全自动测汞仪。
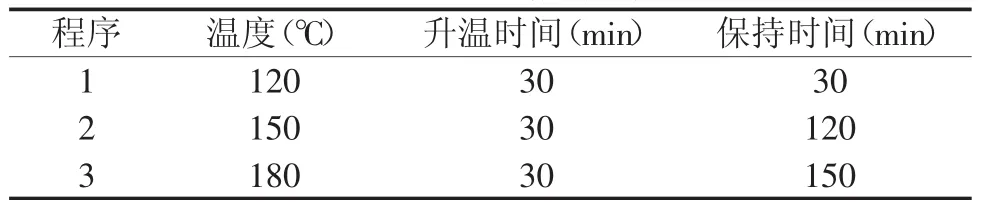
表2 电热消解程序
1.2.3仪器工作条件AFS-9760双道原子荧光光谱仪工作条件设定:光电倍增管负高压为250 V,总灯电流Hg 20 mA和As 40 mA均为原子化器高度10 mm,载气流量400 L/min,屏蔽气流量900 mL/min。
原子吸收光谱仪工作条件设定:原子化器为石墨炉,狭缝宽0.7 L/nm,基体改进剂为NH4H2PO4,Pb测量波长为283.3 nm,灯电流8 mA,Cd测量波长为283.3 nm,灯电流为4 mA。
电感耦合等离子发射光谱仪工作条件设定:等离子气流量15 L/min,泵流量1.5 mL/min,射频功率1 300 W,观测方式为轴向,检测波长Cr 267.7 nm、Cu 327.4 nm、Zn 206.2 nm、Ni 231.6 nm、Mg 267.7 nm、Fe 238.2 nm、Mn 257.6 nm。
电感耦合等离子体质谱仪工作条件设定:射频功率1 100 KW,等离子体气流速度15.00 L/min,辅助气流速度1.40 L/min,雾化气流速1.00 L/min,分辨率(10%峰高)为0.6~0.7 amu,进样量1.00 mL/min,扫描线数150,扫描次数30,每峰点数1,一次读数的重复扫描数3,驻留时间50 ms,分析时间5 min。
2 结果
2.1标准曲线线性关系、方法检出限、准确度和精密度
将各元素的标准储备液稀释后配成相应浓度的标准系列,按测定条件进行测试,得标准线性方程,各元素线性关系均良好,相关系数0.999 0~0.999 9。平行重复测定11次空白溶液,计算其标准偏差值得到方法检出限范围为0.000 2 μg/mL~0.020 0 μg/mL。为了验证样品测定的准确度和精密度,按照实验条件,选取编号3-1药材进行加标回收实验,平行6组。结果见表3。结果表明,各元素平均回收率88.33%~110.87%,方法精密度(相对标准偏差RSD)为1.33%~7.69%,能满足实验需要。
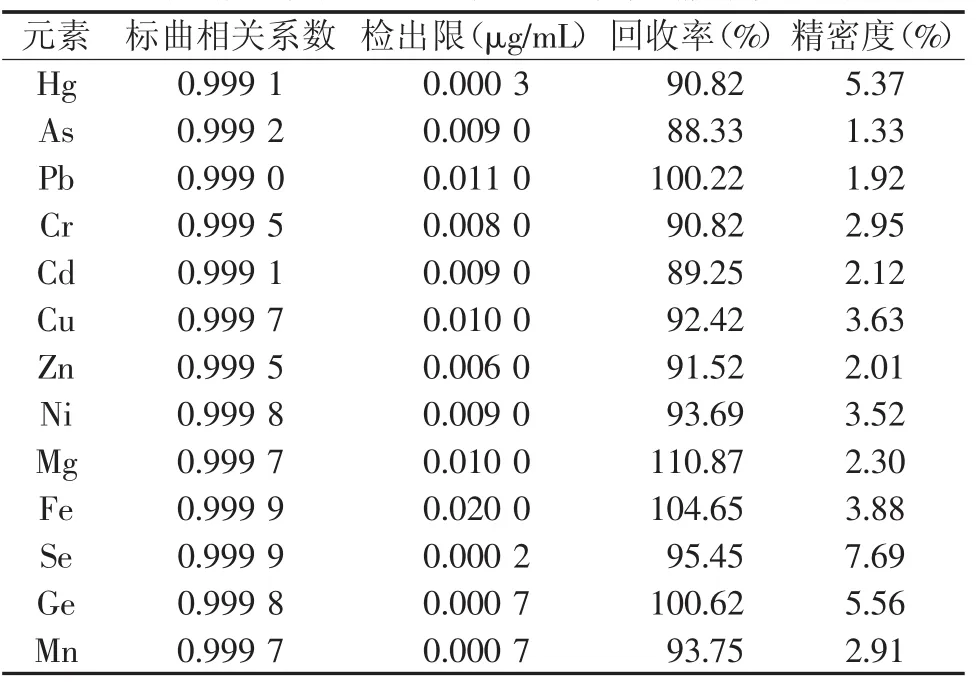
表3 各元素工作曲线相关系数、方法检出限、回收率和精密度实验结果(n=6)
2.2样品结果
对以上处理好的样品进行微量元素[9]含量测定,每份样品平行测定3次,求平均值,计算含量,结果见表4。
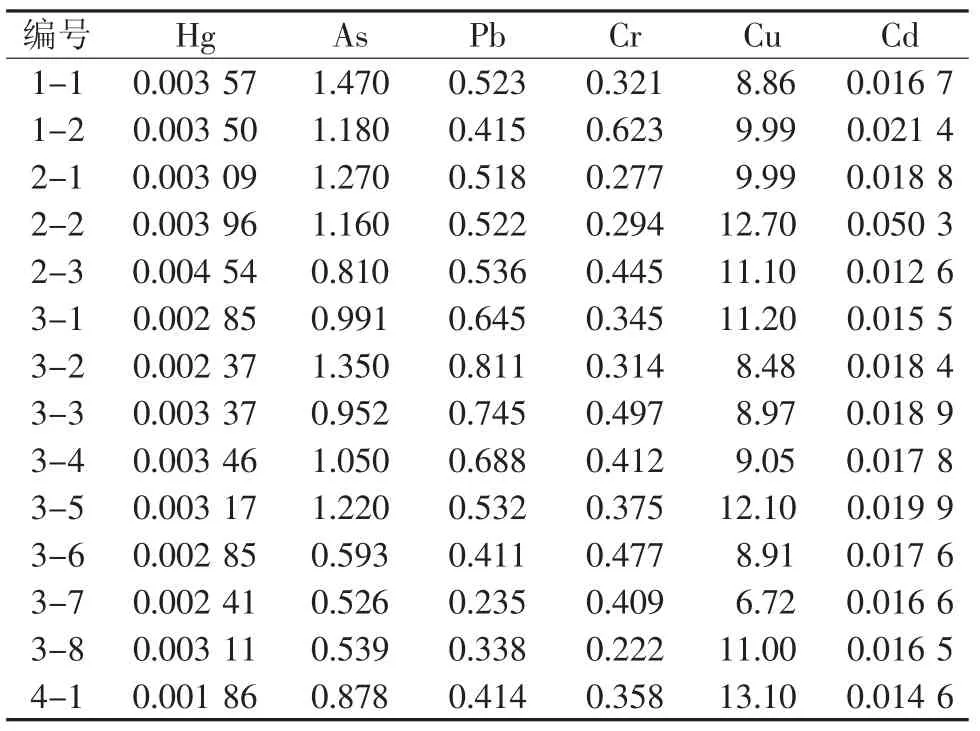
表4 连翘果实中重金属含量统计 (μg/g)
3 讨论
我国土壤环境质量标准(GB15618-1995)中对8种重金属元素限量做了规定,其中包括Pb、Cd、As、Hg、Cu等5种2010版中国药典规定的对人体有害的重金属元素。根据我国《药用植物及制剂进出口绿色行业标准》的规定,分析本实验对山西主要连翘产区连翘果实中微量元素的测定结果,Hg、As、Cr、Cd等重金属元素含量均达标,符合绿色行业标准;微量元素Fe的含量相对较高。
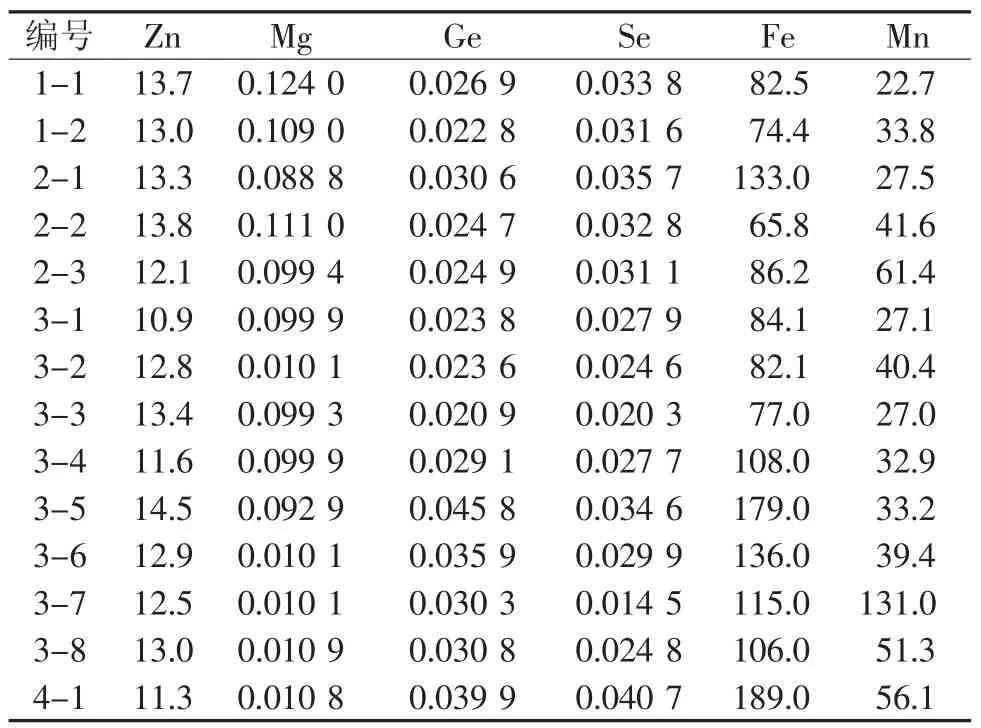
表5 连翘果实中微量元素含量统计 (μg/g)
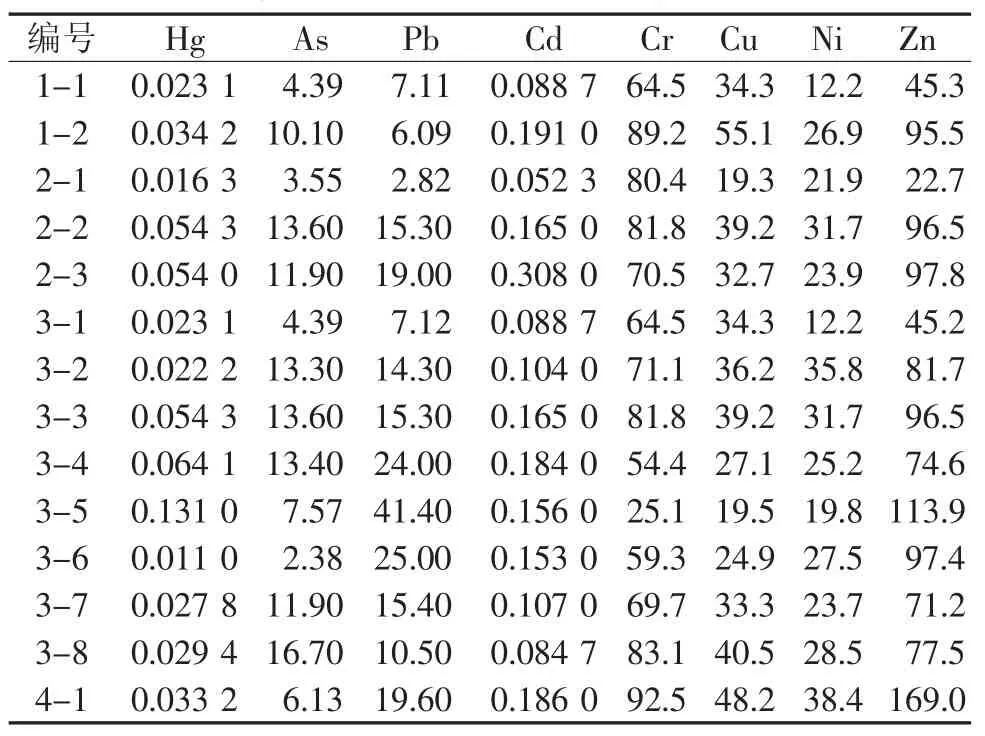
表6 土壤中重金属含量统计 (μg/g)
将本研究中山西主要连翘生产县14批次土壤样品[10-11]检测结果与上述标准进行比较,可知此次土壤样品含量全部符合GB15618-1995相关规定。我国《中药材生产质量管理规范》(GAP)中规定,中药产地的土壤应符合《土壤环境质量标准》中级标准。可知本研究中山西连翘主要生产县的14批次土壤样本符合GAP规定,这些产地在连翘GAP[12-13]种植基地建设方面具有广阔的发展前景。
经软件SPSS16.0分析,连翘土壤和果实之间重金属和微量元素的相关性[14-15]并不明显,有待进一步深入研究。在连翘规范化种植过程中,应对种植地进行环境评价,重视种植基地筛选,避免选择土壤、水质、空气等较差的环境作为种植基地,严禁施用垃圾肥,合理使用农药化肥,避免中药材在采收加工运输过程中的再次被污染,并加强对药材生产过程中各个环节重金属的监控。
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:159-160.
[2]冯卫生,李珂珂,郑晓珂.连翘化学成分的研究[J].中国药学杂志,2009,44(7):490-492.
[3]王刚,陈荣达,林炳承.中药中微量元素测定的研究进展[J].药物分析杂志,2002,22(2):151-155.
[4]黄荣韶,杨海菊,黄政棠.田七药材重金属及微量元素含量分析[J].广西科学院学报,2014,30(4):281-284.
[5]寇兴明,徐敏,顾永祚.微波消解/ICP-MS法测定川黄柏中微量重金属元素[J].光谱学与光谱分析,2007,27(6):1 197-1 200.
[6]张艾华,赵书婷,徐建平.ICP-AES法测定26种蒙药中微量元素和重金属元素的含量[J].包头医学院学报,2014,30(5):24-28.
[7]迟玉广,李中阳,黄爱华.五种中药中微量元素及重金属元素的含量分析[J].广东微量元素科学,2010,17(8):36-40.
[8]吴拥军,刘洁,吴予明,等.中药巴戟天多糖的测定及其微量元素分析[J].光谱学与光谱分析,2005,25(2):2 076-2 078.
[9]鲍士旦.土壤理化分析[M].北京:中国农业出版社,2000:45-53.
[10]隋方功,李俊良.土壤农化分析实验[M].莱阳:莱阳农学院,2004:27-29.
[11]孙振球,徐勇勇.医学统计学[M].北京:人民卫生出版社,2004:342-348,484.
[12]陈兴福,卢进,刘玲,等.谈中药材生产基地的建设[J].中药材,1998,12(2):99-102.
[13]高文远,肖培根.从中药现代化的高度开展药用植物栽培的研究[J].中药材,1998,12(2):99-102.
[14]张春华,周永治.数理统计方法[M].济南:山东大学出版社,1992:132-149.
[15]王夔.生命科学中的微量元素[M].北京:中国计量出版社,1991:1-3.
(编辑:梁葆朱)
Determination of the trace elements and heavy metal elements in Shanxi wild forsythia and soil
Zhang Min,Guo Jie,Liu Xiaoqing,Tian Haijiao
(Shanxi Academy of Analytical Sciences,Taiyuan Shanxi 030006)
Objective:To detect the contents of trace elements and heavy metal elements in forsythia fruit and forsythia soil and to supply experimental data for the comprehensive development and utilization of forsythia.Method:The contents of trace elements and heavy metal elements in forsythia fruit and forsythia soil were detected by atomic fluorescence spectrophotometry,atomicabsorptionspectrophotometry,inductivecouplingplasmaradiationspectrophotometryandinductively coupled plasma mass spectrometry respectively.Result:Shanxi wild forsythia in different regions are safe.They contain a variety of beneficial and essential trace elements for human body,in which iron content is relatively higher.The contents of heavy metal elements in wild forsythia fruit are lower than those in standards of import and export of green industry of medicinal plants and preparations.Conclusion:The correlation between contents of heavy metal elements and trace elements in forsythia soil and those in forsythia fruit aren′t obvious.Further study should be conducted,such as increasing the number of samples.
forsythia;soil;trace elements;heavy metal elements
R285.5
A
1671-0258(2016)05-0031-04
山西省科技厅资助项目(2014081049-1)
张敏,硕士,工程师,E-mail:minzhang19820914@163.com
