中华卵索线虫寄生对棉铃虫保护酶系的影响
2016-11-29焦振龙冯旭飞陶斯莹王国秀
焦振龙,冯旭飞,陶斯莹,王国秀
(华中师范大学 生命科学学院 遗传调控与整合生物学湖北省重点实验室,武汉 430079)
中华卵索线虫寄生对棉铃虫保护酶系的影响
焦振龙,冯旭飞,陶斯莹,王国秀*
(华中师范大学 生命科学学院 遗传调控与整合生物学湖北省重点实验室,武汉 430079)
为了解中华卵索线虫致死棉铃虫的机理,观测宿主死亡率发现其与中肠细胞凋亡程度相关,并进一步比较致死期宿主和对照组幼虫超氧化物歧化酶(SOD),过氧化物酶(CAT),过氧化氢酶(POD),谷胱甘肽转移酶(GST)活性及其基因表达.结果显示:线虫寄生3 d时,宿主SOD和POD活性及其基因表达高于对照组且致6.75%的宿主死于黑化;93.25%的宿主于寄生7 d后随线虫脱出死亡,其SOD、POD、CAT、GST活性及基因表达均极显著提高,表明线虫致死棉铃虫涉其氧化损伤加速细胞凋亡.此外,宿主丙二醛(MDA)含量未因线虫寄生而提高,提示该过程不产生脂质过氧化反应.本研究不仅有利于该天敌的应用开发,而且可为新型杀虫剂的合成提供参考.
中华卵索线虫; 棉铃虫; 细胞凋亡; 氧化损伤
棉铃虫(Helicoverpaarmigera)危害300多种农、林、蔬菜等经济作物,造成严重经济损失,是一种世界性鳞翅目 (Lepidoptera) 害虫[1].长期使用传统杀虫剂,如有机磷、有机氟、拟除虫菊酯、烟碱类等控制虫害使其抗药性日益增加,因此亟需改进传统杀虫剂[2].目前,国内外越来越趋向应用寄生天敌及其宿主建立研究模型,其不仅为传统杀虫剂的改进奠定理论基础,而且可为新型杀虫剂的合成开发提供新的靶标位点[3].
中华卵索线虫(Ovomermissinensis)是一种专性寄生于棉铃虫、黄地老虎(AgrotissegetumSchiffermuller)、甜菜夜蛾(Spodopteraexigua)、小地老虎(AgrotisypsilonRottemberg)、斜纹夜蛾(Spodopteralitura)等多种鳞翅目害虫的病原线虫[4].其感染期幼虫可主动侵染昆虫宿主,害虫的寄生率等于其死亡率,具有广阔的开发和应用前景.为提高防治害虫效率,前期研究主要集中在田间释放策略、体外培养等方面[4-5].相比之下,其致死宿主的机制尚不明确.
已有研究表明,天敌致死宿主涉其氧化损伤,而害虫抗药性也与氧化防御密切相关[6-7].昆虫可形成活性氧(Reactive Oxygen Species,ROS) 清除外来入侵,与此同时通过超氧化物歧化酶(SOD,EC 1.15.1.1)、过氧化物酶(CAT,EC 1.11.1.6)、过氧化氢酶(POD,EC 1.11.1.9)、谷胱甘肽转移酶(GST,EC 1.6.4.2)等抗氧化酶实现自我保护[8-9].当抗氧化防御失衡后,非特异反应的ROS可与昆虫细胞产生脂质过氧化反应诱导细胞凋亡,其可通过丙二醛(MDA)含量来衡.如大蜡螟Galleriamellonella与小杆属线虫Heterorhabditissp.beicherriana[7]、麻蝇Sarcophaghacrassipalpis与金小蜂Nasoniavitripennis[10]、小菜蛾Plutellaxylostella与菜蛾绒茧蜂Cotesiaplutellae[11]、小菜蛾Plutellaxylostella与半闭弯尾姬蜂Diadegmasemiclausum[12]、烟草天蛾Manducasexta与盘绒茧蜂Cotesiacongregata[13]、黄粉虫TenebrioMolitor与肿腿蜂Sclerodermaguani[14]等寄生体系中均发现宿主致死涉及氧化损伤.但有关中华卵索线虫对棉铃虫抗氧化防御的影响未见报道.
为探明中华卵索线虫致死棉铃虫是否涉及氧化损伤,本研究观测了中华卵索线虫寄生后棉铃虫死亡率和细胞凋亡,以及致死期宿主SOD,POD,CAT,GST活力和基因的相对表达量.进一步,通过宿主MDA含量剖析氧化损伤致死宿主的潜在原因,并探讨天敌与传统杀虫剂致死害虫的区别,以期为新型杀虫剂的开发提供理论依据.
1 材料与方法
1.1 供试虫源
中华卵索线虫采自河南省上蔡县(114°54′ E; 33°38′ N)麦田,棉铃虫购自中科院武汉病毒所.供试动物于恒温培养箱中(温度27 ± 1℃,光照周期14L∶10D,相对湿度70% ± 10%)培养.
1.2 试剂和仪器
主要试剂:总蛋白定量试剂盒(A045-2)、MDA测试盒(A003-1)、GST试剂盒(A004)、POD测试盒(A084-1)、CAT测试盒(A007-2)及SOD测试盒(A001-1)均购自南京建成生物工程研究所;苯基硫脲(Solarbio公司);Trizol、反转录试剂盒、荧光定量试剂盒(天根生化科技有限公司);Trizol®Reagent 试剂盒(Omega公司).
主要仪器:数显恒温水浴锅(金坛市金南仪器);ND-1000、FLX800酶标仪(基因有限公司);PCR仪、荧光定量PCR仪、电泳仪(美国Bio-Rad公司);凝胶成像系统(美国Kodak公司);体视显微镜 (CX41; Olympus,Tokyo,Japan).
1.3 实验分析
1.3.1 宿主死亡率及致死期 感染期幼虫以10∶1(线虫∶宿主)的比例感染四龄棉铃虫幼虫(n=100),并设对照组(n=100).线虫感染宿主4 h后将棉铃虫幼虫单头放入含人工饲料的六孔板,置于27 ± 1 ℃的培养箱中进行培养,每6 h统计宿主的死亡率.
1.3.2 宿主细胞凋亡分析 选取线虫寄生3 d和7 d的棉铃虫,并对其中肠细胞凋亡进行分析.参考Wheeler[15]等的方法甲醛固定液固定,石蜡组织切片并HE染色,于显微镜下观察拍照.
1.3.3 抗氧化酶活性分析 将寄生线虫3 d和7 d的棉铃虫(n=10)于冰上麻醉10 min,然后剪第3对腹足取血淋巴.每头棉铃虫取10 μL血淋巴转移至已添加1 μL预冷苯基硫脲的1.5 mLEP管中,随后4℃、8 000 rpm离心5 min,取上清保存于-80℃冰箱中备用.
其中,总蛋白测定参考Bradford (1976) 考马斯亮蓝染色方法,于595 nm下测定其吸光值,以BSA为标准蛋白制作标准曲线计算蛋白质浓度.
SOD活性测定采用黄嘌呤氧化酶法(羟胺法),按照南京建成生物工程试剂盒说明操作,在550 nm测其吸光值,计算如下.
SOD活性(U·ml-1protein)=
反应体系稀释倍数×样品测试前稀释倍数.
CAT活性测定其在240 nm下由于H2O2的分解引起的吸光度的下降,按照南京建成生物工程试剂盒说明操作,计算如下.
CAT活性测(U·ml-1protein)=
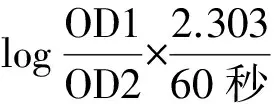
反应体系稀释倍数÷血红蛋白浓度(mg·ml-1).
POD活性是测定在415nm下底物H2O2的催化氧化值,按照南京建成生物工程试剂盒说明操作,计算如下.
POD活性(U·ml-1protein)=
反应时间30分钟÷
待测样本蛋白浓度.
GST活性测定按照南京建成生物工程试剂盒说明,在412 nm处测吸光值,计算如下:
GST活性(U·ml-1protein)=
标准品浓度(0.02 μmol·ml-1)×
样品测试前稀释倍数÷
反应时间30分钟÷取样量.
1.3.4 抗氧化酶基因表达 cDNA合成:收集3 d和7 d线虫寄生(n=10)和未寄生棉铃虫(n=10)液氮速冻后保存于-80℃冰箱中备用.总RNA提取按照Trizol®Reagent试剂盒说明操作进行,ND-1000测定浓度及凝胶电泳判断RNA的质量.然后按照反转录试剂盒说明操作获得cDNA第一链,并用内参引物检测.
qPCR检测:从Genbank获取目的基因全长,用Primer5软件计引物,选取Hrps3为内参,引物序列如表1.随后Real-time PCR检测基因的相对表达量.qPCR反应体系:SsoFastTMEvagreen®超混合液7.5 μL,正反向引物各0.3 μL,cDNA模板3 μL,ddH2O 3.9 μL,总体系15 μL.反应条件:95℃,3 min;95℃,10 s,60℃,30 s,共40个循环;60℃退火30;每循环一次,退火温度上升0.5℃绘制溶解曲线.基因相对表达量采用2-ΔΔCt方法计算[16].

表1 实验中所用的引物
1.3.5 MDA含量测定 棉铃虫血淋巴MDA含量按照南京建成生物工程试剂盒说明操作,计算如下:
MDA含量(mol·ml-1)=
标准品浓度(10 mol·ml-1)×
样品测试前稀释倍数.
1.4 数据分析
数据统计分析采用SPSS 17.0 (SPSS Inc.,Chicago,Illinois,USA),结果表述为平均值±标准差 (mean ± SD).用独立样本t检验(Student’s t-test,P≤ 0.05) 分析寄生和非对照组幼虫各项指标差异性.
2 结果
2.1 宿主死亡率及细胞凋亡
中华卵索线虫寄生致棉铃虫死亡率高达100%(图1A).其中,寄生3 d时,近6.75%的宿主黑化死亡(图1B),而93.25%的宿主随线虫脱出死亡(图1C).同时,宿主死亡率与其细胞凋亡程度同步(图2).线虫寄生3 d时,宿主幼虫中肠出现细胞凋亡以及空泡(图2B);7 d时,随死亡率增加宿主细胞凋亡程度愈加明显,肠壁肿胀且出现较多空泡(图2D).
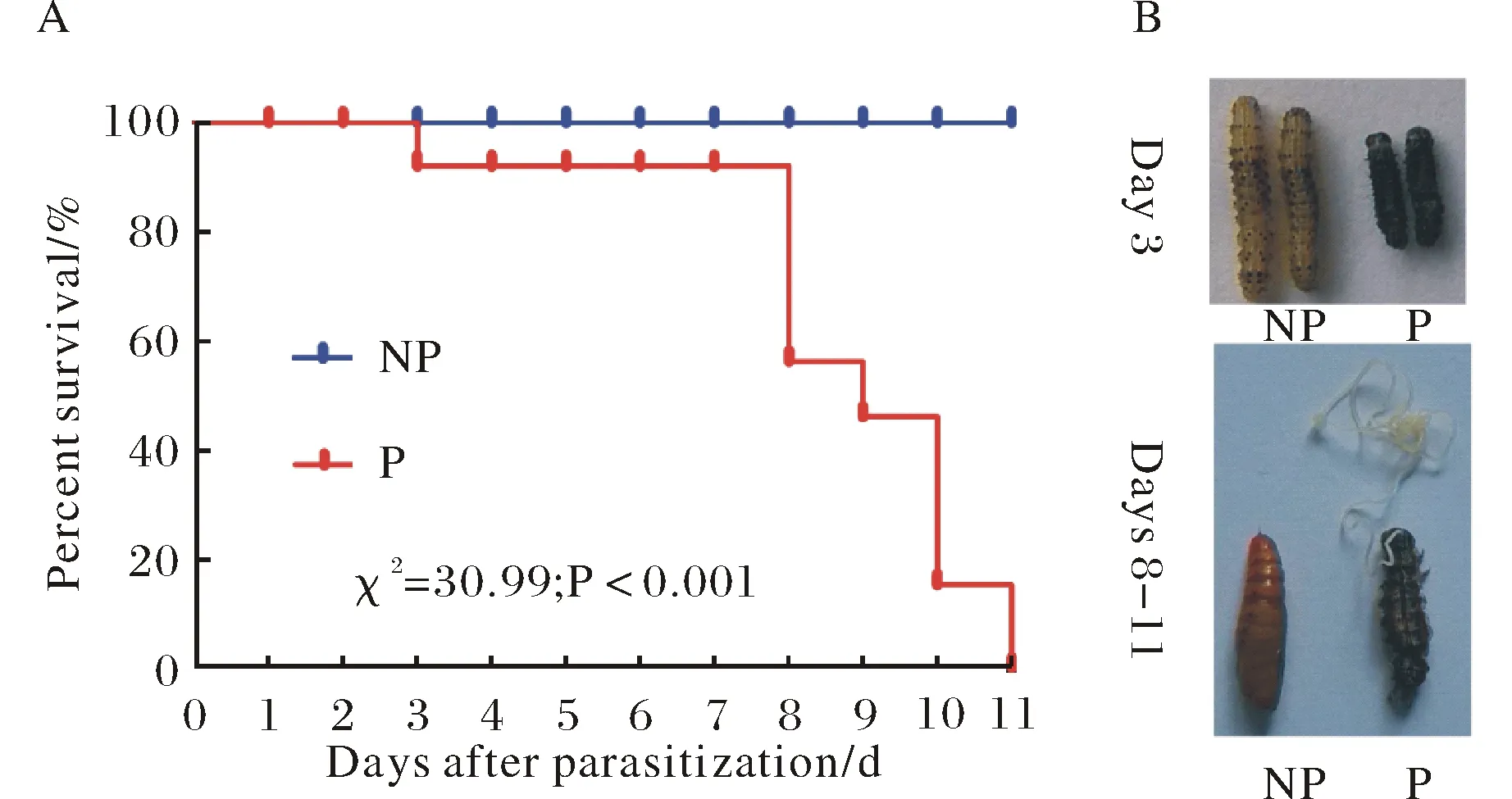
寄生组与对照组间显著性分析采用卡方检验Log-rank (Mantel-Cox) Test,χ2=30.99;P<0.001.数据表述为平均值±标准误,3个生物学重复,每重复100样本.NP代表非寄生组,P代表寄生组.图1 中华卵索线虫寄生后棉铃虫致死率(A)与两种致死表型(B)Fig.1 Mortality rate of H. armigera larvae parasitism by Ovomermis sinensis(A), as well the host’s phenotype (B)

A与B分别是对照组和3 d寄生;C与D分别是对照组和7 d寄生;石蜡组织切片并HE染色,于显微镜 (CX41; Olympus,Tokyo,Japan) 下观察,放大倍数为11.5倍图2 中华卵索线虫的寄生对棉铃虫中肠细胞凋亡的影响Fig.2 Effect of O. sinensis on mid-gut cells in H. armigera
2.2 线虫寄生对宿主SOD活性的影响
线虫寄生提高棉铃虫SOD活性(图3A).线虫寄生3 d和7 d时,宿主SOD活性比对照组分别增加了18.54% (t=-6.395,P=0.003)和32.23% (t=-7.948,P<0.001);与之相应的,宿主HaSOD基因在线虫寄生3 d和7 d时分别上调9.62倍(t=-9.922,P=0.001)和147.35倍 (t=-0.763,P=0.001;图4A).
2.3 线虫寄生对宿主POD活性的影响
线虫寄生增强棉铃虫POD的活性(图3B).线虫寄生3 d和7 d时,宿主POD活性比对照组分别增强了40.89% (t=-5.487,P=0.005)和297.73% (t=-7.948,P<0.001).与此同时,宿主HaPOD基因在线虫寄生3 d、7 d时分别上调了2.03倍(t=-4.618,P=0.010)和2.33倍 (t=-5.838,P=0.004;图4B).

数据表述为平均值±标准误,*表示各时期寄生组和对照组间差异显著(独立样本t检验,*P ≤ 0.05;**P ≤ 0.01).NP代表非寄生组,P代表寄生组.图3 中华卵索线虫寄生对棉铃虫SOD、POD、CAT、GST活性的影响Fig.3 Effect of O. sinensis on SOD,POD, CAT,GST activities of H. armigera larvae
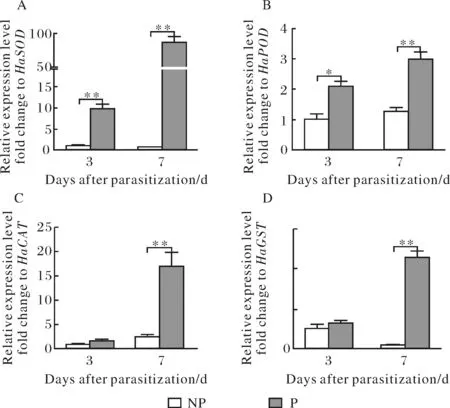
数据表述为平均值±标准误,*表示各时期寄生组和对照组间差异显著(独立样本t检验,*P ≤ 0.05;**P≤ 0.01)NP代表非寄生组,P代表寄生组.图4 中华卵索线虫寄生对棉铃虫HaSOD、HaPOD、HaCAT及HaGST基因表达的影响Fig.4 Effect of O. sinensis on the gene HaSOD(A),HaPOD(B),HaCAT(C),HaGST(D) of H. armigera larvae
2.4 线虫寄生对宿主CAT活性的影响
宿主CAT活性也受线虫寄生的影响(图3C).虽在线虫寄生3 d时,宿主CAT活性和对照组没有显著性差异(t=-1.364,P=0.244),但在寄生7 d时,显著增加75.62% (t=-8.163,P<0.001).相似的,宿主基因HaCAT在寄生3 d时和对照组无显著性差异(t=-1.104,P=0.331);7 d时显著上调6.63倍 (t=-5.201,P=0.007;图4C).
2.5 线虫寄生对宿主GST活性的影响
线虫寄生增强宿主GST活性(图3D).宿主GST活性在寄生3 d时与对照组没有显著性差异(t=-1.339,P=0.252),但寄生7 d时,宿主GST活性增加了35.22% (t=-6.339,P=0.003).相应的,宿主HaGST基因的转录水平也在3 d时和对照组无显著性差异(t=-1.680,P=0.168),而7 d时显著上调31.78倍 (t=-14.062,P<0.001;图4D).
2.6 线虫寄生对宿主MDA活性的影响
有趣的是,宿主MDA含量未因线虫寄生而提高(图5).其中,线虫寄生3 d时,MDA含量和对照组没有显著性差异(t=0.572,P=0.598);7 d时,宿主MDA含量显著下降了2.51倍 (t=9.991,P<0.001).

数据表述为平均值±标准误,*表示各时期寄生组和对照组间差异显著(独立样本t检验,*P ≤ 0.05;**P ≤ 0.01).NP代表非寄生组,P代表寄生组.图5 中华卵索线虫寄生对棉铃虫丙二醛(MDA)含量的影响Fig.5 Effect of O. sinensis on the malondialdehyde content in H. armigera
3 讨论
昆虫细胞产生ROS是其防御外来入侵物和杀虫剂等外来入侵的第一道防线,主要包括过氧化氢(H2O2)、游离羟基(OH-)、超氧阴离子(O2-)等.同时,昆虫通过抗氧化酶实现自我保护,其中SOD可有效的清除体内形成的O2-并将其转化为H2O2.随之,CAT和POD共同协作清除昆虫体内H2O2,而GST间接的防御昆虫过量的ROS,这些酶协同保持昆虫体内ROS处于动态平衡[9].一旦失衡,非特异性反应的ROS能够加速细胞凋亡[8].本研究发现,中华卵索线虫致死棉铃虫与其细胞凋亡相关,而且宿主SOD、POD、CAT、GST活性及其基因表达也随致死率增加而提高,结果支持本文的假说——中华卵索线虫致死棉铃虫涉其氧化损伤.
昆虫抗氧化损伤形成有2种途径.其一,由体液免疫和细胞免疫产生的黑化反应破坏抗氧化平衡形成氧化损伤;其二,因生物和非生物胁迫引起病理形成氧化损伤[8-9,17].如小杆属线虫感染大蜡螟后抑制其免疫应答,且SOD、POD、CAT活性在48 h内显著增强,大蜡螟的致死率高达60%[7];盘绒茧蜂寄生烟草天蛾后抗氧化相关基因如peroxidase-like-4等随着免疫抑制而显著上调[13],表明天敌抑制宿主免疫引起氧化损伤.此外,金小蜂寄生麻蝇、菜蛾绒茧蜂寄生小菜蛾后期宿主GST活性显著提高[10-11];肿腿蜂诱导黄粉虫4个SOD基因于致死前期显著上调[14],表明天敌胁迫宿主也能引发氧化损伤.本研究对棉铃虫致死期的观测包括了以上两种途径氧化损伤:因线虫于寄生3 d抑制并耗竭宿主免疫,随后快速发育在7 d后完成寄生[4-5].另一方面,传统杀虫剂如有机磷、有机氟、拟除虫菊酯、烟碱类等破坏害虫免疫防御并产生非生物胁迫,该过程抑制害虫体内SOD、CAT、POD、GST活性.相比之下,无论病原线虫、寄生蜂,还是索科线虫致死害虫均显著提高宿主SOD、CAT、POD、GST活性.由此推测,害虫抗药性可能与保护酶系抑制存在关系.
抗氧化失衡后,非特异性反应的ROS可攻击细胞内蛋白,核酸,生物膜的多不饱和脂肪酸(Polyunsaturated fatty acid)形成蛋白交联,核酸序列错配,脂质过氧化物反应等破坏细胞器和细胞膜的流动性,加速细胞程序化死亡[8-9],其中MDA含量可反映细胞脂质过氧化反应.本研究发现,宿主中肠细胞凋亡程度与氧化损伤同步,表明氧化损伤加速细胞的程序化死亡,但宿主MDA含量显著下降,说明该过程没有产生脂质过氧化反应.对小杆属线虫与大蜡螟幼虫体系的研究也取得相似的结果[7],提示天敌诱发细胞凋亡可能与蛋白交联,或核酸错配相关.然而,杀虫剂攻击害虫生物膜多不饱和脂肪酸,大幅提升MDA含量[18-20].基于此,进一步研究需从细胞水平深层解析害虫抗药性是否与脂质过氧化反应有关.
综上所述,本研究发现中华卵索线虫提高棉铃虫抗氧化酶活力及上调抗氧化基因表达,形成氧化损伤加速细胞凋亡,此过程不产生脂质过氧化反应.探讨天敌致死宿主的机理不仅有利于其开发应用,而且可为新型杀虫剂的合成提供参考.
[1] WU K M,LU Y H,FENG H Q,et al. Suppression of cotton bollworm in multiple crops in china in areas with Bt toxin-containing cotton[J]. Science,2008,321(5896):1676-1678.
[2] WU K M,GUO Y Y. The evolution of cotton pest management practices in China[J]. Annual Review of Entomology,2005,50:31-52.
[3] BECKAGE N E,GELMAN D B. Wasp parasitoid disruption of host development: implications for new biologically based strategies for insect control[J]. Annual Review of Entomology,2004,49:299-330.
[4] REN S,WANG W N,ZHAO N N,et al. Research progresses and prospects of nematode,Ovomermis sinensis[J]. Chinese Journal of Applied Entomology,2011,48(3): 716-719.
[5] WANG G X,CHEN Q H,CHEN G. In vitro cultivation of the entomogenous nematodeOvomermissinensis[J]. Acta Zoologica Sinica,2001,47(2): 235-239.
[6] CHEN F J,ZHANG C Z,GAO X W. In vitro inhibition of glutathione S-transferases by several insecticides and allelochemicals in cotton bollworm,Helicoverpa armigera Hubner[J]. Journal of Entomological Science,2007,42(2): 296-305.
[7] WU H D,LIU Q Z. Antioxidative responses in Galleria mellonella larvae infected with the entomopathogenic nematode Heterorhabditis sp. beicherriana[J]. Biocontrol Science and Technology,2012,22(5):601-606.
[8] WANG Y,OBERLEY L W,MURHAMMER D W. Evidence of oxidative stress following the viral infection of two lepidopteran insect cell lines[J]. Free Radical Biology and Medicine,2001,31(11):1448-1455.
[9] FELTON G W,SUMMERS C B. Antioxidant systems in insects[J]. Archives of Insect Biochemistry and Physiology,1995,29(2):187-197.
[10] DANNEELS E L,FORMESYN E M,HAHN D A,et al. Early changes in the pupal transcriptome of the flesh fly Sarcophagha crassipalpis to parasitization by the ectoparasitic wasp,Nasonia vitripennis[J]. Insect Biochemistry and Molecular Biology,2013,43(12):1189-1200.
[11] TAKEDA T,NAKAMATSU Y,TANAKA T. Parasitization by Cotesia plutellae enhances detoxifying enzyme activity in Plutella xylostella[J]. Pesticide Biochemistry and Physiology,2006,86(1):15-22.
[12] ETEBARI K,PALFREYMAN R W,SCHLIPALIUS D,et al. Deep sequencing-based transcriptome analysis of Plutella xylostella larvae parasitized by Diadegma semiclausum[J]. BMC Genomics,2011,12(2):266-267.
[13] CHEVIGNON G,CAMBIER S,DA S C,et al. Transcriptomic response of Manduca sexta immune tissues to parasitization by the bracovirus associated wasp Cotesia congregata[J]. Insect Biochemistry and Molecular Biology,2015,62: 86-99.
[14] ZHU J Y,ZE S Z,STANLEY D W,et al. Parasitization by Scleroderma guani influences expression of superoxide dismutase genes in Terebrio molitor[J]. Archives of Insect Biochemistry and Physiology,2014,87(1):40-52.
[15] WHEELER K,SHIELDS J D,TAYLOR D M. Pathology of Hematodinium infections in snow crabs (Chionoecetes opilio) from Newfoundland,Canada[J]. Journal of Invertebrate Pathology,2007,95(95):93-100.
[16] SCHMITTGEN T D,LIVAK K J. Analyzing real-time PCR data by the comparative C-T method[J]. Nature Protocols,2008,3(6):1101-1108.
[17] ZHANG S,FU W,LI N,et al. Antioxidant responses ofPropylaeajaponica(Coleoptera: Coccinellidae) exposed to high temperature stress[J]. Journal of Insect Physiology,2015,73: 47-52.
[18] ICEN E,ARMUTCU F,BUYUKGUZEL K,et al. Biochemical stress indicators of greater wax moth exposure to organophosphorus insecticides[J]. Journal of Economic Entomology,2005,98(2):358-366.
[19] YU Q Y,FANG S M,ZUO W D,et al. Effect of organophosphate phoxim exposure on certain oxidative stress biomarkers in the silkworm[J]. Journal of Economic Entomology,2011,104(1):101-106.
[20] JAMES R R,XU J. Mechanisms by which pesticides affect insect immunity[J]. Journal of Invertebrate Pathology,2012,109(2):175-182.
Antioxidative responses of Helicoverpa armigera (Lepidoptera: Noctuidae)parasitized byOvomermissinensis(Nematoda: Mermithidae)
JIAO Zhenlong,FENG Xufei,TAO Siying,WANG Guoxiu
(Hubei Key Laboratory of Genetic Regulation and Integrative Biology,School of Life Sciences,Central China Normal University,Wuhan 430079)
To understand how theOvomermissinensiskills its hostHelicoverpaarmigera,the host mortality was observed and found to be related to cell apoptosis. The antioxidant responses were further investigated by analyzing the activities of superoxide dismutase (SOD),catalase (CAT),peroxidase (POD),and glutathione-S-transferases (GST),as well as the mRNA expression ofHaSOD,HaCAT,HaPODandHaGST. The results showed that the activity level of SOD and POD,along with the gene expression level ofHaSOD,andHaPODin the host ofH.armigerasignificantly increased after infection ofO.sinensisfor 3 d,comparing with control treatments. The host mortality reached 6.75% resulting from melanism after nematode infection for 3 d and 93.25% of host mortality after 7 d. Consequently,all the activity levels of SOD,CAT,POD and GST significantly elevated as well as the corresponding genes compared to control. These suggested that accelerated cell apoptosis caused by oxidative damage might involve in the toxic process ofO.sinensisto its host. In addition,the level of malondialdehyde (MDA) in the infected host decreased,indicating that the lipid peroxidation was not produced in the process. The present work provided
for future research on broadly developing the natural enemy ofH.armigeraand exploring novel insecticides.
Ovomermissinensis;Helicoverpaarmigera; cell apoptosis; oxidative damage
2016-06-20.
国家自然科学基金项目(31572279).
1000-1190(2016)05-0752-06
Q255
A
*通讯联系人. E-mail: wanggx@mail.ccnu.edu.cn.
