低能N+离子注入阿维菌素B1a生产菌的诱变选育
2016-11-29龚文静娄兴焜虞龙
龚文静,娄兴焜*,虞龙
(1.扬子江药业集团有限公司质量管理部,江苏泰州225321;2.南京工业大学生物与制药工程学院,江苏南京211816)
低能N+离子注入阿维菌素B1a生产菌的诱变选育
龚文静1,娄兴焜1*,虞龙2
(1.扬子江药业集团有限公司质量管理部,江苏泰州225321;2.南京工业大学生物与制药工程学院,江苏南京211816)
以阿维菌素生产菌阿维链霉菌为研究对象,通过低能N+离子注入法对阿维链霉菌进行诱变选育。根据其存活率和突变率,确定最佳的诱变条件为:诱变能量为16 keV,诱变剂量为160×1014ions/cm2。经过诱变后筛选获得高产突变菌株AVE-10-N102-26。该菌株发酵产阿维菌素B1a含量为3 012 μg/mL,较出发菌株AVE-10提高了25.7%;经多次传代试验结果证明其遗传稳定性较好。
阿维菌素B1a;诱变选育;离子注入
阿维菌素(avermectins,AVM)是由放线菌属链霉菌中阿维链霉菌(Streptomyces avermitilis)发酵产生的一类十六元环内酯类多组分抗生素,天然阿维菌素按其C5、C22-23、C26三个位置上的结构差异可分为A1a、A1b、A2a、A2b、B1a、B1b、B2a、B2b共8种组分,其中B1a组分活性最高且毒性最小[1]。阿维菌素的杀虫机制独特,目前广泛应用于家畜的寄生虫感染、治疗以及农业虫害的防治,如家畜杀螨剂,菜青虫、小菜蛾、斜纹夜蛾防治等。阿维菌素具有高效、广谱、低残留以及对人畜和环境安全等特点,是一种重要的绿色生态型农畜用抗生素。目前已商品化的有伊维菌素(ivermectin,IVM)、阿维菌素(avermectin,AVM)、多拉菌素(doramectin,DOR)等。阿维菌素B1a的分子结构式如图1所示。

图1 阿维菌素B1a分子结构式Fig.1 Molecular structure of avermectins B1a
阿维菌素作为抗生素是一类次级代谢产物,涉及初级代谢和次级代谢的多种酶系,其调控机制复杂,随机诱变、定向筛选的方法依旧是目前生产商及科研机构应用最经典、最广泛的微生物育种手段,尤其是对于遗传背景未知的菌株,诱变选育是目前最好的选择。但传统应用的紫外、化学诱变由于长期使用,使得菌种对其产生“钝化效应”[4]。研究表明,离子注入诱变法是集物理诱变和化学诱变特性于一体的一种综合诱变方法,与传统诱变方式相比,除了有能量沉积外,还具有动量传递、质量沉积及电荷交换等效应[2-3],其不仅可以影响细胞的生理生化功能,还能引起细胞内脱氧核糖核酸(deoxyribose nucleic acid,DNA)分子的断裂、碱基的缺失等物理损伤,从而导致细胞遗传物质——染色体结构的变异,在低剂量注入下具有损伤轻、突变率高和突变谱广等特点[4-5]。作为一种具有独特诱变机理和生物效应的新型生物诱变源,近年来离子束在诱变育种方面的应用发展极为迅速。目前国内外已有大量研究者通过离子注入诱变成功获得目标性能大幅度提高且遗传性能稳定的菌株[6-12]。近年来,众多研究人员对阿维菌素采用了各种不同方法以改良其遗传特性,为提高有效组分B1a做了大量研究,但离子注入能否诱导阿维链霉菌发酵生成高产阿维菌素却鲜有研究报道。本研究利用低能N+离子作为物理诱变剂,对阿维链霉菌(Streptomyces avermitilis)进行诱变选育,并对不同诱变产物的有效成分进行检测,以期获得高产阿维菌素B1a的稳定菌株。
1 材料与方法
1.1材料与试剂
1.1.1菌种
阿维链霉菌(Streptomyces avermitilis)AVE-10:本实验室保存。
1.1.2培养基
平板/斜面培养基:可溶性淀粉10.0 g/L,(NH4)2SO42.5 g/L,NaC1 0.5 g/L,MgSO4·7H2O 1.2 g/L,K2HPO4·3H2O 3.0 g/L,CaCO33.0 g/L,琼脂粉15.0 g/L,pH 7.2~7.4,蒸馏水配制。
种子培养基:玉米淀粉25.0g/L,花生饼粉10.0g/L,黄豆饼粉8.0 g/L,酵母粉5.0 g/L,酵母膏5.0 g/L,玉米浆4.0 g/L,CoCl2·6H2O 0.003g/L,淀粉酶(酶活力为2 000 U/mg)4 μg/g淀粉,pH7.0~7.2,蒸馏水配制。
发酵培养基:玉米淀粉140.0 g/L,花生饼粉10.0 g/L,黄豆饼粉8.0 g/L,酵母粉5.0 g/L,酵母膏3.0 g/L,玉米浆2.2g/L,CoCl2·6H2O0.003g/L,淀粉酶(酶活力为2000U/mg)4 μg/g淀粉,pH7.2~7.4,蒸馏水配制。
1.1.3试剂
可溶性淀粉、氯化钠、氯化钴、磷酸氢二钾、琼脂粉、丙酮、乙酸乙酯(均为分析纯):国药集团(上海)化学试剂公司;葡萄糖:中国惠兴生化试剂有限公司;蔗糖、麦芽糖:中国医药集团(上海)化学试剂公司;硫酸镁、碳酸钙:汕头市西陇化工厂;硫酸铵:上海凌峰化学试剂有限公司;酵母粉:北京康明威培养基技术有限公司:甲醇(色谱纯):山东禹王实业有限公司。
1.2仪器与设备
P230II型高效液相色谱仪(high performance liquid chromatography,HPLC):大连依利特分析仪器有限公司;Agilent不锈钢色谱柱(内装填料PLRS-S,100Å,250mm× 4.6 mm,8 μm):美国安捷伦公司;XS-212型生物显微镜:南京江南光电集团公司;SPY50型双层培养摇床:上海市离心机械研究所;101A型电热鼓风干燥箱:上海实验仪器总厂;FA/JA型电子天平:上海精密科学仪器有限公司;SW-CJ-1B型超净台:苏州净化设备厂;YXQ-SG41-280型灭菌锅:上海医用核子仪器厂;Q/BKYY10-200型恒温培养箱:上海跃进医疗器械厂;752S型紫外分光光度计:上海凌光技术有限公司;离子束生物工程装置:中国科学院等离子体物理研究所。
1.3方法
1.3.1菌株活化
将保存的菌种阿维链霉菌AVE-10接种于平板/斜面培养基上,28℃活化培养6~7 d。
1.3.2单孢子悬浮液制备
向成熟的新鲜斜面加无菌水10 mL,刮洗下培养好的新鲜斜面孢子后,倾于带有一定玻璃珠的250 mL三角瓶内,250 r/min振荡摇匀20 min,经三层无菌脱脂纱布过滤,滤液加已灭菌的蒸馏水稀释后用血球计数板计数,至血球板上无孢子重叠,即为单孢子悬液,备用。
1.3.3低能N+离子注入诱变
取0.1 mL的单孢子悬液均匀涂布于无菌平皿上,以无菌风吹干。镜检无细胞重叠者进行低能N+离子注入。分别在10 deV、14 deV、16 deV、18 deV的注入能量下对阿维链霉菌进行N+离子注入。选择的注入剂量分别为40× 1014ions/cm2、80×1014ions/cm2、120×1014ions/cm2、160× 1014ions/cm2、200×1014ions/cm2、240×1014ions/cm2。靶室真空度为10-3Pa,以20 s脉冲式注入,间隔15 s,靶室内放置不接受N+离子注入的阴性对照样。
1.3.4菌株存活率的计算
离子注入完毕后,取出平皿,在无菌环境下用1 mL无菌水洗脱,涂布到平板/斜面培养基上,于28℃条件下倒置培养6~7 d,考察菌株的存活率并测定发酵液中B1a含量,以确定正突变率。菌株的存活率为诱变后平板培养基上生长的菌落数与同条件下未经诱变的阴性对照菌株在平板培养基上生长的菌落数的比值。
1.3.5低能N+离子注入对菌种突变率的影响
以出发菌株为对照,对诱变后的菌株进行发酵培养。先经平板/斜面培养后,进行种子培养,即挑取平板/斜面丰满灰色孢子,转接到种子培养基中,置于28℃,在200 r/min摇床转速下培养40 h。再以5%的接种量接入发酵培养基中,置于28℃,在200 r/min摇床转速下培养9 d。测定发酵液中阿维菌素B1a含量。
将阿维菌素B1a含量比出发菌株低5%的视为负突变菌株,在5%以内的视为无义突变菌株,高于5%的视为正突变菌株。其中,阿维菌素B1a正突变率指正突变菌株占全部被考察菌株的比例。
1.3.6突变菌株的初筛和复筛
初筛:转接至斜面培养基中,在28℃、200 r/min摇床转速下培养6~7 d后,取二分之一的菌体于离心管中,加入0.5 mL丙酮,浸泡12~15 h。然后加入0.25 mL乙酸乙酯,在快速混匀器上振荡l min,3 000 r/min离心10 min,取上清采用紫外分光光度法在波长254 nm处测定样品的光密度(OD254nm值)。以乙酸乙酯为空白对照,根据测得的光密度值结果,淘汰50%的低效价菌株。
复筛:将初筛得到的高产量菌株斜面接入种子培养基中于28℃、200 r/min摇床转速下扩大培养40 h,以5%(V/V)的接种量接入发酵培养基,在28℃、200 r/min摇床转速下培养8~9 d,用高效液相色谱法测定发酵液中阿维菌素B1a含量。
1.3.7发酵液中阿维菌素B1a含量测定
取发酵液3 mL,在3 500 r/min条件下离心10 min,弃上清液,加入甲醇至9 mL,在漩涡混合器上振荡30 min,3 500 r/min离心10 min后取上清液经稀释后用HPLC法测定B1a含量[6]。
色谱条件:色谱柱选用Agilent不锈钢柱(250 mm× 4.6 mm,8 μm)流动相为甲醇-水(85∶15,V/V),流速为1.0 mL/min,检测波长245 nm,进样量20 μL,柱温30℃。以质量浓度为100 μg/mL阿维菌素标准溶液进行定量分析,阿维菌素B1a含量计算公式如下:

2 结果与分析
2.1 N+离子注入对菌株存活率的影响
选取出发菌株AVE-10,利用N+离子注入进行诱变,考察不同注入能量和剂量对菌株存活率的影响,结果见图2。
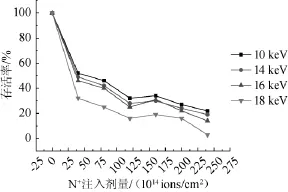
图2 N+离子注入对菌株存活率的影响Fig.2 Effect of N+ion beam implantation on survival rate of strains
由图1可知,不同能量的N+离子注入后菌株的存活率曲线均呈现“马鞍型”曲线[13]。当离子注入剂量<120 ions/cm2时,菌株的存活率随着N+离子注入剂量的增加而降低;在注入剂量为160×1014ions/cm2时,存活率出现短暂回升达到一个峰值,为40%左右;随后有逐渐下降,整个曲线呈“马鞍型”[13]。这种现象发生的原因可能是低剂量的离子只对孢子细胞的表面产生损伤及刻蚀,因此细胞存活率较高;随着注入剂量的增加,细胞表面刻蚀加重,离子对细胞内部产生损伤,同时生成大量自由基和软射线等,从而使细胞的存活率急剧下降。下降到一定限度时,连续注入的电荷堆积产生很强的库伦斥力并对细胞形成一种所谓的“保护屏障”,阻碍了后续注入离子对细胞的损伤,从而达到保护细胞的作用[13-14]。与此同时,离子注入激活细胞内的各种酶尤其是修复酶,提高了细胞损伤的修复效率,使得存活率有短暂回升[14];但继续增加剂量时,细胞损伤无所修复,细胞失去电荷屏障,存活率再次下降。
2.2 N+离子注入对菌株突变率的影响
经不同能量、不同剂量N+离子注入处理后得到的单菌落接种到种子培养基28℃、200 r/min摇床培养40 h后,进行摇瓶发酵培养,考察其正负突变率变化情况,结果见表1。
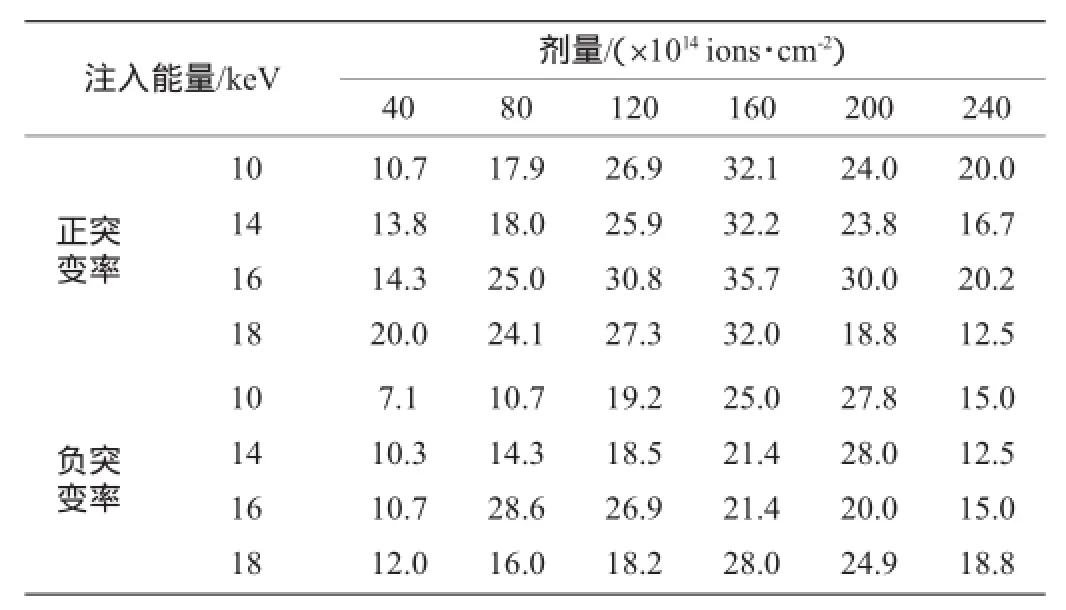
表1 不同剂量N+离子注入对菌株突变率的影响Table 1 Effect of different doses of N+ion beam implantation on mutation rate of strains%
由表1可知,10 keV、14 keV以及18 keV剂量下菌株的正突变率普遍低于16 keV,且负突变率普遍低于正突变率,也就是说可以确定16 keV为菌种的最佳诱变能量。在能量为16 keV、剂量为160×1014ions/cm2条件下正突变率最高,最容易筛选出效价提高幅度超过10%的正突变菌株,所以确定最佳诱变能量为16 keV、最佳诱变剂量为160×1014ions/cm2。
2.3诱变菌株的筛选
采用能量为16 keV的N+离子,以160×1014ions/cm2的处理剂量对菌株AVE-10进行诱变处理,初筛经紫外分光光度法测定后淘汰50%的低产菌株。将初筛获得的菌株照复筛要求进行培养后测定发酵液中阿维菌素B1a含量,根据HPLC测定结果,最终筛选获得3株产阿维菌素B1a含量较高的突变菌株,分别命名为AVE-10-N16、AVE-10-N23、AVE-10-N102,经发酵培养后,分别测定各发酵液种阿维菌素B1a含量,结果见表2。
由表2可知,筛选得到的3株菌株AVE-10-N16、AVE-10-N23、AVE-10-N102,其发酵产阿维菌素B1a含量较出发菌株AVE-10均有一定提高。其中菌株AVE-10-N102发酵产阿维菌素B1a含量最高,为2847μg/mL,比出发菌株提高了18.8%。

表2 突变菌株产阿维菌素B1a含量Table 2 Content of avermectins B1aproduced by the mutant strain
通过对筛选到得到菌株AVE-10-N102进行重复诱变一次,最终筛选到高产菌株产阿维菌素B1a含量从2396μg/mL提高到3 012 μg/mL,将其命名为AVE-10-N102-26。
2.4菌株遗传稳定性试验结果
对筛选到的高产阿维菌素B1a菌株AVE-10-N102-26进行遗传稳定考察。将出发菌株和筛选到得高产菌株AVE-10-N102-26共传5代,每代做3个平行样。遗传稳定性试验结果见表3。

表3 突变菌株遗传稳定性试验结果Table 3 Results of genetic stability tests of the mutant strain
由表3可知,高产菌株AVE-10-N102-26传代5次,其发酵产阿维菌素B1a的含量基本维持不变,与出发菌株比较,突变提高在23%以上,表明其很好地保持高产稳定的能力,阿维菌素B1a含量遗传稳定在3 000 μg/mL左右。
3 结论
为筛选到产阿维菌素B1a含量较高的阿维链霉菌,本研究采用低能N+离子注入阿维链霉菌进行诱变筛选,确定出低能N+离子注入的最优诱变能量及最优诱变剂量分别为16 keV和160×1014ions/cm2。在此条件下,筛选得到高产菌株AVE-10-N102-26,其产阿维菌素B1a含量为3 012 μg/mL,较出发菌株提高了25.7%,且遗传稳定性较好。诱变选育结果表明,低能N+离子注入法在提高菌株突变率的同时,对正向突变菌株也起到了一定的富集作用[15],是一种有效的诱变筛选模型,在微生物诱变选育领域具有广泛的使用价值。
[1]田靖,张惟才.阿维菌素的生物合成及代谢工程研究进展[J].生物技术通讯,2006,17(3):447-450.
[2]DRINYAEV V A,MOSlN V A,KRUGLYAK E B,et al.Antitumor effect of avermectins[J].Eur J Pharmacol,2004,501(1/3):19-23.
[3]SHAO C L,WANG X Q,YU Z L.Phosphate release from N+ions irradiated 5′-CMP nucleotide and its kinetics[J].Radiat Physics Chem,1997, 6(50):561-565.
[4]张建华,王乃彦,张丰收,等.离子注入诱变微生物应用与研究进展[J].北京师范大学学报,2011,47(3):262-266.
[5]石坡.离子注入D-核糖产生菌的诱变效应及作用机理研究[D].石家庄:河北师范大学,2013.
[6]赵丽坤,张利平,石楠,等.阿维菌素高产菌的诱变育种研究[J].安徽农业科学,2008,36(19):8062-8064.
[7]周小云,马盾,黄乐平.新疆离子束诱变育种研究现状[J].新疆农业科学,2007,44(S3):44-47.
[8]杨立峰,虞龙,张宁.低能N+离子注入天冬氨酸转氨酶高产菌株诱变选育的研究[J].化学与生物工程,2005(1):13-16.
[9]刘胜男,王亚洲,石林霞,等.γ-亚麻酸产生菌的低能离子束诱变选育[J].河南科技大学学报:自然科学版,2015,36(3):76-80.
[10]越南,吴冬兰,唐红殷,等.氮离子注入井冈霉素生产菌诱变高产菌株的研究[J].江西农业学报,2010,22(4):119-122.
[11]向廷生,郭晓博,张祥胜.低能离子诱变烃降解菌所产表面活性剂的研究[J].微生物学杂质,2013,33(1):48-53.
[12]杜艳.碳离子束辐照拟南芥突变体筛选及诱变效应研究[D].兰州:中国科学院研究生院(近代物理研究所),2015.
[13]沈以凌,谢飞,虞龙.低能氮离子注入在γ-亚麻酸发酵中的应用研究.中国酿造,2009,12(1):96-99.
[14]虞龙,张宇,龚文静,等.氯化锂-紫外-离子束复合诱变红霉素高产菌株研究[J].原子能科学技术,2011,45(7):780-784.
[15]金超楠,刘莉,史吉平,等.离子束诱变与连续驯化选育耐毒性产丁醇菌株[J].中国酿造,2015,34(6):25-28.
Mutation screening of avermectins B1aproducing strains with low energy N+ion beam implantation
GONG Wenjing1,LOU Xingkun1*,YU Long2
(1.Depatment of Quality Management,Yangtze River Pharmaceutical Group Co.,Ltd.,Taizhou 225321,China; 2.College of Biotechnology&Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 211816,China)
Using the avermectins-producingStreptomyces avermitilisas research object,the strain was mutated and screened by low energy N+ion beam implantation.According to the survival rate and mutation rate,the optimum mutation conditions were determined as mutation energy 18 keV and mutation dose 160×1014ions/cm2.The high yield mutant strain AVE-10-N102-26 was obtained by mutation,and the content of avermectins B1awas 3 012 μg/ml,which was 25.7%higher than that of original strain AVE-10.The results of subculture tests indicated that the strain had good genetic stability.
avermectins B1a;mutation screening;ion beam implantation
Q939.97
0254-5071(2016)08-0133-04
10.11882/j.issn.0254-5071.2016.08.030
2016-03-31
中国科学院知识创新工程重大项目(KZCX1-YW-14-3)
龚文静(1987-),女,助理工程师,硕士,研究方向为工业微生物育种。
娄兴焜(1987-),男,助理工程师,本科,研究方向为制药工程。
