沙棘籽提取物抑菌能力的研究及其生物活性成分分析
2016-11-29扎格乐边鑫赵莉徐敏王娜娜霍贵成
扎格乐,边鑫,赵莉,徐敏,王娜娜,霍贵成*
(东北农业大学食品学院乳品科学教育部重点试验室,黑龙江哈尔滨150030)
沙棘籽提取物抑菌能力的研究及其生物活性成分分析
扎格乐,边鑫,赵莉,徐敏,王娜娜,霍贵成*
(东北农业大学食品学院乳品科学教育部重点试验室,黑龙江哈尔滨150030)
选取蒙古国不同产地和不同培育方式的5种沙棘籽的活性成分进行了提取,研究了提取物对常见致病菌的抑菌能力,并对其中的生物活性成分进行了分析。结果表明,野生沙棘籽1号提取物对金黄色葡萄球菌的抑菌能力最强,抑菌圈直径可达(12.3±0.5)mm,而3号提取物具有广谱抑菌能力,对枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌的抑菌能力最强,抑菌圈直径分别达到(11.5±0.5)mm、(12.3±0.2)mm和(11.9±0.3)mm,并且随着沙棘籽提取物的用量增加,其抑菌能力增强。沙棘籽提取物中主要的生物活性成分主要为植物甾醇、黄酮类物质、植物磷脂和维生素C,其中植物甾醇含量越高,对应的抑菌能力越强。
沙棘籽;生物活性成分;抑菌能力
沙棘(Hippophae rhamnoidesLinn)原产于温带、亚热带的欧亚地区。中国是世界上对沙棘利用率最高的国家,早在古代,许多医学名著中均有对沙棘果补脾健胃、活血化瘀和清热止泻等医药功效的记载。据国内外专家研究发现,沙棘的果实、叶、种子和皮等各器官均有多种营养和药用价值[1-3],除此之外,沙棘酸奶、沙棘果汁和果酱等产品也倍受人们欢迎[4-5]。
国内外学者研究发现,沙棘中含有各种生物活性成分,诸如沙棘叶子中的黄酮类物质及多糖类物质。其中,万方琼等[6]研究了沙棘叶中总黄酮的提取方法,为相关研究提供了理论基础;李淑珍等[7]优化了沙棘叶中黄酮的纯化工艺,经优化得黄酮精制品1.29 g,总黄酮含量为14.89%,比粗制品的黄酮含量提高了103倍,且优化的工艺操作简单,产率高,可用于工业化大规模生产;赵二劳等[8]优化了沙棘叶中多糖的提取,在微波辅助的条件下可有效提高多糖的提取率。
为了防止食品的腐败变质,各种化学防腐剂越来越多的添加到食品中,长期食用会对人们的身体健康造成潜在的危害,随着人们消费水平的提高,无毒、无害的天然食品防腐剂成为大家关注的焦点。沙棘中富含生物活性成分,而且,研究证实其具有较强的抑菌潜力[9]。本实验选取蒙古国不同产地和不同培育方式的5种沙棘籽的活性成分进行了提取,然后研究了提取物对常见致病菌(金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌)的抑菌能力、抑菌谱以及不同的用量对抑菌能力的影响,并对其中的生物活性成分进行了初步分析。旨在为沙棘籽提取物作为生物防腐剂提供理论依据,开发一种新型的天然防腐剂具有重要意义。
1 材料与方法
1.1材料与试剂
1.1.1材料与菌株
分别选取蒙古国3个不同地区的野生沙棘1号(鄂尔浑)、2号(达尔汗乌勒)、3号(肯特)和两个不同地区人工培养的沙棘A(戈壁松布尔)和B(戈壁阿尔泰)。绿假单胞菌(Pseudomonas aeruginosa)CICC 10419、大肠杆菌(Escherichia coli)CICC 10004、金黄色葡萄球菌(Staphylococcus aureus)CICC10201和枯草芽孢杆菌(Bacillus subtilis)CICC 10732、卷枝毛霉(Mucorcircinelloides)CICC2632、扩展青霉(Penicillium expansum)CICC 40658、白色念珠菌(Candida albicans)ATCC 18804、黄曲霉(Aspergillus flavus)CICC 2091、拜耳接合酵母(Zygosaccharomycesbailii)CICC1281、汉逊德巴利酵母(Debaryomyces hansenii)CICC 1714、解脂耶罗维亚酵母(Yarrowia lipolytica)CICC 32519和蜡样芽孢杆菌(Bacilluscereus)CICC21290均购于中国工业微生物菌种保藏管理中心(Chinacenterofindustrialculturecollection,CICC);单核细胞增生李斯特菌(Listeria monocytogenes)ATCC 19115、沙门氏菌(Salmonella)ATCC 14028、植物乳杆菌(Lactobacillus plantarum)KLDS 1.0344、干酪乳杆菌(Lactobacillus casei)KLDS 1.0381、嗜酸乳杆菌(Lactobacillus acidophilus)KLDS AD1、瑞士乳杆菌(Lactobacillus helveticus)KLDS 1.8701、乳酸乳球菌(Lactococcus lactis)KLDS4.0325、保加利亚乳杆菌(Lactobacillus bulgaricus)KLDS1.0205和嗜热链球菌(Streptococcus thermophilus)KLDS3.0207均由东北农业大学教育部重点试验室工业微生物菌种保藏中心提供。
1.1.2培养基
LB培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化钠10 g/L。
营养肉汤培养基:蛋白胨10 g/L、氯化钠5.0 g/L、牛肉膏3.0 g/L。
胰蛋白胨大豆肉汤(trypticase(tryptic)soy broth,TSB)培养基:胰蛋白胨17 g/L、大豆蛋白胨3.0 g/L、氯化钠5.0 g/L、磷酸氢二钾2.5 g/L、葡萄糖2.5 g/L。
脑心浸液(brian heart infusion,BHI)培养基:蛋白胨10 g/L,脱水小牛脑浸粉12.5 g/L,脱水牛心浸粉5 g/L,氯化钠5 g/L,葡萄糖2 g/L,磷酸氢二钠2.5 g/L(固体培养基中加15 g/L琼脂),调pH值为7.4。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取马铃薯浸取液1.0 L加入葡萄糖20.0 g/L,KH2PO43.0 g/L,MgSO4·7H2O 1.5 g/L,维生素B1微量,琼脂15.0 g/L,调pH为6.0。
麦芽汁培养基:麦芽汁150 mL,pH自然(6.4)。以上培养基均在121℃条件下灭菌15 min。
1.1.3试剂
所有试验试剂均为国产分析纯。
1.2仪器与设备
XS104分析天平:瑞士METTLERTOLEDO公司;DU-800紫外分光光度计:美国BECKMAN公司;BCN1360生物洁净工作台、HH-8电热恒温水浴锅:上海智城分析仪器制造有限公司;LTI-700电热恒温培养箱:上海佳胜试验设备有限公司。
1.3方法
1.3.1沙棘籽提取物的制备
将沙棘清洗干净,晾干后用坩埚杆将其捣碎,取出沙棘籽。用无菌蒸馏水反复清洗沙棘籽3~4次,沙棘籽烘干后用坩埚杆将其捣碎;然后以甲醇∶水为6∶4(V/V)的溶液为提取溶剂,在料液比1∶1(g∶mL)、提取温度50℃条件下,提取2次,每次3 h,取滤液制得沙棘籽提取物,放置4℃冰箱贮存备用。
1.3.2沙棘籽提取物抑菌能力的测定
选取金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌进行抑菌试验,其中金黄色葡萄球菌用TSB培养基培养,枯草芽孢杆菌和铜绿假单胞杆菌用营养肉汤培养基培养,大肠杆菌用LB培养基培养。采用滤纸片法测定抑菌活性,即将指示菌培养到稳定期,然后在无菌平板中加入已接入指示菌的琼脂培养基,待冷却凝固后,用无菌镊子放入滤纸片,取沙棘籽提取物溶解在丙二醇的溶液(0.5 mg/mL)并在滤纸片(直径为6 mm)上加入50 μL不同组沙棘籽提取物溶液,放入37℃培养箱内培养24 h,测量抑菌圈直径的大小。以等量的庆大霉素为阳性对照,为无菌蒸馏水为阴性对照,研究不同来源沙棘籽提取物活性成分的抑菌能力。
1.3.3沙棘籽提取物的抑菌谱
为了确定沙棘1号和沙棘3号提取物的抑菌谱,选取了18株指示菌包括食源性致病菌、霉菌、枯草芽孢杆菌以及部分乳酸菌进行了评价。具体评价方法参照1.3.2中的滤纸片法进行抑菌试验,滤纸片直径6 mm,并对抑菌圈直径进行测量。
1.3.4沙棘籽提取物含量与抑菌能力关系的研究
选取金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌,加大沙棘籽提取物溶液至100 μL、150 μL,探究沙棘籽提取物活性成分含量与抑菌能力关系。
将指示菌培养到稳定期,然后在无菌平板中加入已接入指示菌的琼脂培养基,待冷却凝固后,用无菌镊子放入滤纸片(直径为6 mm),并在滤纸片上加入100 μL、150 μL不同组沙棘籽提取物溶液,放入37℃培养箱内培养24 h,测量抑菌圈直径的大小。
1.3.5沙棘籽提取物生物活性成分的测定
植物甾醇含量参照国标GB/T 5009.128—2003[10]《食品中胆固醇的测定》中铁矾显色法和窦巍巍等[11]所述的方法进行测定;总黄酮含量参考蔡定建等[12]所述的方法进行测定;植物磷脂、维生素C含量参照中华人民共和国水利行业标准SL 493—2010《沙棘籽油》[13]中活性物质的检测方法进行测定。
1.3.6数据统计分析
所有试验均进行3次重复试验,数据处理均通过SPSS13.0进行统计学分析,两两比较采用Duncan法,试验结果采用平均值±标准差表示,P<0.05为差异有显著性意义;图表运用Excel 2007进行绘制。
2 结果与分析
2.1沙棘籽提取物活性成分提取物对常见致病菌的抑菌作用
由于沙棘籽提取物中含有丰富的生物活性物质,其中大多数成分均对常见致病菌有抑制作用[15]。不同沙棘籽样品对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌的抑菌能力,结果如图1所示。
由图1a可知,1号样品对金黄色葡萄球菌的抑菌能力最强,抑菌圈直径达到12.0 mm,但与庆大霉素抑菌圈直径(23.5±0.4)mm相比还有一定差距;由图1(b~d)可知,3号样品对枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌的抑菌能力最强,抑菌圈直径分别为(11.5±0.5)mm、(12.3± 0.2)mm和(11.9±0.3)mm,但与庆大霉素(抑菌圈直径分别为(20.6±0.4)mm、(22.4±0.7)mm和(21.8±0.5)mm)相比还有一定差距,这可能由于沙棘籽活性物质提取物中有效成分的浓度未达到阈值,因此,需要进一步浓缩纯化提高其浓度和纯度。
整体来说,野生沙棘籽1号和3号样品对指示菌的抑菌能力于其他样品强,这可能由于是天然培养条件下的沙棘中有效成分种类更为丰富或有效成分含量更多,而人工培养条件可能改变了有效营养成分种类和含量,从而导致其抑菌能力稍差,该结果与HANDIQUE P J等[14]的研究结果一致。因此,选择野生沙棘籽1号和3号样品进行后续实验。
2.2沙棘籽野生提取物的抑菌谱
为了考察沙棘籽1号和3号提取物对其他菌种的抑菌能力,选取了部分食源性致病菌、霉菌以及部分乳酸菌作为考察对象进行了抑菌谱试验,所得结果如表1所示。

图1 不同沙棘籽提取物对致病菌的抑菌活性Fig.1 Antibacterial activities of different sea-buckthorn seed extracts on pathogenic bacteria
由表1可知,沙棘籽3号提取物对提供的致病菌、霉菌和酵母菌均具有明显的抑制作用,而沙棘籽1号提取物对提供的致病菌、霉菌和部分酵母菌有抑制作用,其中其对拜耳接合酵母和汉逊德巴利酵母没有抑制作用,而且整体的抑菌活性低于沙棘籽3号提取物。值得注意的是,沙棘籽1号及3号提取物对所提供的乳酸菌均没有抑制作用,这些乳酸菌通常用于发酵食品的生产,因此,沙棘可作为原料或辅料用于发酵制品生产,而且对其中的乳酸菌生长不会产生影响。
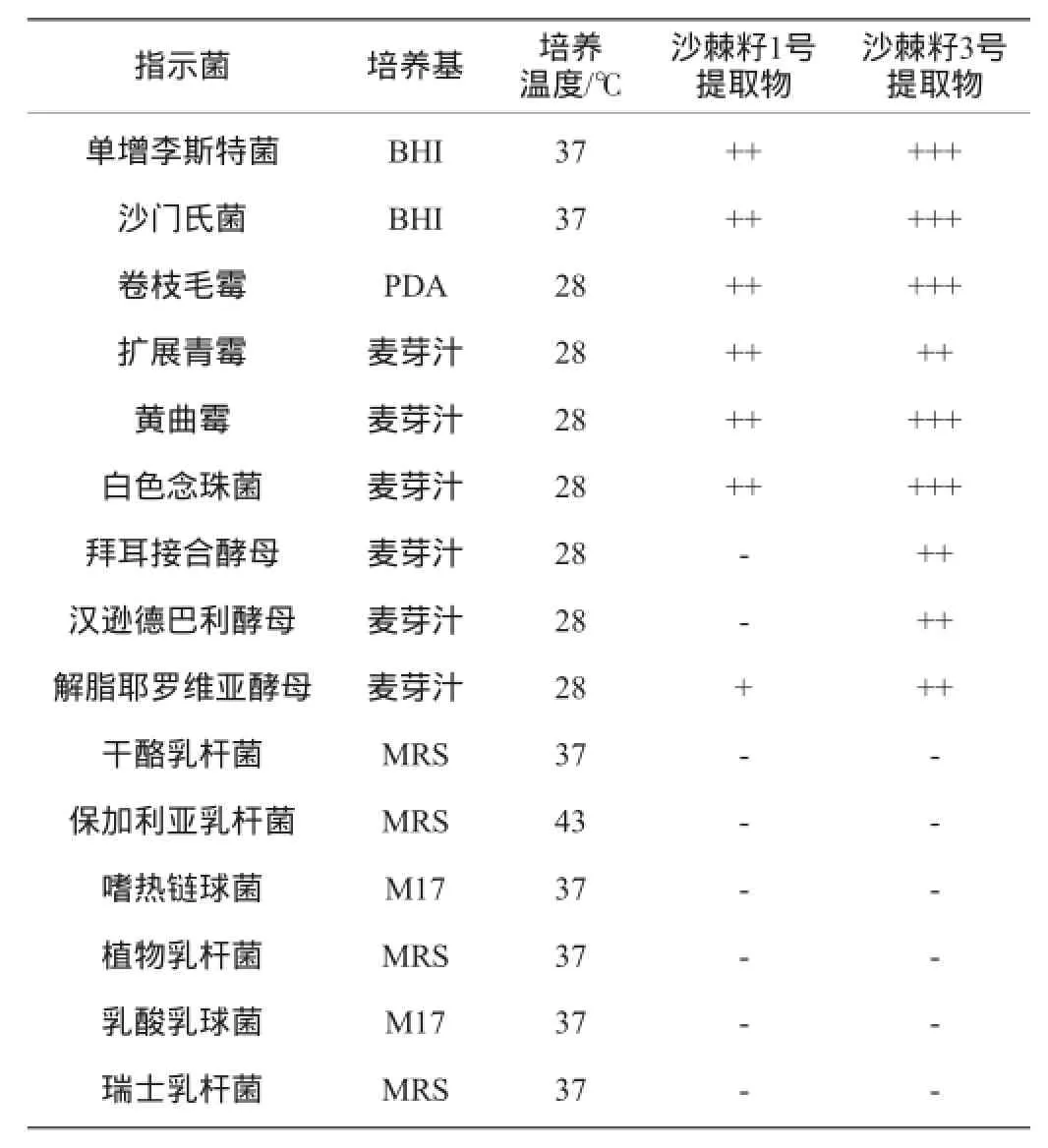
表1 沙棘籽1号提取物和沙棘籽3号提取物的抑菌谱Table 1 Antimicrobial spectrum of sea-buckthorn seed No.1 and No.3 extracts
2.3沙棘籽提取物活性成分含量与抑菌能力关系的研究
选取金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞杆菌为指示菌,加大沙棘籽提取物溶液体积至100 μL、150 μL,探究沙棘籽提取物活性成分含量与抑菌能力关系,不同来源沙棘籽提取物对致病菌抑菌效果分别如图2A、2B所示。
由图2A可知,增大沙棘籽提取物溶液至100 μL时,不同品种沙棘籽提取物的抑菌性均有一定的提高。自然条件下选育的沙棘籽1号提取物对金黄色葡萄球菌具有较强的抑菌效果(见图2A-a),抑菌圈直径达到12.9 mm,其次为自然条件下选育的品种3号沙棘籽提取物,抑菌圈直径约12.3 mm。继续增大沙棘籽提取物溶液至150 μL时(见图2B),沙棘籽1号提取物对金黄色葡萄球菌抑菌圈直径达到13.2 mm,其次为自然条件下选育的品种3号沙棘籽提取物,抑菌圈直径约12.8 mm。结果表明,加大沙棘籽提取物的添加剂量,可以提高其对金黄色葡萄球菌的抑菌活性。
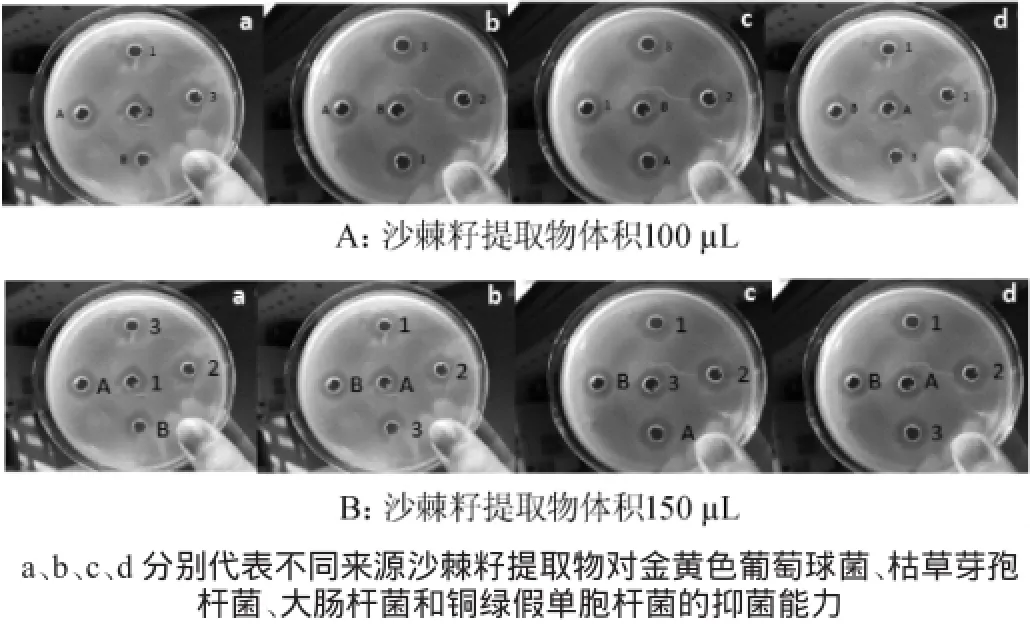
图2 不同用量沙棘籽提取物对致病菌抑菌效果Fig.2 Antibacterial activities of different addition of sea-buckthorn seed extracts on pathogenic bacteria
增大沙棘籽提取物活性成分的含量至100 μL和150 μL,不同品种沙棘抗枯草芽孢杆菌(见图2A-b和2B-b)潜力也有一定的提高,具体表现在5种沙棘籽提取物中,自然条件下选育的沙棘籽3号提取物对枯草芽孢杆菌具有较强的抑菌效果,抑菌圈直径达到11.9 mm和12.1 mm,其次为自然条件下选育的品种1号沙棘籽提取物,抑菌圈直径约11.3 mm和11.9 mm,再次为自然条件下选育的品种2号沙棘籽提取物,而人工培育出的沙棘籽提取物具有较弱的抗枯草芽孢杆菌潜力。由图2A-c、2B-c、2A-d和2B-d可知,增大沙棘籽提取物活性成分的含量至100 μL和150 μL,类似的结果也出现在不同品种沙棘籽对大肠杆菌和铜绿假单胞杆菌能力试验中。结果表明,加大沙棘籽提取物的添加量,可以提高其对致病菌的抑菌活性。
2.4沙棘籽提取物中的生物活性物质含量分析
同一植物在不同地区会因气候、土壤和环境等因素的影响,在生长过程中累积不同的生物活性物质。对不同地区人工培养和自然生长条件下的沙棘籽中的生物活性成分进行定性分析,结果如表2所示。

表2 不同地区沙棘籽中的生物活性成分含量检测结果Table 2 Detection results of bioactive components contents in sea-buckthorn seed from different regions
由表2可知,5个品种的沙棘籽提取物质中含有的生物活性成分种类相同,主要为植物甾醇,黄酮类物质、植物磷脂和维生素C,但活性成分含量存在一定差异。沙棘籽3号提取物中含有较高含量的植物甾醇和总黄酮;沙棘籽2号品种具有较高植物磷脂及维生素C;而沙棘籽1号提取物、沙棘籽A号提取物和沙棘籽B号提取物中各成分含量相对适中。值得注意的是,5种沙棘籽提取物中植物甾醇含量显著高于其他活性成分(P<0.05),而且结合图1的结果,不难发现,植物甾醇含量高的沙棘籽提取物,其抑菌能力也越强。这说明,沙棘籽提取物的抑菌活性来自于植物甾醇的作用。国内外研究表明,沙棘籽提取物中的植物甾醇具有抑菌、抗氧化等作用[15],这与本研究得出的结果相吻合。
3 结论
本研究对蒙古国不同产地和不同培育方式的5种沙棘籽提取物的抑菌作用进行了研究,结果表明,沙棘籽1号提取物对金黄色葡萄球菌具有较强的抑菌作用,而沙棘籽3号提取物对枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌具有较强的抑菌作用,抑菌谱试验结果表明,沙棘籽3号提取物具有广谱抑菌作用,其对一些常见的有微生物(致病细菌、霉菌、酵母菌)抑制作用明显,而对于乳酸菌的生长则没有抑制作用。不同剂量沙棘籽提取物的抑菌试验结果表明,沙棘籽提取物的抑菌作用随着添加剂量的增加而增加。另外,本研究分析了沙棘籽中的植物甾醇、黄酮类物质、植物磷脂和维生素C等生物活性成分,其中植物甾醇是沙棘籽提取物中发挥抑菌作用的主要活性成分。
[1]王翔飞.沙棘籽渣的化学成分研究[D].杨凌:西北农林科技大学,2006.
[2]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:20-30.
[3]钱学射,金敬红.沙棘的药用研究与开发[J].中国野生植物资源,2015,34(6):68-72.
[4]李超敏,李林珂,郭明月.营养保健型沙棘酸奶的研制及感官评定研究[J].食品与发酵科技,2013,49(3):27-29.
[5]闫波,林宇红,刘晓红,等.新型保健沙棘枸杞果肉酸奶的研制[J].中国乳品工业,2015,43(8):53-56.
[6]万方琼,周吉银,曾圣雅,等.沙棘叶总黄酮分离纯化研究进展[J].安徽农业科学,2014,42(30):10517-10518.
[7]李淑珍,武飞,陈月林,等.沙棘叶黄酮纯化工艺优化[J].安徽师范大学学报:自然科学版,2015,29(6):21-23.
[8]赵二劳,韩永花,张海容.微波辅助萃取沙棘叶多糖的研究[J].江西师范大学学报:自然科学版,2005,29(3):207-209.
[9]闫涛,罗丽梅,谢竹田,等.沙棘的化学成分及生物功能的研究进展[J].吉林医药学院学报,2010,31(1):40-45.
[10]中国预防医学院营养与食品卫生研究所.GB/T5009.128—2003食品中胆固醇的测定[S].北京:中国标准出版社,2003.
[11]窦巍巍,胡立志,朱秀清,等.酯交换植物油中甾醇测定方法研究[J].东北农业大学学报,2011,42(8):43-47.
[12]蔡定建,柳茶花,钟鸿鸣,等.莲子心中黄酮类物质的提取和测定[J].中国酿造,2010,29(1):132-135.
[13]中华人民共和国水利部.SL 493—2010沙棘籽油[S].北京:中国电力出版社,2010.
[14]SAIKIA M,HANDIQUE P J.Antioxidant and antibacterial activity of leaf,bark,pulp and seed extracts of seabuckthorn(Hippophae salicifolia D.Don)of Sikkim Himalayas[J].J Med Plant Res,2013,19(7):1330-1338.
[15]贺亮.中国陕甘地区苦楝多糖及苦楝籽油的研究[D].北京:北京林业大学,2007.
Research on the antimicrobial activity of the sea-buckthorn seed extract and analysis of its bioactive components
BAYARAA Zoljargal,BIAN Xin,ZHAO Li,XU Min,WANG Nana,HUO Guicheng*
(Key Laboratory of Dairy Science,Ministry of Education,College of Food Science, Northeast Agricultural University,Harbin 150030,China)
The active constituents of five kinds of sea-buckthorn seed with different regions and different cultivation ways from Mongolia were extracted.The antimicrobial activity of extracts on common pathogenic bacteria was researched,and the bioactive components were analyzed.The results showed that the antimicrobial activity of wild sea-buckthorn seed NO.1 extract againstStaphylococcus aureuswas the strongest,and the diameter of inhibition zone was(12.3±0.5)mm.But wild sea-buckthorn seed NO.3 extract had a broad-spectrum antibacterial ability,and the its antimicrobial activity onBacillus subtilis,Escherichia coliandPseudomonas aeruginosawas the strongest,the diameters of inhibition zone were (11.5±0.5)mm,(12.3±0.2)mm and(11.9±0.3)mm,respectively.With the increasing of sea-buckthorn seed extract addition,its antimicrobial activity was stronger.The main bioactive components in sea-buckthorn seed extracts were phytosterol,flavonoids,plant phospholipids and vitamin C,and the higher phytosterols content was,the stronger antimicrobial activity was.
sea-buckthorn seed;bioactive components;antimicrobial activity
TS201.3
0254-5071(2016)08-0110-05
10.11882/j.issn.0254-5071.2016.08.025
2016-03-26
国家自然科学基金(31401512);国家高技术研究发展计划‘863计划’(2011AA100902)
扎格乐(1985-),女,硕士研究生,研究方向为食品科学。
霍贵成(1958-),男,教授,博士,研究方向为食品科学。
