超短时间回波磁共振成像对类风湿关节炎关节钙化区的研究进展
2016-11-29赵英华朱艳春胡绍勇肖继杰李绍林
赵英华 朱艳春 李 葳 胡绍勇 肖继杰 李绍林
超短时间回波磁共振成像对类风湿关节炎关节钙化区的研究进展
赵英华1朱艳春2李葳1胡绍勇1肖继杰1李绍林1
超短回波时间磁共振成像;间充质干细胞;类风湿关节炎;关节软骨钙化区;综述
MRI是目前观察干细胞在体内移植的生长和发育最常用的方法。然而,准确评估干细胞移植后类风湿关节炎(rheumatoid arthritis,RA)的关节软骨钙化区(zone of calcified cartilage,ZCC)的治疗效果是临床面临的一个问题,尤其是在评估RA的生理和生化变化方面。本文对基于超短时间回波磁共振成像(ultrashort time echo magnetic resonance imaging,UTE-MRI)观察干细胞治疗RA关节软骨ZCC治疗反应的研究现状及修复情况的最新进展进行总结,讨论目前UTE-MRI技术的临床应用和未来发展的限制。
1 ZCC的结构、功能及RA的ZCC发病机制、修复现状
关节软骨从表层到最深层分为表面区、过渡区、辐射区和ZCC共4个区[1],其中ZCC占关节软骨总厚度的3%~8%,其内水含量约占65%,其作用是为软骨提供一定的坚硬度,有利于软骨细胞和滑液内的气体、营养和废物之间的交换[2]。通常情况下,少部分水是以自由水的形式存在,大部分水与基质蛋白聚糖(proteoglycan,PG)富含负电荷的硫酸酯及羧基结合形成结合水,以阻止水从负重软骨表面孔隙中流失[3]。影响水含量的因素较复杂,包括胶原和PG的含量及结构变化等[4]。ZCC是连接骨-软骨功能单位的重要枢纽,具有传导分散应力、抵抗剪切力、紧密连接骨软骨及限制组织液在骨和软骨之间自由交换等作用[5]。
RA发病时,PG大分子结构破坏,结合水减少;同时胶原纤维肿胀,胶原纤维的张力降低,使关节软骨内交换的自由水增加,导致自由水容易流失[6],出现肥大的软骨细胞表型,引起潮线前移、ZCC重塑、矿化程度、硬度增加、通透性改变,破坏了ZCC缓解骨-软骨界面应力梯度的作用,最终将附着于骨组织的ZCC剥离,使软骨完全损毁[7]。因此,关节软骨ZCC的组织结构及生物功能的修复对RA的功能修复至关重要,重建关节软骨ZCC已成为近年兴起的界面组织工程领域研究热点。
目前治疗RA的方法主要有非甾体抗炎药、抗风湿药、生物制剂,或通过软骨下钻孔、软骨骨膜移植等方法治疗[8],但是上述治疗方法对于病程较长、疾病活动性顽固的RA患者疗效不理想,对于RA所致的软骨破坏无效,因此迫切需要一种新的具有修复受损关节的治疗方法。
骨髓间充质干细胞(bone mesenchymal stem cells,MSCs)是一种基质干细胞,具有修复软骨的功能[9]。同时,MSCs还能够抑制T细胞为主的免疫调节作用和炎症因子的分泌,改善血管生成和防止纤维化,利用MSCs治疗RA是一项新的有效的治疗方法[10]。
近年来,界面组织工程正蓬勃发展,如何构建既具备生物学效应,又能执行特殊生理、生化功能的精细ZCC界面结构,是目前的一个难题[11]。既往研究采用MSCs及不同材料、方法构建成具有ZCC界面的骨-软骨复合支架植入体内,较单纯骨-软骨双支架具有更好的分散应力和抗剪切力作用,优于自体骨软骨移植修复[12-16]。有关RA关节软骨ZCC的生化、结构和生物学变化,MSCs修复RA关节ZCC时如何构建具备生物学效应、执行特殊生理和生化功能的精细界面结构的机制有待研究。
2 活体观察RA的ZCC的方法
目前多数研究通过显微技术观察ZCC的形成、生长、退变等,主要探讨了ZCC表面粗糙度、厚度、胶原、羟基磷灰石的含量及所占比例[17-19],显示骨关节炎的ZCC增厚、细胞间质被水解酶消化、I型胶原显著增加、III型胶原保持不变、软骨细胞基质金属蛋白酶-1和基质金属蛋白酶-3的表达显著增加、通透性增加等病理改变[20]。然而,目前有关RA关节软骨ZCC的研究较少,仅Zschäbitz[21]报道1例RA关节软骨ZCC被选择性地破坏,非钙化软骨保持完好。既往活体观察ZCC的方法不仅操作复杂,而且浪费了大量的实验资源。
MRI可以显示组织、细胞和亚细胞水平的特定分子,反映活体状态下分子水平变化[22],采用非侵入性的影像参数对生理和病理过程中的分子进行定性或定量的可视化观察,帮助阐明治疗过程中的生物学机制。然而,由于关节软骨ZCC氢质子的T2弛豫时间仅为200~500 μs,ZCC短T2成分的MRI信号在激发后迅速衰减,目前采用的梯度回波、快速自旋回波及反转恢复序列等常规MRI在ZCC表现为无信号或极低信号,不能观察其代谢和生化信息[18]。近年来发展的阳性及阴性对比剂进行干细胞移植后MRI示踪监测技术,仅观察移植干细胞在体内的生长及发育情况,不能准确显示RA的发生及发展过程中关节软骨ZCC的生理及生化演变过程[23-26]。
3 用于关节软骨ZCC的UTE-MRI应用及存在的问题
随着MRI技术的飞速发展,UTE-MRI使ZCC成像成为可能[27],可以采集到如CCZ等短T2组织的信号[28],再结合长T2组织(如肌肉、脂肪)的抑制[29],可清晰显示关节软骨层面信息,使ZCC的线状高信号界线清晰(图1),有利于评价RA关节软骨ZCC对MSCs修复RA的反应。Brossmann等[30]报道,UTE(TE=150 μs)可显示早期骨关节炎ZCC信号改变,其敏感度及特异度均为100%。ZCC内结合水、自由水及总水含量是UTE-MRI用于检测MSCs修复RA关节软骨的生理学基础。
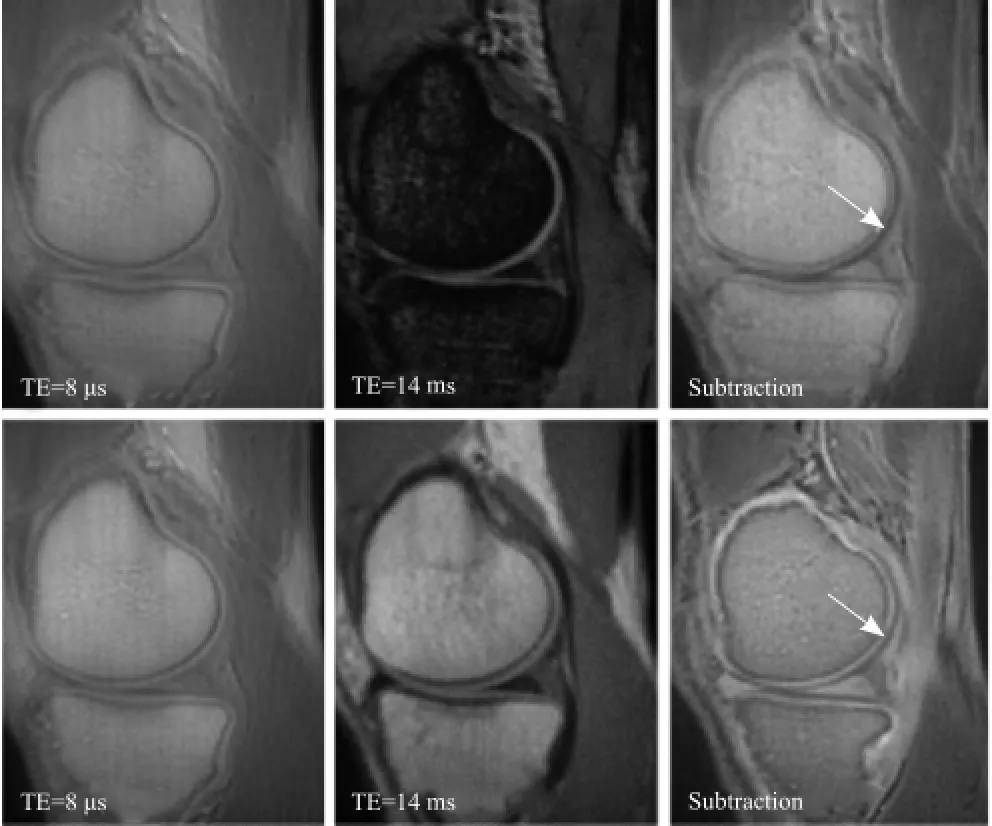
图1 双梯度回波(上排)及双自旋回波(下排)得到的健康志愿者关节图像。发现自旋回波可以得到更好的关节软骨ZCC的图像(箭)
Du等[31]最早采用双回波差UTE法(图2A、B)研究骨关节及肌骨成像,显示ZCC为明亮色,但其缺点是第2个回波的TE信号较弱,结果容易受到涡流、磁化率差异的影响。绝热反转恢复UTE方法(图2C、D)仅剩下大量未受影响的短T2组织信号,此方法的缺点是不能同时反转长T2水和脂肪或导致显著的短T2信号衰减。双绝热反转恢复(DIR)UTE脉冲序列(图2E、F)对短T2的磁化影响较小,其缺陷是需要2个隔热反转脉冲,可能导致吸收率增加。
二维DIR UTE成像(图3A)应用半射频脉冲结合层面选择梯度实现层面激发、放射状或螺旋状轨迹填充k空间,但对组织细微结构成像时(层厚0.7 mm对厚度<0.1 mm成像时)易受部分容积效应影响,应用短硬脉冲激发及三维放射状采集实现三维UTE成像(图3B),可消除容积效应的影响。

图2 双回波UTE(A)、单绝热反转恢复(C)及双绝热反转恢复(E)脉冲序列。B、D、F分别是3种脉冲序列对应的短T2对比度形成机制

图3 UTE脉冲序列。A.二维半射频脉冲结合极性相反的优化选层梯度激发一层,采用二维放射状轨迹填充k空间;B.短矩形硬脉冲激发后三维放射状轨迹填充k空间
UTE多回波脉冲序列对组织含水及生化结构非常敏感。Pauli等[32]采用UTE-MRI序列观察到的短T2*水成分与组织病理学分级(Mankin分级)和偏振光显微镜测试法 (Vaudey分级)有明显的相关性。光谱成像UTE显示ZCC的T2*值为1~2 ms[33-35]。Eliav等[36]研究认为UTE-T2* mapping能定量评价ZCC内自由水含量、结合水含量、总水含量及有机基质含量,可间接反映PG的含量、胶原纤维的各向异性等结构。磁化转移UTE可用于定量评估短T2组织结合水与自由水的T1、T2及比例等[36]。DIR-UTE逐渐饱和恢复时间获得T1ρ,可反映受限水分子运动和大分子环境之间的相互作用,对PG丢失高度敏感。Du等[34]收集6例尸体髌骨采用3T MR通过DIR-UTE成像,测得ZCC的T2*、T1及T1ρ值分别为(2.0±1.2)ms(1.0~3.3 ms)、(305±45)ms(256~389 ms)及(3.6±1.2)ms(2.2~4.6 ms)。Williams等[33]收集11例负重胫骨内侧髁及胫骨平台,行增强3D UTE-T2* MRI检查,发现两者关节软骨深部的重复测量值均方根平均系数的变化分别为16%、13%,绝对误差分别为1.5 ms、2.1 ms,证明增强3D UTE-T2* MRI是一种可重复定量检测ZCC的新型技术。
综上所述,基于UTE-MRI对RA关节软骨ZCC的定量评估,可准确测量总水含量、结合水与自由水含量及比例等信息[37],准确测量ZCC的T2*、T1及T1ρ值等影像生物标志,间接反映有机基质PG含量、胶原纤维结构和排列、矿化程度和硬度及通透性改变等,可反映IB与RA关节软骨ZCC的结构、生理及生化的相关性[38],弥补了既往需要处死动物取病理观察治疗效果及常规MRI检查无法定量评估ZCC等不足,具有广阔的应用前景。
[1] Porter EG, Winter MD, Sheppard BJ, et al. Correlation of articular cartilage thickness measurements made with magnetic resonance imaging, magnetic resonance arthrography, and computed tomographic arthrography with gross articular cartilage thickness in the equine metacarpophalangeal joint. Vet Radiol Ultrasound,2016, 57(5): 515-525.
[2] Mahjoub M, Berenbaum F, Houard X. Why subchondral bone in osteoarthritis? The importance of the cartilage bone interface in osteoarthritis. Osteoporos Int, 2012, 23(Suppl 8): S841-S846.
[3] Mow VC, Holmes MH, Lai WM. Fluid transport and mechanical properties of articular cartilage: a review. J Biomech, 1984, 17(5): 377-394.
[4] Hoemann CD, Lafantaisie-Favreau CH, Lascau-Coman V, et al. The cartilage-bone interface. J Knee Surg, 2012, 25(2): 85-97.
[5] Mente PL, Lewis JL. Elastic modulus of calcified cartilage is an order of magnitude less than that of subchondral bone. J Orthop Res, 1994, 12(5): 637-647.
[6] Hardingham T, Bayliss M. Proteoglycans of articular cartilage: changes in aging and in joint disease. Semin Arthritis Rheum,1990, 20(3 Suppl 1): 12-33.
[7] 郭智萍, 赵建, 李石玲. 类风湿性关节炎的MRI表现与早期诊断. 中国医学影像学杂志, 2006, 14(5): 377-379.
[8] Kahlenberg JM, Fox DA. Advances in the medical treatment of rheumatoid arthritis. Hand Clin, 2011, 27(1): 11-20.
[9] Sonomoto K, Yamaoka K, Tanaka Y. An approach to bone and cartilage repair of rheumatoid arthritis by mesenchymal stem cells. J UOEH, 2014, 36(2): 141-146.
[10] Djouad F, Bouffi C, Ghannam S, et al. Mesenchymal stem cells: innovative therapeutic tools for rheumatic diseases. Nat Rev Rheumatol, 2009, 5(7): 392-399.
[11] Seidi A, Ramalingam M, Elloumi-Hannachi I, et al. Gradient biomaterials for soft-to-hard interface tissue engineering. Acta Biomater, 2011, 7(4): 1441-1451.
[12] Allan KS, Pilliar RM, Wang J, et al. Formation of biphasic constructs containing cartilage with a calcified zone interface. Tissue Eng, 2007, 13(1): 167-177.
[13] Marquass B, Somerson JS, Hepp P, et al. A novel MSC-seeded triphasic construct for the repair of osteochondral defects. J Orthop Res, 2010, 28(12): 1586-1599.
[14] Mouthuy PA, El-Sherbini Y, Cui Z, et al. Layering PLGA-based electrospun membranes and cell sheets for engineering cartilagebone transition. J Tissue Eng Regen Med, 2016, 10(4): E263-E274.
[15] Welling MM, Duijvestein M, Signore A, et al. In vivo biodistribution of stem cells using molecular nuclear medicine imaging. J Cell Physiol, 2011, 226(6): 1444-1452.
[16] Chen K, Shi P, Teh TK, et al. In vitro generation of a multilayered osteochondral construct with an osteochondral interface using rabbit bone marrow stromal cells and a silk peptide-based scaffold. J Tissue Eng Regen Med, 2016, 10(4): 284-293.
[17] Lane LB, Bullough PG. Age-related changes in the thickness of the calcified zone and the number of tidemarks in adult human articular cartilage. J Bone Joint Surg Br, 1980, 62(3): 372-375.
[18] Lories RJ, Luyten FP. The bone-cartilage unit in osteoarthritis. Nat Rev Rheumatol, 2011, 7(1): 43-49.
[19] Wang F, Ying Z, Duan X, et al. Histomorphometric analysis of adult articular calcified cartilage zone. J Struct Biol, 2009, 168(3): 359-365.
[20] Xu QR, Dong YH, Chen SL, et al. Degeneration of normal articular cartilage induced by late phase osteoarthritic synovial fluid in beagle dogs. Tissue Cell, 2009, 41(1): 13-22.
[21] Zschäbitz A. Selective destruction of the calcified zone in a patient with seronegative rheumatoid arthritis. J Rheumatol, 1988, 15(6): 1009-1011.
[22] Chang Y, Park JW, Sung S, et al. Volume-normalized transfer constant as an imaging biomarker for chronic inflammatory arthritis: a dynamic contrast enhanced MRI study. Magn Reson Med, 2016, 76(3): 926-934.
[23] Zhou R, Idiyatullin D, Moeller S, et al. SWIFT detection of SPIO-labeled stem cells grafted in the myocardium. Magn Reson in Med,2010, 63(5): 1154-1161.
[24] Cunningham CH, Arai T, Yang PC, et al. Positive contrast magnetic resonance imaging of cells labeled with magnetic nanoparticles. Magn Reson Med, 2005, 53(5): 999-1005.
[25] Sheth V, Shao H, Chen J, et al. Magnetic resonance imaging of myelin using ultrashort Echo time (UTE) pulse sequences: phantom, specimen, volunteer and multiple sclerosis patient studies. Neuroimage, 2016, 136: 37-44.
[26] Zhang Z, Hancock B, Leen S, et al. Compatibility of superparamagnetic iron oxide nanoparticle labeling for ¹H MRI cell tracking with ³¹P MRS for bioenergetic measurements. NMR Biomed, 2010, 23(10): 1166-1172.
[27] Du J, Chiang AJ, Chung CB, et al. Orientational analysis of the Achilles tendon and enthesis using an ultrashort echo time spectroscopic imaging sequence. Magn Reson Imaging, 2010,28(2): 178-184.
[28] 陈民, 袁慧书. 超短回波时间磁共振(UTE-MRI)在骨皮质成像中的应用. 磁共振成像, 2016, 7(2): 156-160.
[29] 高嵩, 杜江, 包尚联. 超短回波磁共振成像与骨质量检测. 中国医学物理学杂志, 2013, 30(2): 4004-4007.
[30] Brossmann J, Frank LR, Pauly JM, et al. Short echo time projection Reconstruction MR imaging of cartilage: comparison with fatsuppressed spoiled GRASS and magnetization transfer contrast MR imaging. Radiology, 1997, 203(2): 501-507.
[31] Du J, Bydder M, Takahashi AM, et al. Two-dimensional ultrashort echo time imaging using a spiral trajectory. Magn Reson Imaging,2008, 26(3): 304-312.
[32] Pauli C, Bae WC, Lee M, et al. Ultrashort -echo time MR imaging of the patella with bicomponent analysis: correlation with histopathologic and polarized light microscopic findings. Radiology, 2012, 264(2): 484-493.
[33] Williams A, Qian Y, Bear D, et al. Assessing degeneration of human articular cartilage with ultra-short echo time (UTE) T2* mapping. Osteoarthritis Cartilage, 2010, 18(4): 539-546.
[34] Du J, Carl M, Bae WC, et al. Dual inversion recovery ultrashort echo time (DIR-UTE) imaging and quantification of the zone of calcified cartilage (ZCC). Osteoarthritis Cartilage, 2013, 21(1): 77-85.
[35] Gold GE, Thedens DR, Pauly JM, et al. MR imaging of articular cartilage of the knee: new methods using ultrashort TEs. AJR Am J Roentgenol, 1998, 170(5): 1223-1226.
[36] Eliav U, Komlosh ME, Basser PJ, et al. Collagen composition and content-dependent contrast in porcine annulus fibrosus achieved by using double quantum and magnetization transfer filtered UTE MRI. Magn Reson Med, 2014, 71(1): 388-393.
[37] Williams A, Qian Y, Chu CR. UTE-T2* mapping of human articular cartilage in vivo: a repeatability assessment. Osteoarthritis Cartilage, 2011, 19(1): 84-88.
[38] Chang EY, Du J, Chung CB. UTE imaging in the musculoskeletal system. J Magn Reson Imaging, 2015, 41(4): 870-883.
R593.22;R445.2
10.3969/j.issn.1005-5185.2016.09.019
2016-04-08
2016-07-24
(本文编辑张春辉)
国家自然科学基金项目(81471810,81501463);广东省公益研究与能力建设科技项目(2014A 411308138 117,2014A020211018);广东省自然科学基金项目(2014A030310360);广东省创新科研团队项目(2011S013)。
1.南方医科大学第三附属医院,广东省骨科研究院医学影像科广东广州510630;2.中国科学院深圳先进技术研究院生物医学与健康工程研究所广东深圳518055
李绍林 E-mail: 18926191928@189.cn
