前列腺癌Ktrans值与肿瘤Gleason评分的相关性:Meta分析
2016-11-29GAOPeng赵莲萍ZHAOLianping史长征SHIChangzheng罗良平LUOLiangping
高 鹏 GAO Peng赵莲萍 ZHAO Lianping史长征 SHI Changzheng罗良平 LUO Liangping
前列腺癌Ktrans值与肿瘤Gleason评分的相关性:Meta分析
高鹏GAO Peng赵莲萍ZHAO Lianping史长征SHI Changzheng罗良平LUO Liangping
作者单位
暨南大学附属第一医院影像中心广东广州510630
目的 运用Meta分析综合评价前列腺癌磁共振动态增强扫描(DCE-MRI)定量参数Ktrans值与肿瘤Gleason评分的相关性,探讨Ktrans值是否可以用于无创性地预测肿瘤的恶性程度及预后。资料与方法 检索PubMed、Medline、Cochrane图书馆、中国知网、万方数据库收录的2000年1月—2015年11月公开发表的关于前列腺癌DCE-MRI定量参数Ktrans值及Gleason评分之间的相关性的中英文文献,提取文献中的相关系数r值,对纳入文献的r值进行分析。结果 共10篇文献符合纳入标准,其中英文4篇,中文6篇,样本量共464例。Meta分析结果显示,通过合并Spearman相关系数rs值进行分析,Ktrans值与Gleason评分呈弱正相关(r=0.29,P<0.001,95% CI 0.19~0.37)。结论 前列腺癌Ktrans值可以为临床穿刺活检提供一定的影像学依据,但是否可以成为无创性预测肿瘤恶性程度及预后的可靠指标,其可行性及准确性需要更多的研究验证。
前列腺肿瘤;磁共振成像;图像增强;Meta分析
前列腺癌是除皮肤癌以外男性最常见的恶性肿瘤,也是最常见的生殖系统肿瘤,是目前世界范围内主要面临的公共健康问题[1]。近年,随着我国人口老龄化进程加剧,前列腺癌的发病率及病死率不断增加。因此,前列腺癌的早期检出和定位对其治疗及预后有重要意义。目前MRI已成为诊断前列腺疾病的最佳影像学检查方法,但由于前列腺常伴有炎症、出血、钙化等,导致肿瘤组织及正常腺体信号混杂,给前列腺癌的诊断增加了困难。在病理学上,肿瘤组织的新生微血管密度增加,血流灌注增多。磁共振动态增强扫描(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)通过药物动力学模型计算的定量参数包括容量转移常数(Ktrans)、速率常数(Kep)、血管外细胞外容积分数(Ve),可用于评估组织和肿瘤血管的生理学特性,可为肿瘤的检出、定位、治疗及判断预后提供更多有价值的信息。
既往研究中,DCE-MRI评价Ktrans与肿瘤Gleason评分的相关性结论不一致,缺乏对此类研究的系统评价。本研究采用Meta分析对国内外相关文献进行汇总分析,以循证医学为基础,探讨前列腺癌Ktrans值与肿瘤Gleason评分的相关性,并得出较为客观的结论,以探讨Ktrans值是否可以成为无创性地评估前列腺癌侵袭性及预测其病理学Gleason评分的可靠指标。
1 资料与方法
1.1文献检索 检索2000年1月—2015年11月PubMed、Medline、Cochrane图书馆、中国知网、万方数据库中公开发表的关于DCE-MRI定量参数Ktrans值及肿瘤Gleason分级的中英文文献。英文检索词为“prostate cancer”“DCE”“magnetic resonance imaging”“Ktrans”“Gleason score”,中文检索词为“前列腺癌”“磁共振成像”“Ktrans值”“Gleason分级”,分别由2名工作人员独立阅读文献,通过阅读摘要进行初步筛选,意见不一致时讨论后达成统一意见;阅读全文,对初步检索所得文献的相关参考文献进行二次检索,获取符合纳入标准的文献。
1.2文献纳入及排除标准 纳入标准:①受试者在行MRI检查前未接受过放疗、内分泌治疗、手术治疗、直肠指检及穿刺活检等;②磁场强度为1.5T或3.0T;③可以直接获得Pearson相关系数或Spearman相关系数;④所有受试者均行病理活检作为诊断“金标准”;⑤纳入样本量≥15例。排除标准:①综述、信件、评论及会议摘要等非研究性文献;②受试者为模型或动物;③无法直接获得Pearson相关系数或Spearman相关系数;④纳入样本量<15例。
1.3文献质量评价 采用诊断试验工具QUADAS(quality assessment of diagnostic accuracy studies)评价文献质量及发生偏倚的可能性,对每个项目按“是(Y)”“否(N)”“不清楚(U)”3个等级加以判断;由2名研究人员分别独立提取资料并评估文献质量,意见不一致时经协商达成一致意见。
1.4资料提取 ①基本资料包括作者、发表年、研究样本数、磁共振磁场强度、病理采集方式等;②研究对象Pearson相关系数r值或Spearman相关系数rs值。
1.5统计学方法 对提取的资料信息先转换为统一参数,再用Review Manager 5.3软件进行Meta分析;本研究中纳入的相关系数包括Spearman相关系数及Pearson相关系数,由于Spearman相关系数已经过对数转换处理,故其不适合再进行对数转换。因此,将纳入文献中的Pearson相关系数r值转换成Spearman相关系数rs值[2],见公式(1)。

其中,rs表示Spearman相关系数,r表示Pearson相关系数。
Spearman相关系数用作Meta分析转换方法见公式(2)~(5)。

首先采用公式(2)~(4)将各研究相关系数r值换算出Fisher Z值和标准误SE,并输入Review Manager 5.3软件采用倒方差法[3]得出综合效应Fisher Z值,再通过反Fisher转换,利用公式(5)换算综合相关系数r值。根据χ2检验和I2检验确定是否有研究间异质性,若P≥0.1、I2<50%,则研究存在同质性,采用固定效应模型;若P<0.1、I2≥50%,则选用随机效应模型。采用漏斗图观察发表性偏倚。最后用综合相关系数r值评价DCE-MRI定量参数Ktrans值与Gleason评分之间的相关性。
2 结果
2.1纳入文献的基本资料与质量评价 初步检索得到英文文献72篇,中文文献147篇,根据纳入及排除标准,最终纳入10篇文献,其中4篇英文文献[4-7],6篇中文文献[8-13],样本量共464例。纳入文献的基本特征见表1,质量评价见表2。
2.2Meta分析结果 对纳入研究中直接或间接得到的Spearman相关系数rs值进行合并相关系数分析。χ2检验表明研究具有同质性(I2=45%,P=0.06),采用固定效应模型进行分析。综合Fisher Z值有统计学意义,综合效应值为0.30(95% CI 0.20~0.39),通过公式(5)转换得到综合相关系数r=0.29(P<0.001,95% CI 0.19~0.37),表明Ktrans值与肿瘤Gleason评分呈弱正相关,经过敏感性分析将纳入研究逐个排除后,对剩余研究进行Meta分析,综合Fisher Z值及95% CI均有统计学意义,结果无明显改变,综合相关系数r值为0.27~0.35,表明该研究结果稳定(图1)。
2.3发表性偏倚分析 根据漏斗图(图2)显示大部分研究处于“倒漏斗”的上部,且基本呈大致对称分布,表明纳入的研究无明显发表偏倚。
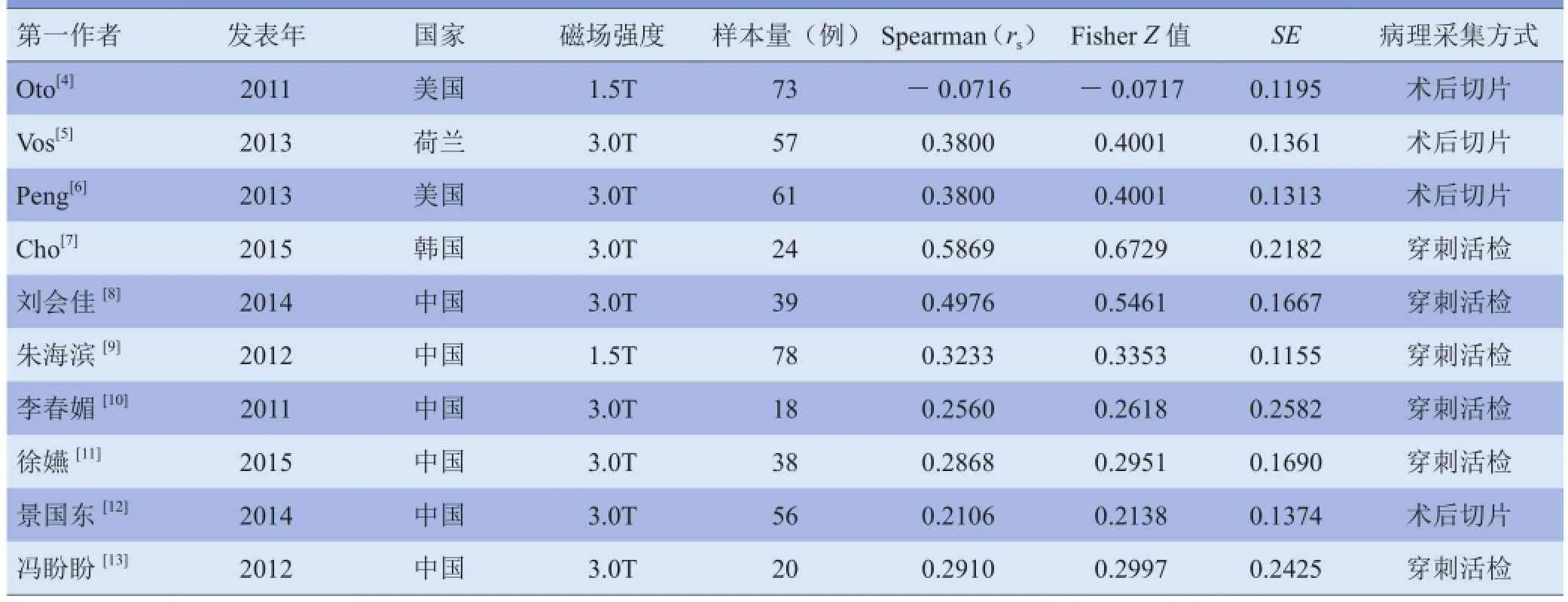
表1 纳入10篇文献的基本特征
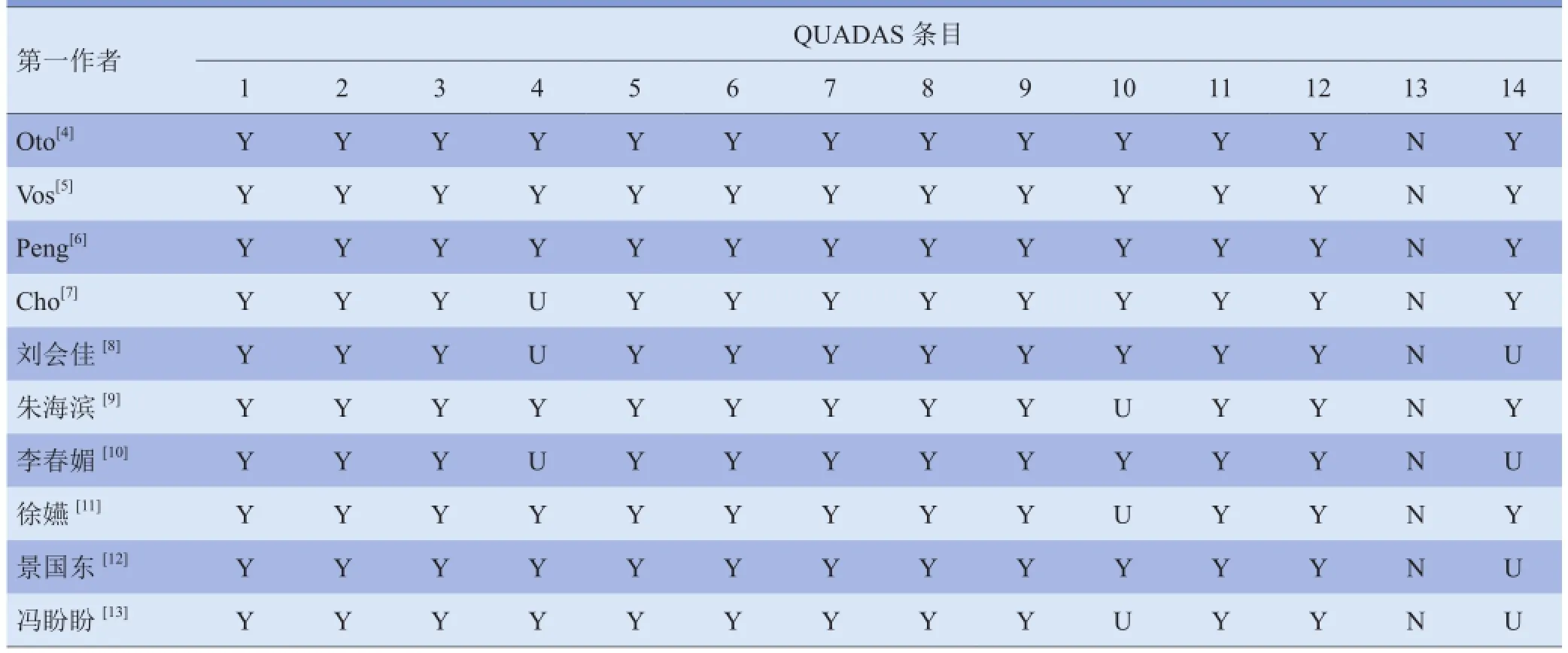
表2 纳入10篇文献的QUADAS条目评价
3 讨论
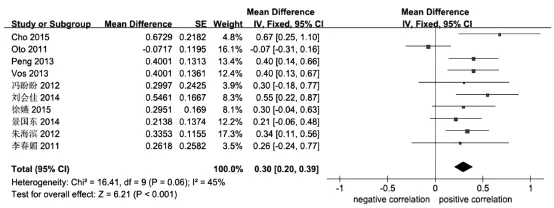
图1 汇总相关系数r值的Meta分析森林图
前列腺癌容易侵犯周围组织并发生广泛转移,对于侵袭性强的肿瘤常需要行根治性切除术,故预测肿瘤的侵袭性对于指导临床治疗及预后具有重要价值。Gleason分级系统是根据肿瘤腺体分化程度、结构变异及肿瘤侵袭方式作为分级标准,是前列腺癌患者制订治疗方案和评价预后的最有意义的指标[14]。前列腺癌的生物学行为包括肿瘤浸润、淋巴结转移、远处转移等,均与Gleason评分密切相关。Gleason分级分为5个等级,1级表示肿瘤组织结构分化最好,预后较好;5级表示肿瘤组织结构分化最差,预后最差。由于前列腺癌不同区域腺癌结构的变异,按其主要和次要分化程度分别评分,Gleason评分为2项评分相加的总分作为判断预后的标准。
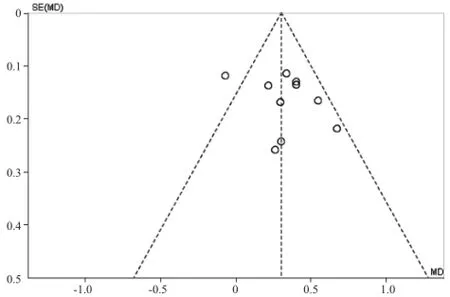
图2 纳入文献发表偏倚
DCE-MRI通过检测前列腺组织的血流动力学改变,获得肿瘤组织微血管密度及血管通透性的定量指标进行分析,不但可以评价肿瘤的生理特性,同时可以实现对前列腺癌侵袭性的无创性预测及评价预后。Tofts等[15]建立的药代动力学双室模型目前被广泛应用,主要描述了对比剂在血浆和组织间隙之间交换的动力学过程。DCE-MRI通过Tofts药代动力学“双室”模型计算的Ktrans、Kep、Ve值能定量反映肿瘤血管的生理学特性。Ktrans代表单位时间内对比剂从血浆泄漏到组织间隙的转运容积,反映对比剂分子通过血管壁的能力大小;Kep代表单位时间内对比剂从组织间隙进入血管的量;Ve代表单位体积组织血管外细胞外间隙体。前列腺癌的生长、侵袭及转移过程中均依赖于肿瘤内及肿瘤周围的新生微血管生成[16-17]。由于肿瘤组织代谢旺盛,微血管生成快速,但新血管内皮细胞的间隙大于正常血管内皮细胞,因此新血管的通透性高于正常血管[18]。在前列腺癌中有许多新的微血管,低分化和高恶性程度的肿瘤组织生成更多的微血管,组织灌注和毛细血管通透性较高。前列腺癌平均微血管密度及血管通透性与肿瘤Gleason评分、临床分期、复发、转移、预后密切相关[19]。目前国内外文献中对DCE-MRI定量指标与肿瘤Gleason评分相关性的研究多集中在Ktrans值,其余2个参数关注相对较少。既往研究表明,前列腺癌Gleason评分越高的区域,相应区域Ktrans值也越高,肿瘤恶性程度越高,其肿瘤侵袭性程度越明显[5-9]。但另外一些研究得出相反的结论,认为前列腺癌的Ktrans值与Gleason评分之间无明显相关性[4,10-13],目前尚无统一结论。
本研究最终纳入10篇文献,对合并Spearman相关系数r值进行分析,提示Ktrans值与Gleason评分呈弱正相关,随着前列腺癌Gleason评分升高,前列腺癌DCE-MRI定量参数Ktrans值也随之升高,提示Ktrans值可以为临床治疗决策提供有力的影像学依据。另外,由于前列腺癌不同区域腺癌结构的变异,可以利用Ktrans值指导穿刺,以提高穿刺阳性率及Gleason分级的准确性。目前仅有极少数研究对Ktrans值鉴别良恶性病变的界值进行了探讨,其中Cho等[7]的研究结果显示,Ktrans值与Gleason评分呈中度相关,Ktrans值诊断良恶性病变的界值为0.184/min;而Peng等[6]的研究中Ktrans值诊断良恶性病变的界值高于Cho等[7]的研究结果,为0.257/min。目前对于DCE-MRI定量参数诊断界值的研究尚处于探索阶段,并未得出统一结论,需要大样本的前瞻性研究进行验证。
目前,Gleason分级系统是最常用的评价前列腺癌生物学侵袭性的病理学标准。经直肠超声引导下前列腺活检术已成为诊断前列腺癌的常用方法,也可以用于组织病理学检查和Gleason分级,但其为有创性检查,可能导致感染、脓毒血症等并发症。因此,利用其对肿瘤进行Gleason分级仍然存在一定的局限性。前列腺癌DCE-MRI定量参数Ktrans值与Gleason评分呈弱正相关,为预测肿瘤恶性程度及预后提供有价值的信息,但存在局限性,尚不能完全取代穿刺活检术,其原因为:①目前各研究中心采用不同的后处理软件及不同药代动力学模型,导致结果存在差异;使用不同模型的结果有所不同,也是造成差异的关键因素[20]。②DCE-MRI因不同的磁场强度及采集数据方式,获得图像的分辨率及信噪比不一致。③不同Gleason评分组间的Ktrans值存在重叠效应,需更多大样本、高质量且经病理检查证实的临床对照研究支持。④大部分研究依据穿刺活检标本取得结果,尚缺少根治术后大体标本、大切片与影像图像的对照,而穿刺活检标本存在取样误差,使得与根治术大切片病理结果的Gleason评分存在一定的偏差,从而会导致病理结果的假阴性或假阳性。
总之,前列腺癌DCE-MRI定量参数Ktrans值与肿瘤Gleason分级之间存在一定的相关性,可以为临床穿刺活检提供一定的影像学依据,但能否替代穿刺活检,并成为无创性预测肿瘤恶性程度及预后的可靠指标,其可行性及准确性需要更多的研究验证。
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA Cancer J Clin, 2014, 64(1): 9-29.
[2] Rupinski MT, Dunlap WP. Approximating pearson productmoment correlations from kendall's tau and spearman. s rho. Educational&Psychological Measurement, 1996, 56(3): 419.
[3] Tsiligianni I, Kocks J, Tzanakis N, et al. Factors that influence disease-specific quality of life or health status in patients with COPD: a review and meta-analysis of Pearson correlations. Prim Care Respir J, 2011, 20(3): 257-268.
[4] Oto A, Yang C, Kayhan A, et al. Diffusion-weighted and dynamic contrast-enhanced MRI of prostate cancer: correlation of quantitative MR parameters with Gleason score and tumor angiogenesis. Am J Roentgenol, 2011, 197(6): 1382-1390.
[5] Vos EK, Litjens GJ, Kobus T, et al. Assessment of prostate cancer aggressiveness using dynamic contrast-enhanced magnetic resonance imaging at 3 T. Eur Urol, 2013, 64(3): 448-455.
[6] Peng Y, Jiang Y, Yang C, et al. Quantitative analysis of multiparametric prostate MR images: differentiation between prostate cancer and normal tissue and correlation with Gleason score--a computer-aided diagnosis development study. Radiology,2013, 267(3): 787-796.
[7] Cho E, Chung DJ, Yeo DM, et al. Optimal cut-off value of perfusion parameters for diagnosing prostate cancer and for assessing aggressiveness associated with Gleason score. Clin Imaging, 2015, 39(5): 834-840.
[8] 刘会佳, 赵娓娓, 任芳, 等. 3.0 T动态增强磁共振对前列腺癌的定量分析研究. 放射学实践, 2014, 29(5): 477-481.
[9] 朱海滨, 刘婧, 蔡文超, 等. 前列腺癌MRI动态增强定量参数Ktrans值与Gleason评分的相关性研究. 中国医学影像学杂志, 2012, 20(7): 481-484.
[10] 李春媚, 陈敏, 李飒英, 等. 3.0 T MR动态增强扫描定量分析诊断前列腺癌的初步研究. 中华放射学杂志, 2011, 45(1): 50-54.
[11] 徐嬿, 冷晓明, 郑芸, 等. 3.0 T DCE-MRI定量分析在前列腺癌与增生鉴别诊断中的应用价值. 磁共振成像, 2015,6(8): 608-612.
[12] 景国东, 汪剑, 陈录广, 等. 3.0 T动态增强MRI在前列腺癌诊断中的价值. 放射学实践, 2014, 29(5): 482-486.
[13] 冯盼盼. 前列腺病变3.0 T MRI及血管通透性成像的应用研究. 广州: 南方医科大学, 2012.
[14] Buhmeida A, Pyrhönen S, Laato M, et al. Prognostic factors in prostate cancer. Diagn Pathol, 2006, 1(1): 4.
[15] Tofts PS, Brix G, Buckley DL, et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging, 1999, 10(3): 223-232.
[16] Folkman J. Seminars in Medicine of the Beth Israel Hospital,Boston. Clinical applications of research on angiogenesis. N Engl J Med, 1995, 333(26): 1757-1763.
[17] Fox SB. Tumour angiogenesis and prognosis. Histopathology,1997, 30(3): 294-301.
[18] Kozlowski P, Chang SD, Meng R, et al. Combined prostate diffusion tensor imaging and dynamic contrast enhanced MRI at 3T-quantitative correlation with biopsy. Magn Reson Imaging, 2010, 28(5): 621-628.
[19] Bigler SA, Deering RE, Brawer MK. Comparison of microscopic vascularity in benign and malignant prostate tissue. Hum Pathol, 1993, 24(2): 220-226.
[20] Lowry M, Zelhof B, Liney GP, et al. Analysis of prostate DCEMRI: comparison of fast exchange limit and fast exchange regimen pharmacokinetic models in the discrimination of malignant from normal tissue. Invest Radiol, 2009, 44(9): 577-584.
(本文编辑张春辉)
Correlation of KtransValue with Gleason Score in Prostate Cancer: A Meta-analysis
Purpose Using meta-analysis to explore the association between Ktransvalue,a quantitative parameter of dynamic contrast-enhanced magnetic resonance imaging (DCEMRI) of prostate cancer, and Gleason score, and to explore whether Ktransvalue can be a non-invasive indicator to predict the degree and prognosis. Materials and Methods PubMed, Medline, Cochrane library, CNKI and Wanfang database were searched for studies discussing the correlation between the quantitative parameter Ktransvalue of DCEMRI and Gleason score in prostate cancer. Only studies published in English or Chinese from January 2000 to November 2015 were included. Correlation coefficient r values were extracted from each study. Results A total of 10 articles met the inclusion criteria, of which 4 were in English and 6 were in Chinese. There were a total of 464 lesions. Metaanalysis with Spearman correlation rs evaluation showed that the Ktransvalue was slightly positively correlated with the Gleason score (r=0.29, P<0.001, 95% CI 0.19-0.37). Conclusion Ktransvalue in prostate cancer can provide imaging evidence for biopsy. The feasibility and accuracy of using Ktransas an indicator of the degree of malignancy and prognosis require further research verification.
Prostatic neoplasms; Magnetic resonance imaging; Image enhancement;Meta-analysis
10.3969/j.issn.1005-5185.2016.09.017
罗良平
Department of Medical Imaging, the First Affiliated Hospital of Jinan University,Guangzhou510630, China
Address Correspondence to: LUO Liangping E-mail: tluolp@jnu.edu.cn
R737.25;R730.42
2016-04-03
2016-07-16
中国医学影像学杂志
2016年 第24卷 第9期:696-700
Chinese Journal of Medical Imaging 2016 Volume 24 (9): 696-700
