磁共振动态增强及扩散加权成像对前列腺癌灶诊断价值的Meta分析
2016-11-29宋惠贞SONGHuizhen尹YINXi张ZHANGLin
宋惠贞 SONG Huizhen尹 喜 YIN Xi张 林 ZHANG Lin
磁共振动态增强及扩散加权成像对前列腺癌灶诊断价值的Meta分析
宋惠贞SONG Huizhen尹喜YIN Xi张林ZHANG Lin
作者单位
石河子大学医学院第一附属医院MR室新疆石河子832000
目的 采用Meta分析系统性地比较磁共振动态增强(DCE-MRI)、扩散加权成像(DWI)及两者联合应用对前列腺癌灶的诊断价值。资料与方法 以“前列腺癌、扩散加权成像、DWI、动态增强、DCE-MRI、prostate、cancer、dynamic contrast enhanced、diffusion weighted imaging”为检索词,检索2005年1月—2015年12月中国知网、万方数据库、PubMed及Springer Link中收录的关于DCE-MRI和DWI对前列腺癌灶诊断价值的文献。对符合要求的文献进行质量评价和异质性检验,汇总合并敏感度和特异度,并进行汇总受试者工作特征曲线分析。结果 共纳入7篇文献,均为英文文献,共包括447例患者,以4561个感兴趣区作为研究对象。DCE、DWI及两者联合诊断的合并敏感度分别为0.36(95% CI 0.31~0.57)、0.61(95% CI 0.57~0.65)、0.73(95% CI 0.68~0.77),合并特异度分别为0.89(95% CI 0.90~0.98)、0.89(95% CI 0.88~0.90)、0.81(95% CI 0.78~0.83),汇总受试者工作特征曲线下面积分别为0.7536、0.8402、0.8425。结论 DWI诊断前列腺癌灶的准确性优于DCE,两者联合诊断效果更好。
前列腺肿瘤;磁共振成像;扩散加权成像;图像增强;Meta分析
前列腺癌是老年男性常见的恶性肿瘤,其死亡率呈逐年升高趋势。MRI对前列腺癌的检出、定位及分期具有独特优势,是目前最佳的影像学诊断方法。传统T2WI对前列腺癌检出的敏感度和特异度较低[1]。近年许多学者采用扩散加权成像(DWI)、磁共振动态增强(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)扫描对前列腺癌的诊断价值进行了研究,本研究采用Meta分析对DCE-MRI、DWI及两者联合诊断前列腺癌灶进行系统性比较,为前列腺癌灶诊断的序列选择提供更加有力的证据。
1 资料与方法
1.1文献检索 以“前列腺癌、扩散加权成像、DWI、动态增强、DCE-MRI、prostate、cancer、dynamic contrast enhanced、diffusion weighted imaging”为检索词,检索中国知网、万方数据库、PubMed及Springer Link。收集DCE-MRI和DWI对前列腺癌灶诊断价值的文献,检索时间为2005年1月—2015年12月。为尽量避免漏查文献,采用手工检索和网络检索相结合的方式,对纳入文献的参考文献均进行二次检索。
1.2文献纳入与排除标准 纳入标准:①研究类型,均采用DCE及DWI诊断前列腺癌,诊断试验以超声引导下穿刺活检或前列腺癌切除术后病理结果作为“金标准”,为回顾性研究或前瞻性研究;②研究对象,来自临床疑似前列腺癌患者的前列腺组织的单个感兴趣区(ROI);③研究结果,均能获得诊断试验的四格表数据;④文献语种为中文和英文。排除标准:①文摘、综述、述评或个案报道类文献;②数据重复发表;③DCEMRI及DWI研究的对象不是同一组病例;④诊断过程中前列腺组织ROI的放置参照T2WI图像上的异常信号或病理结果提示。
1.3文献资料提取 由1名影像学主治医师及1名泌尿科主治医师独立检索,并按照预先制订的纳入标准和排除标准筛选文献、进行资料提取,意见不一致时讨论确定。提取内容包括作者、发表时间、患者年龄、样本量、仪器设备、线圈类型、b值、诊断“金标准”、DCE及DWI的诊断方法。
1.4文献质量评价 按照Cochrane协作网推荐的QUADAS(quality assessment of diagnostic accuracy studies)作为诊断性试验的质量评价工具[2],评价诊断性文献质量。
1.5统计学方法 采用Meta-Disc 1.4及STATA软件,首先通过Egger法检测文献发表偏倚,同时采用χ2检验对各研究诊断比值比进行异质性分析,I2<50%、P>0.05则无异质性,采用固定效应模型进行分析;I2≥50%、P<0.05则存在异质性,采用随机效应模型进行分析。其中分析异质性来源,包括阈值效应和非阈值效应。随后对全部纳入研究进行Meta分析,计算合并敏感度、特异度和汇总受试者工作特征(ROC)曲线下面积,所有结果均用95% CI表示,P<0.05表示差异有统计学意义。
2 结果
2.1文献检索结果按照检索词初步检索文献414篇,排除未达到纳入标准的文献(图1),共纳入7篇文献进入Meta分析,其基本特征见表1。纳入的7篇文献包含同时应用DCE和DWI诊断前列腺癌,其中仅3篇文献除对比单独使用DCE和DWI诊断技术外,还对比了两者联合应用对前列腺癌灶的诊断价值。
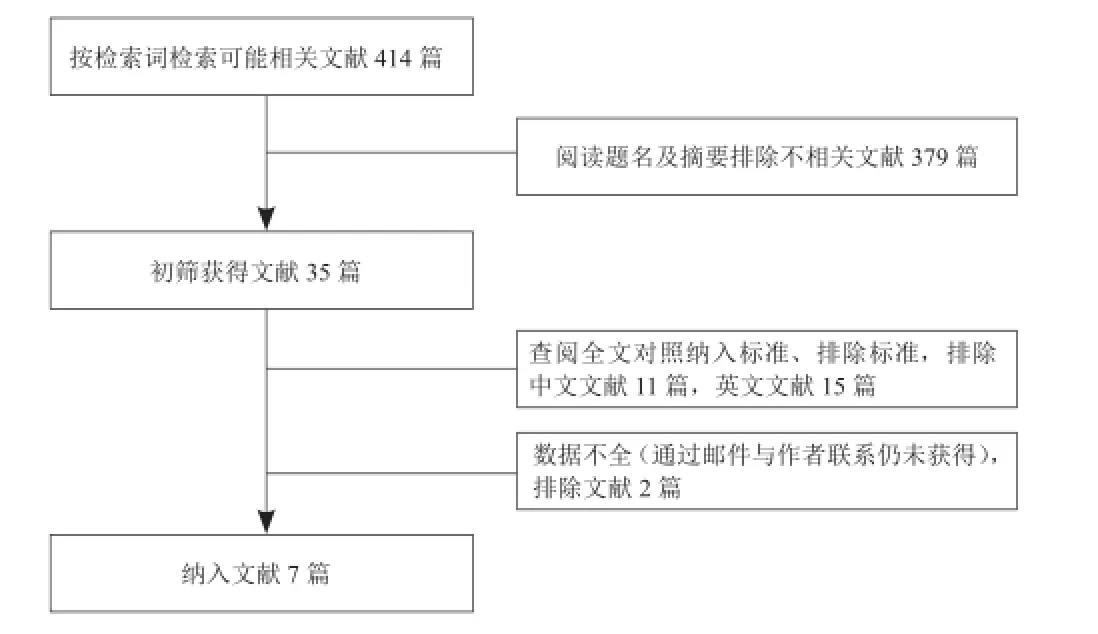
图1 纳入文献筛选流程
2.2发表偏倚检验结果经Egger检验,以0.05为检验水准,P=0.072,表明纳入文献未发现发表偏倚。
2.3纳入文献的基本特征及质量评价纳入的7篇文献[3-9]共包含447例患者,4561个ROI,其中癌灶1068例,并均经病理证实。纳入文献的基本特征见表1,方法学质量评价见表2:其中5篇文献[3-4,6,8-9]评为13分,2篇文献[5,7]评为12分。
2.4Meta分析结果
2.4.1异质性检验通过诊断比值比分析异质性,DCE诊断组I2=57.5%,P<0.05;DWI诊断组I2=14.1%,P>0.05;DCE+DWI诊断组I2=0.0%,P>0.05。结果表明只有DCE诊断组纳入文献存在较大异质性,采用随机效应模型,同时检测是否存在阈值效应,Spearman相关分析结果表明,敏感度与(1-特异度)呈高度正相关(r=0.893,P<0.05),均表明存在阈值效应;DWI及联合诊断组不存在异质性,采用固定效应模型。
2.4.2敏感性分析为观察合成结果的稳定程度,分别将不同诊断组纳入的数据逐一排除并重新汇总比值比,显示被排除后改变量不大,表明纳入文献的稳定性好,结果可信度高。
2.4.3亚组分析DCE诊断组的异质性较大,对可能影响异质性的因素(设备类型、线圈类型)进行亚组分析。①仅纳入以3.0T作为设备类型的文献时,无明显的异质性(I2=38.3%,P>0.05);②仅纳入以1.5T作为设备类型的文献时,仍存在较大异质性(I2=67.7%,P<0.05);③仅纳入线圈类型为直肠内线圈的文献时,无异质性(I2=0.0%,P>0.05);④仅纳入线圈类型为体部线圈的文献时,具有较明显的异质性(I2=70.0%,P<0.05)。
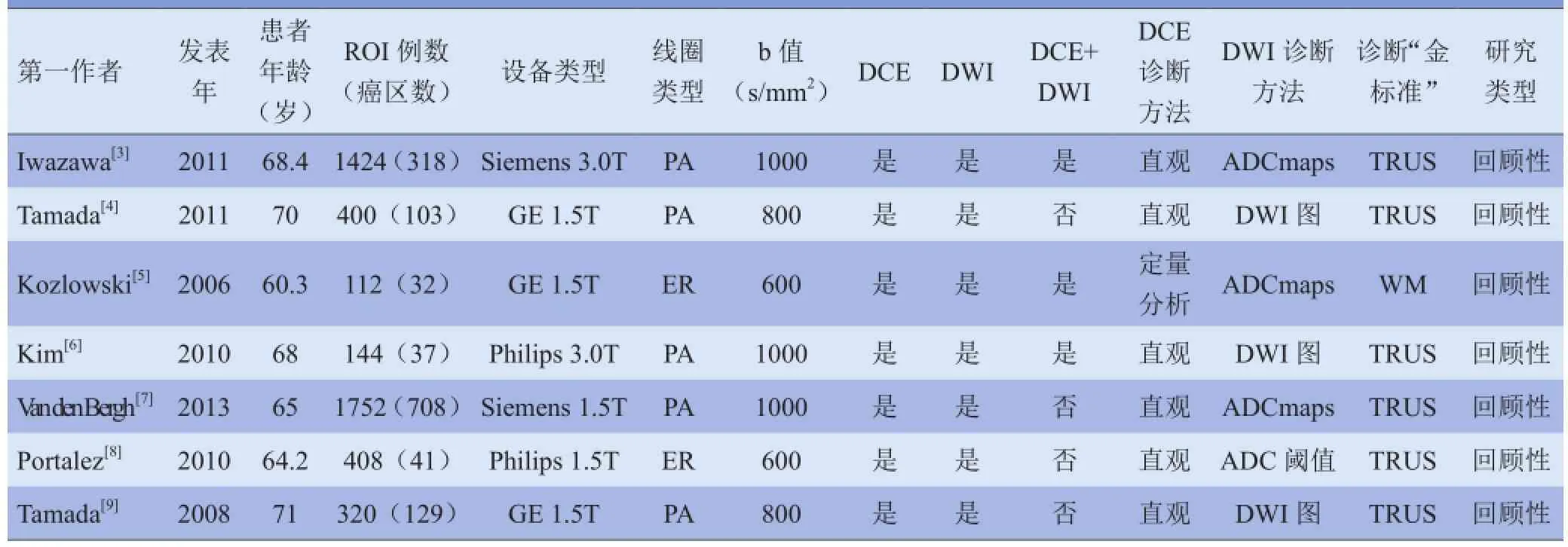
表1 纳入文献的基本特征

表2 纳入文献的QUADAS条目评价
2.5合并值计算及其对比结果
2.5.1合并值计算根据DCE诊断组采用随机效应模型,DWI诊断组及联合诊断组采用固定效应模型合并效应量,DCE、DWI及两者联合诊断的合并敏感度分别为0.36(95% CI 0.31~0.57)、0.61(95% CI 0.57~0.65)、0.73(95% CI 0.68~0.77);合并特异度分别为0.89(95% CI 0.90~0.98)、0.89(95% CI 0.88~0.90)、0.81(95% CI 0.78~0.83);汇总ROC曲线下面积(AUC)分别为0.7536、0.8402、0.8425。见图2。
2.5.23组合并值比较3组诊断技术敏感度差异有统计学意义(χ2=224.400,P<0.05),特异度差异有统计学意义(χ2=71.576,P<0.05);联合诊断组的诊断效果最好,其次为DWI诊断组,DCE诊断的准确性相对较差。

图2 DCE诊断组(A)、DWI诊断组(B)及DCE+DWI诊断组(C)的汇总ROC曲线
3 讨论
3.1诊断价值 DCE技术可直接反映组织血流灌注情况,由于肿瘤组织具有丰富的新生血管及高血管渗透性等生理特性,对比剂能快速并大量地进入肿瘤组织,呈现“快进快出”特性[10]。DWI是能在活体中评价水分子随机扩散运动的无创性检查技术,具有扫描时间短、无需复杂的后处理等优势。前列腺癌组织结构紧密紊乱,其肿瘤细胞核体积大,核-浆比例高,上述因素均使前列腺癌组织中水分子的扩散运动明显受限,表现为较低的ADC值及DWI图像上呈高信号。
本研究汇总分析结果表明,DCE的诊断敏感度较低,容易遗漏部分微小病灶。DCE与DWI联合应用的诊断敏感度最高,降低了前列腺癌灶的漏诊率,以便早期发现癌灶;3组诊断技术的特异度均较高;AUC是衡量某一诊断方法准确性的指标,AUC越接近1,诊断效果越好[11],本研究中3组技术的AUC均大于0.75,表明有较高的诊断准确性。总之,DWI、DCE联合DWI诊断前列腺癌灶均具有较高的准确性,其中联合诊断组的诊断效果最好;DCE的诊断准确性相对较差。
3.2文献异质性 目前DCE对前列腺癌灶诊断最大的局限性在于尚无统一的诊断方式来评估组织血流灌注情况[12]。常见的3种诊断方法为:①直观法,直接观察原始图像的ROI表现为“快进快出”为最简便的方式,但这种方法受诊断医师阅片能力的影响,若诊断医师工作经验不同,可对图像造成解读偏移。②半定量分析法,为了提高动态增强扫描诊断分析的客观性,半定量分析时间-信号强度曲线的特征正逐渐得到应用,常用的计量参数有起始强化时间、强化曲线的平均和初始上升梯度、最大信号强度等[13]。③定量分析法,以肿瘤组织微血管密度及组织血管通透性改变等为基础评价肿瘤的生理特性[14],常用的参数有容量转移常数(Ktrans)、血管外细胞外容积分数(Ve)及速率常数(Kep),但需进行复杂、费时的后处理工作才能获得上述定量参数[13]。
本研究对DCE-MRI诊断前列腺癌灶纳入的7篇文献进行Meta分析,结果发现异质性较大是由于存在阈值效应,推测其主要原因是由于诊断标准不统一,其中除大多研究采用直观法外,无量化的诊断标准,仅1篇研究[5]采用定量分析法,由于纳入文献数量有限,因而对前列腺癌灶的诊断效果不便做出准确的对比。此外,导致异质性较大的原因可能是纳入文献的设备类型、线圈类型的选择不同,对此进行亚组分析后,部分仅纳入3.0T MR设备或直肠线圈的研究异质性明显降低。
DWI诊断组共纳入7篇文献,I2=14.1%,不存在异质性,由于前列腺癌组织ADC值较低,其直接影响因素为b值的选择,对纳入文献进行回顾发现,均采用较高b值(600 s/mm2、800 s/mm2、1000 s/mm2),对异质性的影响不大。
3.3本研究的优势与不足 本研究纳入标准为DCE和DWI技术均来自同一组病例资料。此前有1篇相关的Meta分析[15]比较了DCE与DWI单独应用对前列腺癌灶的检出价值,以应用DWI诊断技术为纳入标准,但并非所有病例均采用了两种诊断技术,不利于严格比较两种诊断技术准确性的高低。另外,本研究针对的是DWI和DCE单独及联合诊断3组资料,在选择ROI时,将T2WI图像的异常信号区或病理结果告知的区域列为排除标准,保证了诊断过程的独立性。
本研究的局限性:①由于纳入文献数量较少,不能做回归分析、探讨异质性的来源;②本研究未纳入中文文献,其中大多数DCE或DWI诊断前列腺癌时,以T2WI图像或病理检查结果作为参考,未探讨DCE或DWI对前列腺癌的独立诊断价值;以及上述文献的研究对象是前列腺癌患者,而不是更加细化的癌灶。
[1] Gürses B, Tasdelen N, Yencilek F, et al. Diagnostic utility of DTI in prostate cancer. Eur J Radiol, 2011, 79(2): 172-176.
[2] Whiting P, Rutjes AW, Reitsma JB, et al. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol, 2003, 3(3): 25.
[3] Iwazawa J, Mitani T, Sassa S, et al. Prostate cancer detection with MRI: is dynamic contrast-enhanced imaging necessary in addition to diffusion-weighted imaging? Diagn Interv Radiol,2011, 17(3): 243-248.
[4] Tamada T, Sone T, Higashi H, et al. Prostate cancer detection in patients with total serum prostate-specific antigen levels of 4-10 ng/mL: diagnostic efficacy of diffusion-weighted imaging,dynamic contrast-enhanced MRI, and T2-weighted imaging. Am J Roentgenol, 2011, 197(3): 664-670.
[5] Kozlowski P, Chang SD, Jones EC, et al. Combined diffusionweightedand dynamic contrast-enhanced MRI for prostate cancer diagnosis--correlation with biopsy and histopathology. J Magn Reson Imaging, 2006, 24(1): 108-113.
[6] Kim CK, Park BK, Park W, et al. Prostate MR imaging at 3T using a phased-arrayed coil in predicting locally recurrent prostate cancer after radiation therapy: preliminary experience. Abdom Imaging, 2010, 35(2): 246-252.
[7] Van den Bergh L, Isebaert S, Koole M, et al. Does 11C-choline PET-CT contribute to multiparametric MRI for prostate cancer localisation? Strahlenther Onkol, 2013, 189(9): 789-795.
[8] Portalez D, Rollin G, Leandri P, et al. Prospective comparison of T2w-MRI and dynamic-contrast-enhanced MRI, 3D-MR spectroscopic imaging or diffusion-weighted MRI in repeat TRUS-guided biopsies. Eur Radiol, 2010, 20(12): 2781-2790.
[9] Tamada T, Sone T, Jo Y, et al. Prostate cancer: relationships between postbiopsy hemorrhage and tumor detectability at MR diagnosis. Radiology, 2008, 248(2): 531-539.
[10] 任逢春, 杨汉丰, 杜勇. 多参数磁共振成像在前列腺癌诊断中的应用. 中华腔镜泌尿外科杂志(电子版), 2013, 7(2): 148-151.
[11] 王建华. 流行病学. 第8版. 北京: 人民卫生出版社, 2014: 102-105.
[12] Tan CH, Hobbs BP, Wei W, et al. Dynamic contrast-enhanced MRI for the detection of prostate cancer: meta-analysis. Am J Roentgenol, 2015, 204(4): W439-W448.
[13] 刘会佳. 前列腺癌MR动态增强的研究进展. 实用放射学杂志, 2013, 29(8): 1347-1349.
[14] 朱海滨, 刘婧, 蔡文超, 等. 前列腺癌MRI动态增强定量参数Ktrans值与Gleason评分的相关性研究. 中国医学影像学杂志, 2012, 20(7): 481-484.
[15] Tan CH, Wei W, Johnson V, et al. Diffusion-weighted MRI in the detection of prostate cancer: meta-analysis. Am J Roentgenol, 2012, 199(4): 822-829.
(本文编辑张春辉)
Dynamic Contrast-enhanced Magnetic Resonance Imaging and Diffusion Weighted Imaging in Prostate Cancer Diagnosis: A Meta-analysis
Purpose To compare the diagnostic value of dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI), diffusion weighted imaging (DWI) and two techniques combined in prostate cancer using meta-analysis. Materials and Methods
Prostatic neoplasms; Magnetic resonance imaging; Diffusion weighted imaging; Image enhancement; Meta-analysis
10.3969/j.issn.1005-5185.2016.09.018
张林
Department of MR Room, the First Affiliated Hospital of the Medical College, Shihezi University, Shihezi832000, China
Address Correspondence to: ZHANG Lin E-mail: zl123ct@sina.com
R737.25;R730.42
2016-05-25
修回日期: 2016-06-27
中国医学影像学杂志
2016年 第24卷 第9期:701-705
Chinese Journal of Medical Imaging 2016 Volume 24 (9): 701-705
Using "prostate cancer" "diffusion weighted imaging" and "dynamic contrast enhanced" as key words, CNKI, Wanfang database, PubMed and Springer Link were searched from January 2005 to December 2015. Those included studies discussed the diagnostic value of DWI and DCE-MRI for prostate cancer lesions. The quality and heterogeneity of the articles were evaluated. Sensitivity and specificity were summarized to generate receiver operating characteristic curves. Results Seven studies were selected and all in English. A total of 4561 regions of interest in 447 patients were analyzed. The sensitivity for DCEMRI, DWI and two techniques combined were 0.36 (95% CI 0.31-0.57), 0.61 (95% CI 0.57-0.65), 0.73 (95% CI 0.68-0.77), respectively; with specificity of 0.89 (95% CI 0.90-0.98), 0.89 (95% CI 0.88-0.90), 0.81 (95% CI 0.78-0.83), respectively. The summary area under curve was 0.7536, 0.8402 and 0.8425, respectively. Conclusion DWI is superior to DCE-MRI in diagnosing prostate cancer. Combining two techniques can provide better diagnostic accuracy.
