脑胶质瘤石蜡包埋组织中微小RNA-184表达与临床病理特征的关系
2016-11-29陶静莉
李 萍 邓 飞 周 薇 陶静莉 王 艳
南方医科大学深圳医院病理科 深圳 518000
脑胶质瘤石蜡包埋组织中微小RNA-184表达与临床病理特征的关系
李 萍 邓 飞 周 薇 陶静莉 王 艳
南方医科大学深圳医院病理科 深圳 518000
目的 探究脑胶质瘤石蜡包埋组织中微小RNA-184表达与临床病理特征的关系,观察其对脑胶质瘤患者预后中的研究价值。方法 选取2007-05—2012-03在河北省人民医院就诊的76例胶质瘤患者和24例脑组织正常患者,对其采用实时定量PCR和微阵列芯片法(microarray chip)检测微小RNA-184表达,同时对胶质瘤患者的无病生存期及总生存期情况采用乘法极限估计法(Kaplan-Meier)进行分析。结果 胶质瘤患者石蜡包埋组织中微小RNA-184表达下降,采用实时定量PCR对其进一步验证。KPS评分、WHO分级、生存时间及复发时间与微小RNA-184的低表达显著相关。乘法极限估计法分析结果显示,微小RNA-184高表达患者的无病生存期和总生存期与微小RNA-184低表达患者比较,差异具有统计学意义(P<0.05)。多因素分析结果表明,微小RNA-184的表达差异是预测无病生存期和总生存期的独立危险因素。结论 胶质瘤患者预后和微小RNA-184的表达密切相关,在预测胶质瘤患者预后情况中微小RNA-184可作为独立的标志物。
微小RNA-184;胶质瘤;临床病理;实时定量PCR
脑胶质细胞瘤是原发性中枢神经系统肿瘤中最为常见的一种肿瘤,放化疗和手术对其均起不到理想效果,患者预后情况较差。目前,对于胶质瘤的研究热点主要体现在寻找其有效的靶标分子及预后标志物[1]。研究发现,舌鳞状细胞癌、混合性胶质瘤、神经上皮细胞肿瘤、星形细胞瘤等肿瘤的发生和进展与微小RNA-184密切相关[2]。然而脑胶质瘤石蜡包埋组织中微小RNA-184表达与临床病理特征的关系仍少见报道。为此,本研究观察了微小RNA-184在正常脑组织及胶质瘤中的表达,分析微小RNA-184与临床病理特征和预后的关系。现报道如下。
1 资料与方法
1.1 病例选择 选取2007-05—2012-03在我院就诊的76例脑胶质瘤石蜡包埋组织患者为研究对象,年龄20~75岁。入选患者均经病理证实并首次进行手术治疗,术前均未行放化疗。76例患者年龄(50.7±4.2)岁,男60例,女16例。卡氏评分<80分59例,≥80分17例。根据2007年WHO神经系统肿瘤分类标准对患者的肿瘤组织分级,其中Ⅰ级8例,Ⅱ级17例,Ⅲ级35例,Ⅳ级16例。同时选取24例行脑外伤行内减压的正常脑组织患者为对照。所有患者均自愿参加并签署知情同意书。
1.2 RNA的浓度测定 采用Trizol法从脑组织中提取总RNA,抽提试剂由北京索莱宝科技有限公司提供,使用ND2000超微量分光光度计对总RNA浓度进行测定,仪器由北京科尔德科贸有限公司提供。RNA提取及浓度测定均严格按照试剂盒说明书操作。
1.3 微小RNA微阵列芯片法检测 为研究正常脑组织和胶质瘤石蜡包埋组织中微小RNA-184的表达,实验中选取4例正常脑组织和4例胶质瘤的石蜡包埋组织,使用晶芯微阵列芯片扫描仪(博奥生物有限公司)进行检测。根据操作说明进行扫描、洗涤、加多聚A尾、染色、杂交等操作。采用Affymetrix基因芯片技术对阵列图像进行分析以便获得原始数据,选择GeneSpring基因表达数据分析软件对数据进行分析。探针含有所有样品均有的基团必须≥1,使用“P”进行标识用作更精确的数据分析。比较P值能够确定微小RNA的表达差异,基因上调及下调的统一标准是P≤0.05。
1.4 实时定量PCR检测微小RNA-184表达 为了对微阵列芯片法分析中微小RNA表达变化进行验证,采用实时定量PCR对正常脑组织及胶质瘤中微小RNA-184表达进行检测,内参选用RUN6B。微小RNA-184和RUN6B的引物由上海华津生物科技有限公司合成。
1.5 随访情况 从接受手术日起,对受试者进行每3月一次的定期随访,随访资料同步更新。末次随访时间为2015-06-24。其中6例由于联系方式发生变化而导致失访,其余70例随访时间为7~30个月。
1.6 统计学分析 应用SPSS 13.0统计软件分析。采用秩和检验或曼-惠特尼U检验对微小RNA-184表达和临床病理特征间的关系进行分析。采用时序检验和乘法极限估计法分析生存曲线。采用Cox分析多因素和单因素,对生存期和临床病理特征的相关性评价选用HR和CI。α=0.05作为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 实时定量PCR检测微小RNA-184表达 对24例正常脑组织和76例胶质瘤石蜡包埋组织中微小RNA-184的表达采用实时定量PCR进行检测。结果显示,微小RNA-184在正常脑组织的相对表达量为(7.31±1.79),胶质瘤为(2.84±0.85),2组微小RNA-184的表达量比较,差异具有统计学意义(P<0.05)。
2.2 微阵列芯片分析结果 选取4例正常脑组织和4例胶质瘤的石蜡包埋组织进行微阵列芯片分析,分析结果表明胶质瘤中微小RNA-184的表达下调,与实时定量PCR检测结果一致(P<0.05)。
2.3 临床病理特征与微小RNA-184表达的相关性 对临床病理变量及微小RNA-184的表达进行比较发现,KPS评分、生存时间、WHO分级和复发时间与微小RNA-184表达之间存在明显的相关性,差异均具有统计学意义(P<0.05)。见表1。
2.4 总生存期和无病生存期与微小RNA-184的关系 分析性别、年龄、肿瘤大小、辅助治疗、WHO分级等影响因素,观察胶质瘤石蜡包埋组织中微小RNA-184表达的对患者预后作用。见表2。时序检验结果表明,胶质瘤微小RNA-184低表达患者无病生存期较高表达患者更短,差异具有统计学意义(P<0.05);胶质瘤微小RNA-184低表达患者总生存期较高表达患者更短,差异具有统计学意义(P<0.05)。对无病生存期和总生存期进行多因素回归分析,结果表明,KPS评分、WHO分级和微小RNA-184的表达与总生存期具有明显相关性。WHO分级、微小RNA-184表达和KPS评分与无病生存期具有明显相关性。见表3。
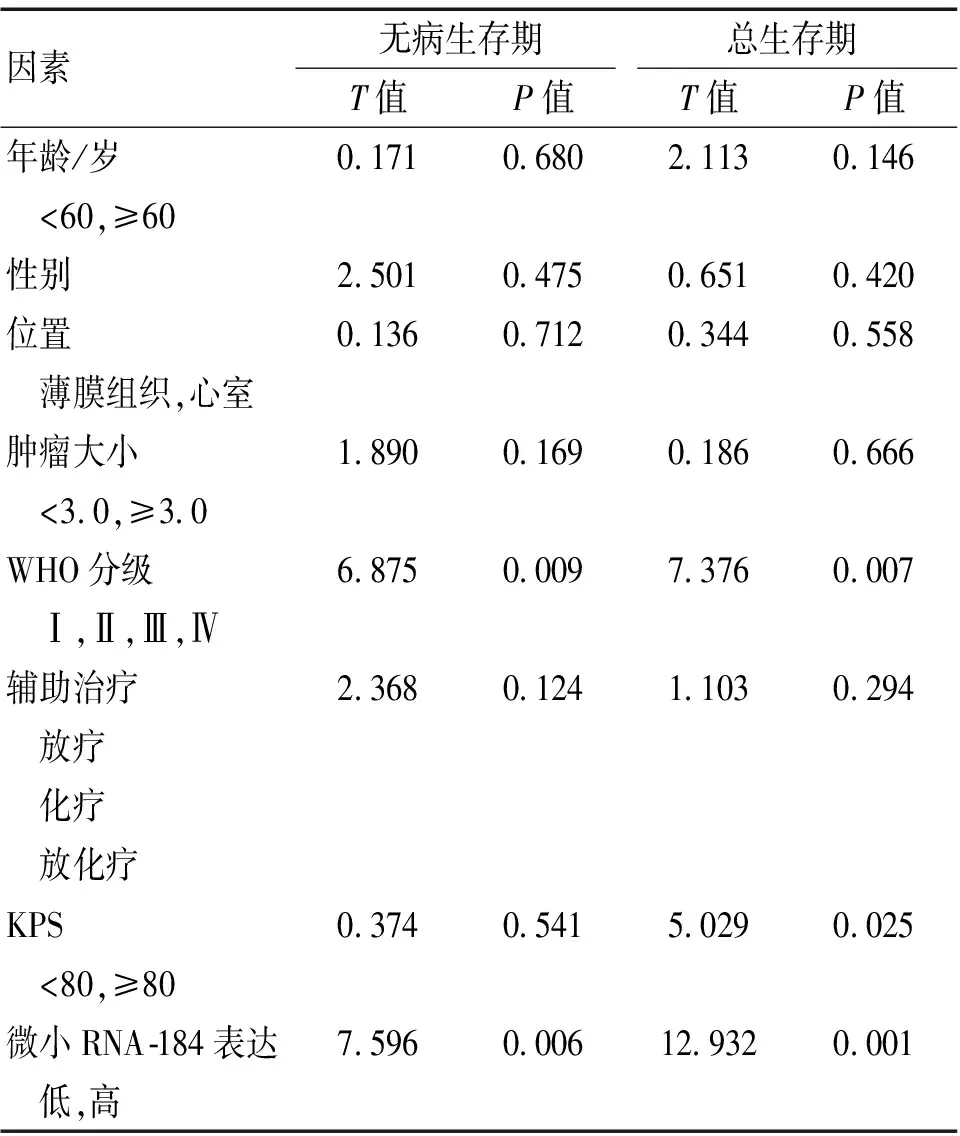
表2 单因素Cox分析胶质瘤患者的无病生存期和总生存期
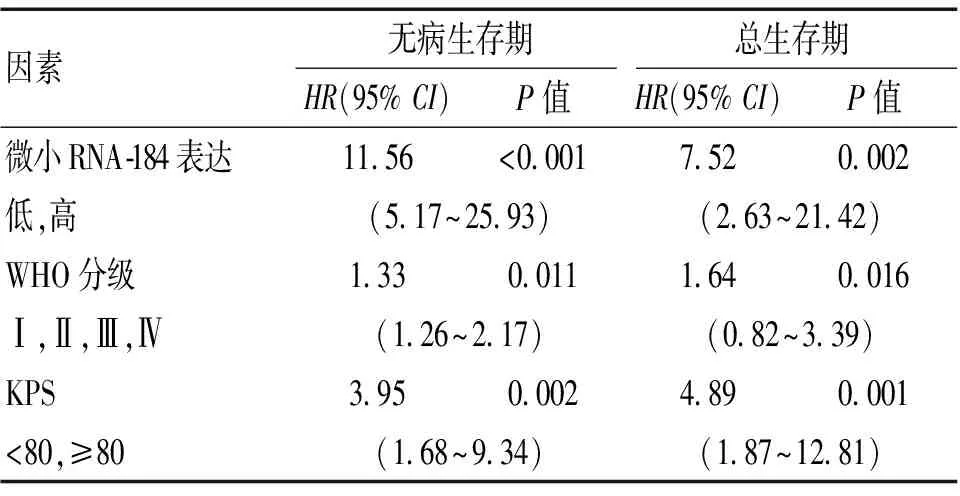
表3 多因素Cox分析胶质瘤患者的无病生存期和总生存期
3 讨论
微小RNA是一种非编码RNA,长度约为22个核苷酸。微小RNA对蛋白的合成具有抑制作用,从而能有效发挥自身的生物学功能。通常恶性肿瘤患者的微小RNA会出现功能失调,这表明肺癌、胶质瘤及乳腺癌等恶性肿瘤与其功能失调具有密切联系[3]。
随着肿瘤相关微小RNA的研究逐渐增多,脑胶质瘤中微小RNA的作用及分布也逐渐被越来越多的人所了解,胶质瘤组织中的微小RNA表达异常,干细胞生成、细胞存活、分化及肿瘤血管生成等胶质瘤的生物学行为与微小RNA的异常表达密切相关[4]。研究发现,胶质瘤细胞中的miR-222、miR-21等23种微小RNA表达上调;而miR-128、miR-7等34种则下调[5]。本次研究中采用微阵列芯片法对胶质瘤中微小RNA-184的表达进行检测,结果发现正常脑组织中微小RNA的表达高于胶质瘤,同时采用实时定量PCR法对微阵列芯片法的检测结果进行验证,发现两种不同的方法检验结果相一致。这提示胶质瘤的发生及发展可能与微小RNA-184表达下调有关。此外,本研究中发现总生存期、WHO分级、复发时间及KPS评分等因素与胶质瘤中微小RNA-184的表达具有密切联系,这表明胶质瘤中微小RNA-184可能具有抑制作用。微小RNA-184能够对凋亡前基因及抑癌基因等多靶点起到调节效果,从而产生癌基因作用;其能够对胞外细胞起靶向结合作用,调节激酶1基因转录产物的3’UTR,抑制细胞外调节蛋白激酶1蛋白的产生,从而对胶质瘤增殖发挥抑制效果。通过本次研究,微小RNA-184的内在机制可能是:(1)微小RNA-184低表达能够作用于靶基因从而对细胞生长起到促进作用并提高其生存能力;(2)微小RNA-184低表达能够对靶基因上调,对胶质瘤的侵袭性具有促进作用[6]。
此外,有研究发现,胶质瘤的进展可能与特定微小RNA表达异常有关,通过对微小RNA-184检测能够对胶质瘤的预后起到预测作用[7]。本次研究发现,微小RNA-184表达水平越高其预后也越好,同时Cox回归分析表明,不良无病生存期和总生存期密切相关的预后因素是微小RNA-184的低表达,从而能够证实在预测胶质瘤的预后中可以将其作为分子标志物。其机制可能是微小RNA-184能够对细胞生存产生抑制作用,而当微小RNA-184表达下调时就能抑制细胞凋亡,促进细胞生长,进而使得患者的预后较差[8]。
综上所述,胶质瘤患者预后和微小RNA-184的表达密切相关,在预测胶质瘤患者预后中微小RNA-184可作为独立的标志物。
[1] 郑立影,吕红,林赋桂,等.脑胶质瘤治疗策略及其研究进展[J].吉林医药学院学报,2016,37(1):50-53.
[2] 郎博娟,马金阳,胡余昌,等.胶质瘤中MicroRNA-184的表达及其预后价值[J].肿瘤防治研究,2015,42(5):483-487.
[3] Selitsky SR,Dinh TA,Toth CL,et al.Transcriptomic Analysis of Chronic Hepatitis B and C and Liver Cancer Reveals MicroRNA-Mediated Control of Cholesterol Synthesis Programs[J].mBio,2015,6(6):e01 500-1 515.
[4] 陈图南,易良,李飞,等.人原代胶质瘤起始细胞的生物学行为初步研究[J].中国临床神经外科杂志,2012,17(6):347-350;357.
[5] 王宏勤,李晋虎,苗旺,等.多发与单发性胶质瘤患者石蜡包埋组织中微小RNA差异表达的初步探讨[J].中华神经外科杂志,2015,31(5):519-523.
[6] 郭红宝,南阳,甄英伟,等.微小RNA-451对人脑U87胶质瘤细胞株增殖和侵袭影响机制的研究[J].中华神经外科杂志,2015,31(12):1 263-1 267.
[7] 马金阳,陈谦学.微小RNA-145在胶质瘤中的表达及其临床意义[J].中华实验外科杂志,2014,31(9):1 871-1 873.
[8] 戚贵军,陈步东,张春智,等.恶性胶质瘤患者预后与微小RNA-221和微小RNA-222表达的关系[J].中华实验外科杂志,2012,29(7):1 394-1 395.
(收稿2016-04-02)
R730.264
A
1673-5110(2016)21-0059-03
