异氟醚对胶质瘤C57BL/6小鼠的抑瘤作用研究
2016-11-29罗冬冬赵海林贺颖芳
胡 骕 彭 彪 罗冬冬 赵海林 李 丹 贺颖芳
广州医科大学附属肿瘤医院神经外科 广州 510095
异氟醚对胶质瘤C57BL/6小鼠的抑瘤作用研究
胡 骕 彭 彪 罗冬冬 赵海林 李 丹 贺颖芳
广州医科大学附属肿瘤医院神经外科 广州 510095
目的 探讨吸入性麻醉药物异氟醚对胶质瘤C57BL/6小鼠的抑瘤作用和机制。方法 将36只C57BL/6小鼠随机分为空白组、模型对照组和实验组,每组12只。采用脑胶质瘤立体定向技术进行U251胶质瘤细胞植入造模;采用核磁共振成像检查(MRI)与苏木精-伊红(HE)染色评价造模成瘤与异氟醚干预后作用;采用荧光定量法检测脑组织匀浆中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6的表达水平;采用蛋白印迹法检查核转录因子-κB p65蛋白表达水平。结果 第20天实验组肿瘤直径明显小于对照组(1.2±0.5mm vs 1.7±0.3mm),差异有统计学意义(P<0.05)。HE染色病理表现提示实验组稍好于对照组,可能有一定抑制作用。实验组TNF-α mRNA表达量显著少于对照组(P<0.05),而IL-1β与IL-6表达量亦相对少于对照组,差异有统计学意义(P<0.05)。实验组NF-κB p65表达与模型组相比有明显降低(0.323±0.011 vs 0.512±0.016),但仍然高于空白组,差异有统计学意义(P<0.05)。结论 吸入性麻醉药物异氟醚能够抑制胶质瘤的快速生长,其作用机制主要是通过抑制NF-κB p65的表达,从而减少脑组织T辅助细胞炎症因子,起到负调控NF-κB的活化作用。
胶质瘤;异氟醚;核转录因子-κB;C57BL/6小鼠
脑胶质瘤是常见的中枢神经系统恶性肿瘤之一,成人发病率为3~5/10万,具有高发病率、高度侵袭性与高病死率的特点。其发病机制尚未阐明,放化疗虽然可以局部抑制胶质瘤的生长,但耐药性与辐射抵抗性严重制约临床疗效[1]。研究证明,术后肿瘤细胞对放、化疗不敏感是与核转录因子(nuclear factor,NF)-κB的活性增高有关[2]。再者,研究也表明麻醉药物对肿瘤细胞的转移也有一定影响,可以诱导氧化应激的发生,并且激活炎性因子水平变化,从而影响肿瘤的增殖[3]。为此,我们基于NF-κB信号通路研究异氟醚对C57 BL/6 胶质瘤小鼠的作用,探讨麻醉药物异氟醚抑制胶质瘤的具体途径和机制,为特异而有效的个体化胶质瘤治疗方案提供一定的基础研究依据。
1 材料与方法
1.1 材料 U251胶质瘤细胞购自中国科学院上海生物学研究所。C57BL/6 小鼠,SPF级,雄性,平均体质量20~25 g,空白组、实验组、对照组各12只,共36只;购自广东省医学实验动物中心(生产许可证:SCXX粤2013-0002)。
1.2 器材与试剂 10%胎牛血清(Gibco)DMEM培养液,实验用电钻1台,江湾II型立体定位仪,广州医科大学附属肿瘤医院影像学系场强飞利浦1.5T MR机,小鼠NF-κB p65抗体与抗兔二抗购自美国CST公司。
1.3 方法
1.3.1 胶质瘤小鼠模型的建立:采用立体定向技术,取对数生长期U251细胞,经0.25 %胰蛋白酶消化,离心去上清,而后用去血清维持DMEM离心洗涤2次,计细胞数,调整细胞浓度,重悬于PBS中,置于37 ℃水浴备用。小鼠以1%戊巴比妥钠按40 mg/kg 腹腔注射,麻醉生效后将小鼠固定于立体定向仪上,剪去头顶部眼裂至外耳道之间的毛发,常规消毒铺单后于中线处眼裂后作一长约1.0 cm垂直切口,暴露前囟,取其前方1.0 mm ,右侧距中线1.0 mm处钻孔,其直径约为1.0 mm;接种U251细胞,从恒温水浴中取出配好的细胞悬液,以10 μL微量注射器吸取4 μL(含G L261 细胞约1×105个),调整移动架位置,使针尖位于骨孔处,缓慢垂直进针2 mm,抽吸略后退后注入细胞悬液,注射时间持续10 min,缓慢拔针,约3 min。以骨蜡封闭骨窗,逐层缝合关颅,固定于电极移动架上。观察各组实验动物生活状态及生存周期;MRI 检查实验10 d、20 d肿瘤的生长情况;MRI成像予钆喷替酸葡甲胺0.2 mmol/kg注射后,T1加权扫描。
1.3.2 小鼠模型吸入性麻醉药物的处理:建模后10 d与20 d,实验组予1.4%异氟醚吸入,同时在100%氧气的环境下作用2 h;模型对照组只接受2 h100%氧气的作用;2组气体通过小鼠麻醉室的流速相同。小鼠麻醉室的温度控制在(37±0.5)℃;2 h后,将小鼠转移到通有100%氧气的饲养室中,直到小鼠恢复翻正反射。
1.3.3 细胞和组织的准备:第20天颈椎脱臼法处死,常规方法取小鼠脑组织。将细胞或组织在细胞或组织裂解液中进行匀浆和裂解。将得到的裂解液或匀浆液收集入EP管中,13 000 r/min离心15 min备用。常规HE染色,以10 %甲醛固定24 h ,石蜡包埋;组织切片机切成5 μm切片,HE染色,光镜下检查。
1.3.4实验室检查:荧光定量PCR法检测三组脑组织匀浆中TNF-α、IL-1β、IL-6的水平。其中,TNF-α引物序列:上游5’-TACTGAACTTCGGGGTGA-’3,下游5’-ACTTGGTGGTTTGCTACG-’3;IL-1β引物序列:上游5’-GGCAGTATCACTCATTGTG-’3,下游5’-CTCCACTTTGCTCTTGAC-’3;IL-6引物序列:上游5’-GCCTTCTTGGGACTGATC-’3,下游5’-AGGTCTGTTGGGAGTGGTA-’3;内参β-actin引物序列:上游5’-CTACAATGAGCTGCGTGTG-’3,下游5’-GCGTGAGGGAGAGCATAG-’3)。PCR反应产物的相对定量分析,测得的目的基因的表达水平,均有该样本内参β-actin基因校正,以2-△△Ct方法计算相对表达水平。
Western blot蛋白印迹法定量检测NF-κB p65蛋白水平,扫描仪扫描胶片,采用Quantity One 4.61软件进行条带的灰度分析,计算p65/β-actin比值,表示p65蛋白的相对表达量。
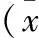
2 结果
2.1 小鼠生存基本情况 C57BL/6小鼠接种后第5~7天自行觅食、饮水较常减少,体质量及警觉性均明显下降;第15~20天出现行动迟缓、运动时身体向一侧偏斜,双眼稍见突起,注射侧头顶部隆起等表现。第20天吸入麻醉药物后,未见死亡,但行动、警觉性较前明显减弱,实验组与对照组均能恢复翻正反射。
2.2 MRI影像学表现 2组C57BL/6 小鼠接种后10 d MRI 检查显示肿瘤均已形成,实验组主要表观为肿瘤直径(0.5±0.3)mm,长T1长T2信号,不均匀强化,边不清;对照组肿瘤直径(0.6±0.2)mm,长T1长T2信号,不均匀强化,边不清。20 d MRI 检查显示实验组肿瘤直径(1.2±0.5)mm,长T1长T2信号,不均匀强化,边不清;对照组(1.7±0.3)mm,且长T1长T2信号,不均匀强化,中线结构移位。20 d实验组肿瘤直径明显小于对照组,差异有统计学意义(P<0.05)。
2.3 病理表现 HE染色光镜下观察实验组肿瘤细胞呈圆形或梭形,肿瘤细胞排列紊乱,可见生长活跃的胶质瘤细胞密集成群,并趋向正常脑组织浸润生长。对照组肿瘤细胞细胞核呈多角或条形,核分裂相多见,细胞质较少,中心部位由于肿瘤生长过快可见坏死表现;脑组织与肿瘤交界处可见到肿瘤细胞侵入脑实质,边界不清。HE染色病理表现,实验组稍好于对照组,可能有一定抑制作用(见图1)。

对照组 实验组图1 C57BL/6小鼠胶质瘤组织HE染色(400×)
2.4 脑组织TNF-α、IL-1β、IL-6的mRNA表达量 经荧光定量PCR检测,实验组TNF-α mRNA表达量显著少于对照组(t=11.90,P=0.00);而IL-1β与IL-6表达量亦相对少于对照组,差异存在统计学意义(P<0.05)。见表1 。
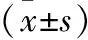
表1 脑组织TNF-α、IL-1β、IL-6的mRNA表达量
2.5 脑组织NF-κB p65的表达水平 实验组NF-κB p65表达与模型组相比有明显降低,但仍然高于空白组,差异有统计学意义(P<0.05),见图2。

图2 脑组织 NF-κB p65的表达水平
3 讨论
恶性肿瘤的主要特征为细胞的无限增殖,而且具有很强的转移性,侵袭到其他组织,治疗不利使生存时间显著缩短[4]。麻醉药物在肿瘤的放化疗及外科手术中均有应用,特别是在恶性肿瘤的切除手术中应用更为广泛[5],但是麻醉药物对肿瘤的作用及其机制尚未阐明,因此麻醉药物与肿瘤发展关系的研究将成为未来肿瘤研究的一个热点领域[6]。
现代研究表明,NF-κB信号通路具有双向效应,需要精确调控;过度激活的NF-κB会导致大量炎性因子表达,对机体带来免疫损伤,减低机体对放化疗的耐受性[7]。再者,研究表明胶质瘤的发展与局部免疫抑制机制有重要的联系[8]。上述结果发现实验组经吸入性麻醉药物异氟醚干预后能够抑制NF-κB p65的表达,而且能够减少脑组织TNF-α、IL-1β、IL-6从而达到负调控NF-κB信号的作用。
综上,吸入性麻醉药物异氟醚虽然不能中断C57BL/6小鼠胶质瘤的发展,但却能够一定程度上抑制胶质瘤的快速生长,其作用机制主要是通过抑制NF-κB p65的表达,从而减少脑组织T辅助细胞炎症因子起到负调控NF-κB的活化作用。然而,NF--κB还参与了细胞凋亡、增殖等其他细胞生物过程,为此我们尚需继续深入探讨吸入性麻醉药的其他作用机制,为提高放化疗疗效与肿瘤个体化治疗提供基础研究依据。
[1] Stupp R ,Brada M,Bent MJ,et al.High-grade glioma:ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2014,25(3):93-101.
[2] Wen PY,Macdonald DR,Reardon DA ,et al.Updated response assessment criteria for high-grade gliomas:response assessment in neuro-oncology working group[J].J Clin Oncol,2010,28(11):1 963-1 972.
[3] Brasil LJ,San MB,Kretzmann NA,et al.Halothane induces oxidative stress and NF-kB activation in rat liver:protective effect of propofol[J].Toxicology,2007,227(1):53-61.
[4] Preusser M,Ribaupierre S,Wöhrer A,et al.Current concepts and management of glioblastoma[J].Ann Neurol,2011,70(1):9-21.
[5] Fogh SE,Andrews DW,Glass J,et al.Hypofractionated stereotactic radiation therapy:an effective therapy for recurrent high-grade gliomas[J].J Clin Oncol,2010,28(18):3 048-3 053.
[6] Osborn AG,Salzman KL,Thurnher MM,et al.The new World Health Organization classification of central nervous system tumors:what can the neuroradiologist really say[J].Am J Neuroradiol,2012,33(5):795-802.
[7] 韩东,王建祯,史保中.耐药相关基因MGMT、NF-κB、GST-π在脑胶质瘤中的表达及其临床意义[J].中国社区医师(医学专业),2013,13(3):232.
[8] Hartmann C,Hentschel B,Simon M,et al.Long-term survival in primary glioblastoma with versus without isocitrate dehydrogenase mutations[J].Clin Cancer Res,2013,19(18):5 146-5 157.
(收稿2015-12-20)
广州医科大学青年项目:2013A38 ;广州市属高校科研项目:1201430219
R-332
A
1673-5110(2016)21-0057-03
