牛磺酸对裸鼠乳腺癌模型肿瘤生长的影响及其机制
2016-11-29宋玉美贺瑜梁柏莹郭松超欧阳轶强
宋玉美贺瑜梁柏莹郭松超欧阳轶强
作者单位:530021南宁广西医科大学公共卫生学院营养与食品卫生学教研室
牛磺酸对裸鼠乳腺癌模型肿瘤生长的影响及其机制
宋玉美贺瑜梁柏莹郭松超欧阳轶强
作者单位:530021南宁广西医科大学公共卫生学院营养与食品卫生学教研室
目的探讨牛磺酸对裸鼠乳腺癌模型肿瘤生长的影响及机制。方法10只SPF级5周龄裸鼠接种MDA-MB-231乳腺癌细胞后随机分为牛磺酸干预组和对照组,每组5只。牛磺酸干预组给予添加5%的牛磺酸饮水,对照组给予正常无菌饮水。测量两组小鼠肿瘤体积和肿瘤质量,采用蛋白免疫印迹法检测雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidemic growth factor receptor 2,HER-2)和鸟苷三磷酸酶激活蛋白(guanosine triphosphatase activating protein,p21ras)表达量的变化。结果实验结束时所有裸鼠均存活,裸鼠乳腺癌模型造模成功。牛磺酸对裸鼠乳腺癌模型肿瘤的抑制率为41.6%。相对于对照组,牛磺酸干预组裸鼠肿瘤组织中ER表达量提高了134%(P<0.05),PR表达量提高了47.5%(P<0.05),HER-2表达量降低了67%(P<0.05),p21ras表达量降低了62.2%(P<0.01)。结论牛磺酸可抑制裸鼠乳腺癌模型肿瘤生长,其机制可能与上调ER、PR和下调HER-2、p21ras有关。
乳腺肿瘤;牛磺酸;抗肿瘤;裸鼠;雌激素受体;孕激素受体;人类表皮生长因子受体2;鸟苷三磷酸酶激活蛋白
牛磺酸是一种人体条件必需的含硫氨基酸,是机体内源性抗损伤物质。研究发现牛磺酸可通过增强大鼠机体的免疫力、抗氧化能力、DNA损伤修复和抑制癌细胞增殖等途径,抑制大鼠肿瘤的生长[1],对二甲基苯蒽诱导的大鼠乳腺癌有一定治疗作用[2]。MDAMB-231细胞引起的乳腺癌侵袭性强、转移率高、预后较差,且缺乏有效的治疗方法[3]。本实验采用人类乳腺癌细胞MDA-MB-231接种裸鼠,建立裸鼠乳腺癌模型,观察牛磺酸对裸鼠乳腺癌模型肿瘤生长的影响,并探讨其干预机制,以期为乳腺癌的治疗提供实验基础。
1 材料与方法
1.1实验动物与细胞
5周龄SPF雌性BALB/c裸鼠10只,体重18~22 g,取自广西医科大学实验动物中心(生产许可证号:SCXK桂2014-0002)。乳腺癌MDA-MB-231细胞为广西医科大学保存提供。
1.2主要试剂和仪器
L-15培养基(美国Gibco公司)、胎牛血清(上海依科赛生物制品公司)、青霉素链霉素双抗、0.25%胰蛋白酶。一抗:ER鼠单克隆抗体、PR鼠单克隆抗体、HER-2鼠单克隆抗体、p21ras鼠单克隆抗体均为美国Origene公司产品。二抗:HRP标记的山羊抗鼠多克隆抗体为英国Abcam公司产品。RIPA裂解液和PMSF购自碧云天生物科技公司。PVDF膜,TBST洗脱液,脱脂奶粉,ECL发光试剂盒,BCA蛋白定量试剂盒,牛磺酸粉剂(楚牛牌食品添加剂,GB14759-2010),1%戊巴比妥钠,全波长酶标仪,超声波组织破碎仪,Western Blot凝胶电泳仪,化学发光成像分析系统购自美国Protein Simple公司。
1.3裸鼠乳腺癌模型的建立
人乳腺癌MDA-MB-231细胞用含10%胎牛血清、1%青霉素链霉素双抗的L-15培养基在37℃二氧化碳细胞培养箱中培养,细胞计数后用生理盐水调整细胞数目至1×107个/mL,在裸鼠左侧的第二对乳腺脂肪垫下注射0.1 mL生理盐水定量的细胞后,将10只裸鼠随机分为牛磺酸干预组和对照组,每组5只。牛磺酸干预组裸鼠给予5%的牛磺酸饮水,对照裸鼠给予正常无菌饮水,两组裸鼠饮水量及进食量一致,每只裸鼠饮水量约为6 mL/d。每两天观察、测量并记录细胞接种部位肿瘤的生长情况。第40天用1%戊巴比妥钠过量麻醉处死荷瘤裸鼠,完整剥离肿瘤,测量肿瘤长径和短径,计算肿瘤体积(肿瘤体积=长径×短径2/2),绘制肿瘤生长曲线。同时称量肿瘤质量,计算肿瘤抑制率=(对照组肿瘤平均质量-牛磺酸干预组肿瘤平均质量)/对照组肿瘤平均质量×100%。肿瘤组织放于液氮速冻,转而保存于-80℃冰箱。
1.4蛋白免疫印迹法检测ER、PR、HER-2、p21ras蛋白的表达情况
取30 mg肿瘤组织加入400 μL裂解液匀浆,超声裂解组织,11 000 r/min离心5 min,取上清液,用BCA定量法测蛋白浓度。将上清液与2X上样缓冲液混合后,100℃加热5 min变性。SDS-PAGE凝胶电泳分离蛋白,PVDF膜转膜,5%脱脂奶粉封闭,分别加一抗ER、PR、HER-2、p21ras单克隆抗体(抗体浓度为1∶2 000),4℃孵育过夜,TBST漂洗3次,加HRP标记过二抗(抗体稀释浓度为1∶4 000),室温孵育2 h,TBST漂洗3次,多功能成像系统曝光。以GAPDH做内参,用Alpha View软件分析条带的灰度值,计算两组肿瘤蛋白表达量含量。
1.5组织病理学检查
裸鼠乳腺癌肿瘤组织浸入福尔马林溶液(10%甲醛)固定后,对肿瘤组织进行取材、脱水、包埋、切片,经HE染色后,在显微镜下观察,进行病理学鉴定。
1.6统计学处理
采用SPSS 16.0软件对数据进行统计学分析,实验结果用均数±标准差(±s)表示,独立样本比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1裸鼠造模情况
实验期间所有裸鼠均存活,实验结束时,所有裸鼠均长出肿瘤,肿瘤最大体积的长径和短径均约2 cm,符合实验预期,表明造模成功。见图1。
2.2裸鼠肿瘤组织病理学检查结果
肉眼观察:两组肿瘤组织均为浅灰白色,似有包膜,质地略软,切开似有坏死。镜下观察:乳腺结构不明显;肿瘤呈实体性,细胞丰富,无腺管状结构;肿瘤细胞增生活跃,多为合体细胞,细胞排列不规则,细胞核呈空泡状,可见核分裂相;癌巢内有坏死和出血,癌巢周围可见淋巴细胞、浆细胞浸润等病理改变,两组组织病理学表现相似,均诊断为裸鼠乳腺髓样癌。病理切片结果符合乳腺癌组织病理特征,裸鼠乳腺癌模型造模可靠。见图2。
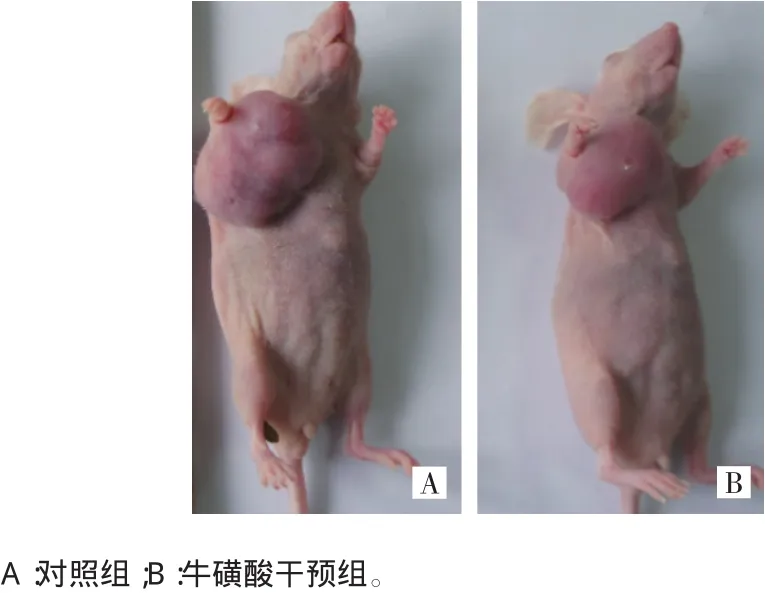
图1 实验结束时裸鼠肿瘤生长情况
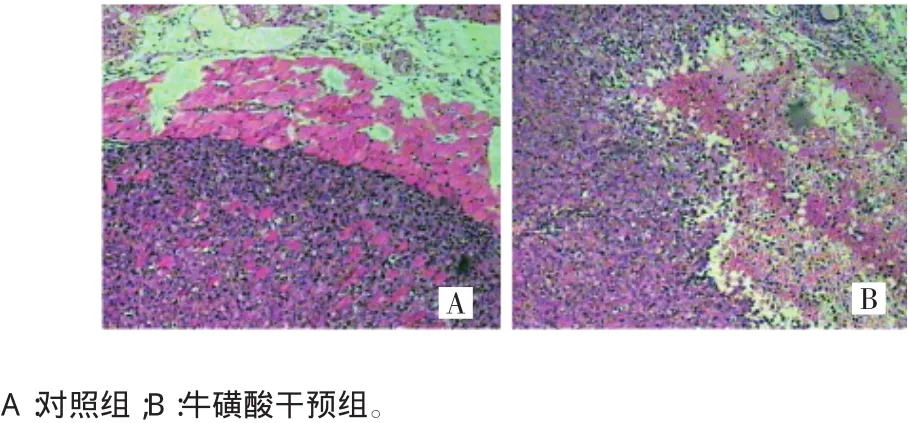
图2 两组裸鼠肿瘤组织的病理学检查结果
2.3牛磺酸对裸鼠乳腺癌模型肿瘤生长的影响
接种肿瘤细胞25 d后,牛磺酸干预组肿瘤体积较对照组明显减缓(见图3)。实验结束时,牛磺酸干预组裸鼠的肿瘤体积为(178.70±67.02)cm3,肿瘤质量为(2.02±0.75)g;对照组肿瘤体积为(306.01±45.93)cm3,肿瘤质量为(3.46±0.95)g,两组肿瘤体积和质量比较差异均有统计学意义(P<0.05)。实验结束时牛磺酸对裸鼠乳腺癌肿瘤的抑制率为41.6%。提示牛磺酸能有效抑制肿瘤生长。
2.4牛磺酸对裸鼠肿瘤组织中ER、PR、HER-2和p21ras蛋白表达的影响
蛋白免疫印迹实验表明,与对照组比较,牛磺酸干预组肿瘤组织中ER表达量提高了134%(P<0.05),PR表达量提高了47.5%(P<0.05);HER-2表达量下降了67%(P<0.05),p21ras表达量下降了62.2%(P<0.01),差异均有统计学意义。见图4。
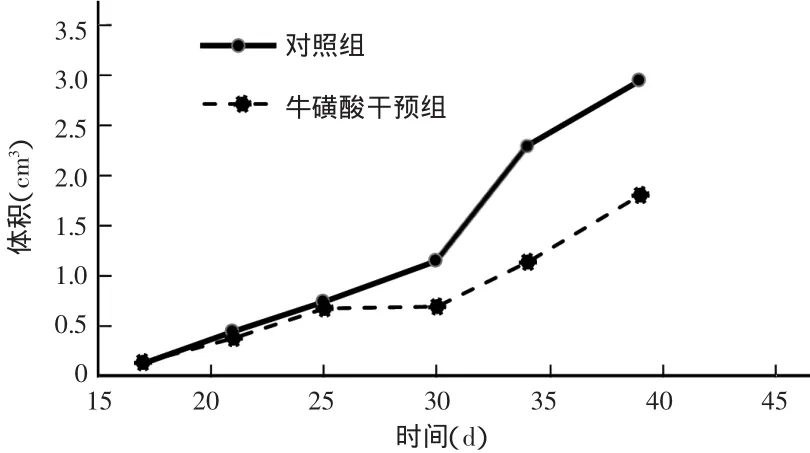
图3 两组裸鼠乳腺癌模型的肿瘤体积生长曲线比较
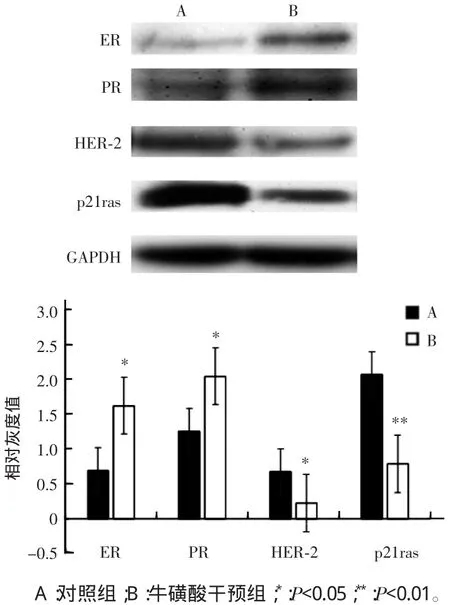
图4 两组裸鼠肿瘤组织中ER、PR、HER-2和p21ras蛋白免疫印迹比较
3 讨论
本实验采用裸鼠注射MDA-MB-231乳腺癌细胞,建立裸鼠乳腺癌模型。经病理切片检查结果证实裸鼠肿瘤组织为乳腺髓样癌,说明建立的裸鼠乳腺癌模型可靠。牛磺酸干预组裸鼠给予牛磺酸饮水25 d后,肿瘤体积和质量明显下降,实验结束时两组肿瘤体积和质量比较差异有统计学意义,牛磺酸对裸鼠乳腺癌肿瘤的抑制率为41.6%,提示牛磺酸具有抑制乳腺癌肿瘤组织生长的作用。
乳腺癌内分泌治疗是降低复发率和死亡危险的有效手段,ER和PR是临床上乳腺癌内分泌治疗中的靶分子,在乳腺癌进展和治疗过程中有重要作用[4]。ER和PR也是判断乳腺癌预后的有效指标,有报道ER和PR阳性表达者,其治愈率较高,而复发率较低[5,6]。Ruddy等[7]研究亦发现ER和PR阳性表达者对内分泌治疗较敏感,可使肿块缩小,癌细胞凋亡,其术后5年生存率高于阴性者[8]。本研究中,蛋白免疫印迹检测发现,接种MDA-MB-231乳腺癌细胞的裸鼠模型经牛磺酸干预,相比对照组,ER和PR的表达量明显提高,说明牛磺酸可能通过提高肿瘤组织中ER和PR的表达而干预乳腺癌内分泌环节的调控,从而影响乳腺癌肿瘤的发展。
HER-2参与了多种肿瘤的发生、发展,是肿瘤治疗的研究热点之一,也是乳腺癌治疗的靶分子之一。国内外学者报道,HER-2与癌细胞转移和复发有关,HER-2高表达的乳腺癌患者其预后较差[9,10]。HER-2过表达亦可导致肿瘤发生、转移及产生药物抵抗,对激素疗法和化疗药物产生耐受[11]。本实验中牛磺酸干预组组织中HER-2的表达量明显降低,说明牛磺酸对HER-2的表达有一定抑制作用,牛磺酸可能通过降低HER-2的表达,参与乳腺癌细胞的生长增殖环节,抑制肿瘤细胞分裂增殖,促进细胞凋亡,减缓肿瘤增长速度,从而发挥控制肿瘤生长的作用。
p21ras是调控细胞生长分化的信号因子,是RAS基因的表达产物。RAS基因是人类最常见的原癌基因,许多肿瘤中都发现RAS基因过度活跃,因此也成为治疗肿瘤的靶点[12]。p21ras与下游相关效应蛋白组成信号传导通路,调控细胞的生长、分化和凋亡,当p21ras过表达,信号传导通路激活,导致细胞恶性转化,从而产生癌变。在已有的报道中,多项实验研究证明,在多种肿瘤细胞中均发现p21ras过量表达的现象。本实验结果亦显示,牛磺酸干预组组织中p21ras表达量降低,提示牛磺酸可能通过降低p21ras表达量,参与和控制肿瘤细胞的生长分化进程,从而延缓肿瘤生长。
综上所述,牛磺酸对裸鼠乳腺癌模型肿瘤表现出较好的抑制作用,其机制可能是牛磺酸通过对乳腺癌发生发展相关的ER、PR、HER-2和p21ras蛋白进行良性调控,从肿瘤的内分泌以及细胞生长、增殖和分化等环节,抑制乳腺癌细胞生长,减缓了裸鼠乳腺癌模型肿瘤生长。
[1]薛美兰,张华荣,姜长青,等.牛磺酸抑制二甲基苯蒽诱发大鼠乳腺癌及其机制研究[J].营养学报,2008,30(1):57-60.
[2]Vanitha MK,Baskaran K,Periyasamy K.et al.Modulatory effect of taurine on 7,12-dimethylbenz(a)Anthracene-induced alterations in detoxification enzyme system,membrane bound enzymes,glycoprotein profile and proliferative cell nuclear antigen in rat breast tissue[J].J BiochemMol Toxicol,2016,30(8):414-423.
[3]Wu K,Yang Q,Liu Y,et al.Meta-analysis on the association between pathologic complete response and triple-negative breast cancer after neoadjuvant chemotherapy[J].World J Surg Oncol,2014,12(6):95.
[4]Early Breast Cancer Trialists'Collaborative Group(EBCTCG).Efects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the randomized trials[J].Lancet,2005,365(9472):1687-1717.
[5]Differ A,Burhanedtin-Zincircioglu S,Karadayi B,et al.Characteristics and prognosis of breast cancer in younger women[J].J BUON,2009,14(4):619-623.
[6]Kapp JM,Yankaskas BC,LeFevre ML.Are mammography recommendations in women younger than 40 related to increased risk?[J]. Breast Cancer Res Treat,2010,119(2):485-490.
[7]Ruddy KJ,Partridge AJ.Optimizing endocrine therapy in premenopausal ER-positive breast cancer patients[J].Oncology(Williston Park),2009,23(1):34-40.
[8]Vrbanec D,Petricevi?B.Estrogen and progesterone receptor status in primary breast cancer--a study of 11,273 patients from the year 1990 to2002[J].Coll Antropol,2007,31(2):535-540.
[9]XuBH,JiangZF,ChuaD,etal.Lapatinibpluscapecitabineintreating HER-2-positiveadvancedbreastcancer:efficacy,safety,andbiomarker results fromChinese patients[J].Chin J Cancer,2011,30(5):327-335.
[10]李少英,王维,李建梅,等.PIK3CA基因突变与乳腺癌恶性程度和预后的关系[J].中华肿瘤杂志,2011,33(8):605-608.
[11]杨丽丽,梁莉萍,赵峰.ER、PR、HER-2、Ki67、Nm23、p53在多中心性乳腺癌中的表达及临床意义[J].重庆医科大学学报.2012,37(11):964-967.
[12]Yang JL,Pan XY,ZhaoWX,et al.The antitumor efficacy of a novel adenovirus-mediated anti-p21Ras single chain fragment variable antibody on human cancers in vitroand in vivo[J].Int J Oncol,2016,48(3):1218-1228.
[2016-08-29收稿][2016-09-20修回][编辑罗惠予]
Effects of taurine on tumor growth in a nude mouse breast cancer model
Song Yumei,He Yu,Liang Boying,Guo Songchao,Ouyang Yiqiang(Department of Nutrition and Food,Hygiene Public Health of Guangxi Medical University,Nanning 530021,P.R.China)
Corresponding author:Guo Songchao.E-mail:2433164518@qq.com
Objective To study the effect of taurine on the humanized nude mouse model of triple-negative breast cancer.Methods Five-week-old SPF level nude mice(n=10)were inoculated with MDA-MB-231 breast cancer cells and randomly divided into one group that
normal drinking water and another group that
water containing 5%taurine(n=5 animals per group). Tumor volume and weight were examined after treatment,and Western blotting was used to assess expression of estrogen receptor(ER),progesterone receptor(PR),human epidermal growth factor receptor 2(HER-2)and guanosine triphosphatase-activating protein p21ras.Results All mice survived until the end of the experiment,and all tumors grew.Compared to control mice,mice given taurine had tumors with 41.6%smaller weight and volume(P<0.05),134%higher expression of ER(P<0.05),47.5%higher expression of PR(P<0.05),67%lower expression of HER-2(P<0.05)and 62.2%lower expression of p21ras(P<0.01).Conclusion Taurine inhibits tumor growth by up-regulating expression of ER and PR and down-regulating expression of HER-2 and p21ras.
Breast neoplasms;Taurine;Antitumor;Nude mice;Estrogen receptor;Progesterone receptor;Human epidemic growth factor receptor 2;Guanosine triphosphatase activating protein
R737.9
A
1674-5671(2016)05-04
10.3969/j.issn.1674-5671.2016.05.01
广西科技基础条件平台建设项目资助(14-91-02)
郭松超。E-mail:2433164518@qq.com
