NF-κB、COX-2、LKB1在子宫内膜癌组织中的表达及临床意义
2016-11-29王健理何君葵潘月琼唐乔乔宋红林
王健理何君葵潘月琼唐乔乔宋红林
作者单位:530021南宁1广西医科大学附属肿瘤医院妇瘤科二病区;2广西医科大学研究生学院
临床研究
NF-κB、COX-2、LKB1在子宫内膜癌组织中的表达及临床意义
王健理1何君葵2潘月琼2唐乔乔2宋红林1
作者单位:530021南宁1广西医科大学附属肿瘤医院妇瘤科二病区;2广西医科大学研究生学院
目的探讨核转录因子κB(NF-κB)、环氧化酶2(COX-2)、肝激酶基因B1(LKB1)在不同子宫内膜组织中的表达及临床意义。方法采用免疫组化SP法检测60例正常子宫内膜、31例非典型增生子宫内膜和60例子宫内膜癌组织中NF-κB、COX-2、LKB1蛋白的表达,并分析其与子宫内膜癌临床病理特征的关系。结果NF-κB、COX-2、LKB1在子宫内膜癌组织、非典型增生子宫内膜组织和正常子宫内膜组织中的阳性表达率分别为63.3%、70.0%、35.0%,41.9%、64.5%、61.3%和35.0%、51.7%、93.3%,NF-κB、LKB1在3组间的表达差异有统计学意义(P<0.05),而COX-2的表达差异无统计学意义(P>0.05)。子宫内膜癌中NF-κB、COX-2、LKB1蛋白的阳性表达与病理类型、FIGO分期、淋巴结转移均无关(P>0.05)。LKB1蛋白表达与肌层浸润深度和组织学分级相关(P<0.05),NF-κB蛋白表达与组织学分级亦相关(P<0.05)。结论NF-κB在子宫内膜癌组织中高表达、LKB1低表达,其表达可能与子宫内膜癌的发生发展有关。
子宫肿瘤;子宫内膜癌;NF-κB;COX-2;LKB1;免疫组织化学法;蛋白表达;临床意义
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,以绝经后妇女多见。高分化子宫内膜癌5年生存率超过90%,而低分化者仅为69%[1],其发生发展机制尚不完全清楚。核转录因子κB(NF-κB)是重要的转录因子,它通过调节生长诱导因子ErbB2、细胞周期蛋白D1以及抗凋亡基因如BCL-2、BCLXL、XIAP的基因编码,参与细胞增殖和凋亡[2]。环氧化酶2(COX-2)是体内重要的环氧化酶,能诱导肿瘤细胞增殖和血管生成,抑制细胞凋亡和免疫耐受,从而促进肿瘤侵袭和转移[3]。肝激酶基因B1(LKB1)能通过激活和磷酸化AMP活化蛋白激酶(AMPK)调节细胞极性、增殖、凋亡、细胞周期进程及能量代谢,是一种肿瘤生长抑制基因[4]。本研究探讨了NF-κB、COX-2、LKB1在不同子宫内膜组织中的表达及其与子宫内膜癌临床病理特征的关系。
1 材料与方法
1.1一般资料
选取2008年9月至2011年9月本院经手术病理确诊为子宫内膜癌的60例患者,年龄25~65岁,中位年龄58岁;临床分期Ⅰ期35例、Ⅱ期8例、Ⅲ期17例。病理分级按WHO(2003)标准G1期25例、G2期12例、G3期23例。同时收集同期因子宫肌瘤行全子宫切除术且术后病理证实无子宫内膜病变的60例组织标本,年龄32~65岁,中位年龄52岁。选取手术病理确诊为子宫内膜非典型增生的31例组织标本,年龄45~68岁,中位年龄54岁。子宫内膜癌患者术前均未接受放疗、化疗或其他抗肿瘤治疗。所有研究对象术前3个月内均未接受非甾体类抗炎药、激素治疗。标本的选取均经医院伦理委员会批准及患者本人知情同意。
1.2主要试剂
兔抗人NF-κB多克隆抗体、兔抗人COX-2多克隆抗体、兔抗人LKB1多克隆抗体和兔/鼠通用型SP试剂盒均购自上海拜力生物科技有限公司。
1.3实验方法
分别取子宫内膜癌组织、正常子宫内膜组织和非典型增生子宫内膜组织,置于4%甲醛溶液中固定,石蜡包埋,4 μm连续切片,常规脱蜡、水化,之后按SP试剂盒说明书操作,DAB显色,一抗工作浓度按说明书配备。空白对照:PBS液代替一抗;同时行阳性对照。采用免疫组化SP法检测NF-κB、COX-2、LKB1蛋白的表达情况。
1.4结果判断
免疫组化阳性染色为细胞质或细胞膜出现明显的棕褐色或棕黄色颗粒。NF-κB、LKB1蛋白的阳性细胞为细胞质内或细胞核出现棕褐色或棕黄色颗粒。COX-2蛋白的阳性细胞为细胞质内及核膜出现棕黄色或者棕褐色颗粒。采用半定量积分法判断结果。高倍镜观察:染色强度基本不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。阳性细胞数和染色强度得分相乘,0~1分为阴性(-),2分及以上为阳性(+)。
1.5统计学处理
采用SPSS 17.0软件包对数据进行统计处理,率的比较采用χ2检验;相关性分析采用关联性χ2检验,以P<0.05为差异有统计学意义。H0MA-IR呈非正态分布,经自然对数转换成正态分布后进行统计。
2 结果
2.1NF-κB、COX-2、LKB1在不同子宫内膜组织中的表达
光镜下可见NF-κB、LKB1免疫阳性反应产物沿细胞质内分布,呈棕黄色颗粒状,在细胞核内也有着色。而COX-2免疫阳性反应细胞为细胞质内及核膜出现棕黄色或者棕褐色颗粒,细胞核内未见明显着色,见图1。NF-κB和LKB1在正常子宫内膜组织、非典型增生子宫内膜组织、子宫内膜癌组织中的阳性表达率差异有统计学意义(P<0.05),而COX-2在组间表达差异无统计学意义(P>0.05)。见表1。
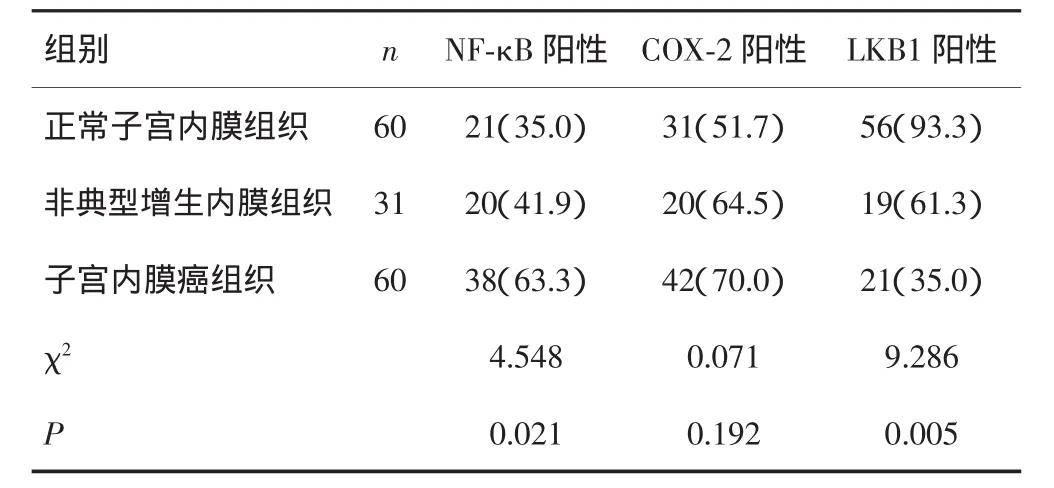
表1 NF-κB、COX-2、LKB1在不同子宫内膜组织中的阳性表达[n(%)]
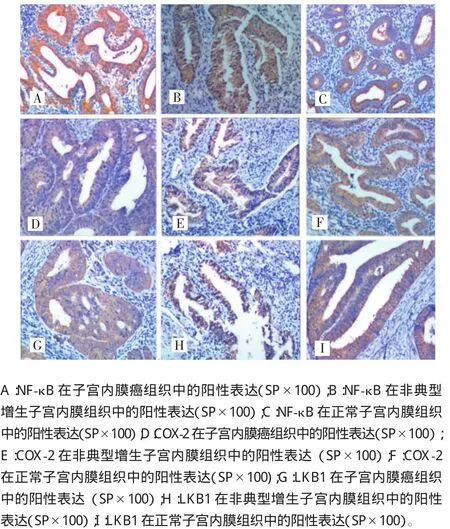
图1 NF-κB、COX-2、LKB1在不同子宫内膜组织中的表达
2.2子宫内膜癌组织中NF-κB、COX-2、LKB1蛋白表达与临床病理特征的关系
子宫内膜癌组织中NF-κB、COX-2、LKB1蛋白表达与病理类型、FIGO分期、淋巴结转移均无关(P>0.05)。NF-κB、COX-2蛋白表达与肌层浸润深度无关(P>0.05),而LKB1蛋白表达与肌层浸润深度相关(P<0.05)。COX-2蛋白表达与组织学分级无关(P>0.05),而NF-κB、LKB1蛋白表达与组织学分级相关(P<0.05)。见表2。
3 讨论
NF-κB是目前已知的重要核转录因子之一,大量研究表明NF-κB可促进肿瘤发生发展。NF-κB靶向基因激活后可导致NF-κB信号增加而抑制细胞凋亡、增殖[5]。COX-2能在细胞膜中将花生四烯酸转化为前列腺素H2(PGH2),进而再转化为前列腺素E2(PGE2)。PGE2能通过自分泌和旁分泌调节参与细胞增殖、分化及凋亡。连接PGE2和肿瘤的主要信号传导通路有Ras-ErK、GSK3β-β-catenin、PI3K-AKT、BCL2、SRC-EGFR及NF-κB通路[6]。在子宫内膜癌中,已有研究发现NF-κB和COX-2被雌激素受体激活后,NF-κB与COX-2相互作用并共同调节细胞转录[7]。这种相互作用是直接的,因为COX-2基因启动子包含了NF-κB的连接位点[8]。Faloppa等[9]研究发现,在子宫内膜癌中,COX-2和NF-κB的表达降低。因此,NF-κB和COX-2信号通路可能在子宫内膜癌发生发展过程中起重要作用。
本研究用免疫组化法检测不同子宫内膜组织中NF-κB的表达,结果发现在子宫内膜癌组织中NF-κB的表达显著高于非癌变组(P<0.05)。NF-κB在非典型增生内膜组织中的表达高于正常子宫内膜组织,提示NF-κB的活化可能是子宫内膜癌的早期事件。NF-κB在子宫内膜癌中的阳性表达与组织分化程度相关,肿瘤分化程度越低,NF-κB的表达越高(P<0.05),但与子宫内膜癌FIGO分期、肌层浸润深度、淋巴结转移及组织病理类型的相关性不显著。推测NF-κB可能参与子宫内膜癌的发生,但与肿瘤的进展及其预后关系不大。
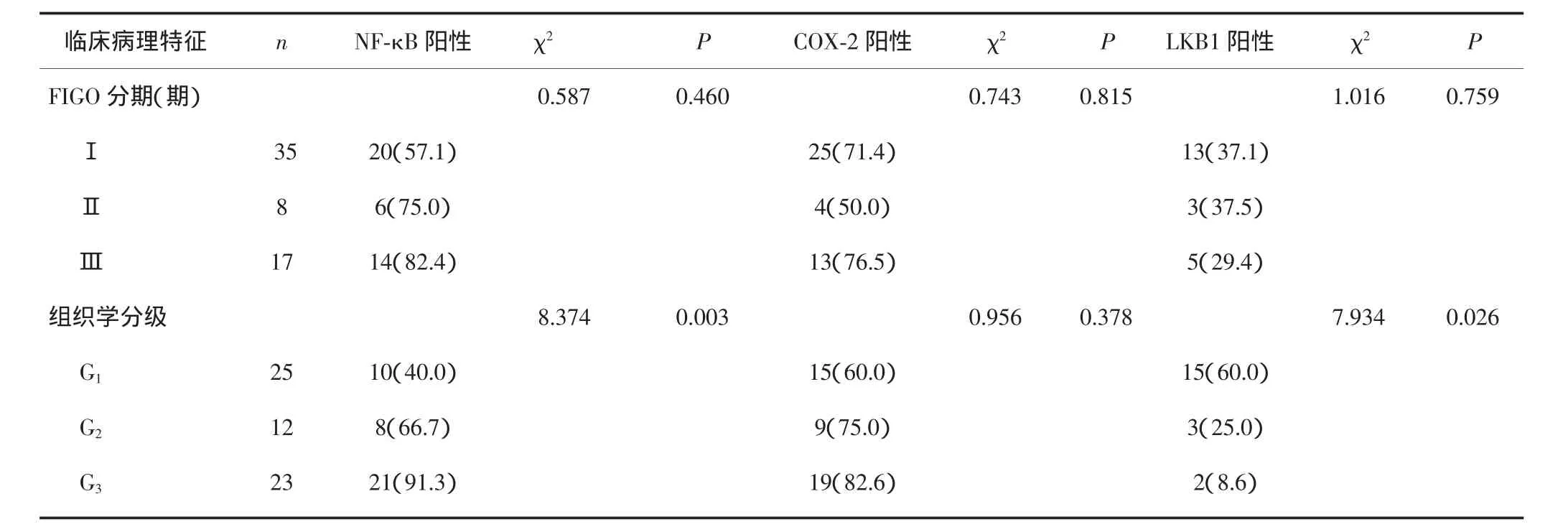
表2 子宫内膜癌组织中NF-κB、COX-2、LKB1蛋白表达与临床病理特征的关系[n(%)]

(续表)
已有研究发现COX-2在多种肿瘤中存在高表达,能促进肿瘤血管生成,与肿瘤侵袭转移密切相关。许多体内外试验证实在胃癌、肠癌、脑癌、肺癌及胰腺癌等多种肿瘤中使用COX-2抑制剂能抗肿瘤血管生成从而起到抗肿瘤增殖作用[10]。在子宫内膜癌中亦观察到COX-2的差异表达,但相关报道结果不一,尚未有统一结论。最近有研究发现子宫内膜癌中COX-2过表达与肿瘤侵袭性相关。Liao等[11]报道,COX-2在非典型增生的子宫内膜中表达增加,间接说明COX-2在子宫内膜非典型增生进展到子宫内膜癌这一过程中起不可忽视的作用。但也有不同的观点,如Cao等[12]研究发现COX-2表达与子宫内膜癌的组织学分化程度呈正相关,而在子宫内膜增生组织中,COX-2低表达,甚至不表达,认为COX-2高表达并不是子宫内膜癌发生的早期事件。本研究结果显示,COX-2在正常子宫内膜、非典型增生子宫内膜和子宫内膜癌中的表达率逐渐升高,但差异无统计学意义(P>0.05)。在子宫内膜癌组织中,COX-2的表达与FIGO分期、组织学分级、肌层浸润深度、淋巴结转移及组织病理类型等均无相关性(P>0.05),提示COX-2可能与子宫内膜癌预后无明显关系。由于COX-2在炎症及肿瘤等病理情况下能被炎症因子、生长因子等诱导,而子宫内膜的周期性变化类似炎症的过程,这可能是导致以上结果的原因之一。因此,COX-2与子宫内膜癌发生发展的相关性有待进一步证实。虽然各学者对于NF-κB、COX-2在子宫内膜癌的发生、发展、浸润及转移过程中的作用有不同结论,但均认为NF-κB、COX-2在子宫内膜癌中的表达与在非癌内膜中有差异表达。
近年来,有关LKB1参与肿瘤的转移机制的研究较多。LKB1是AMP的一个上游激酶,可通过激活AMPK,从而抑制mTOR复合体,最终抑制肿瘤细胞的生长与侵袭。Contreras等[13]研究发现,LKB1基因缺失的雌性小鼠中,有超过50%的小鼠发生子宫内膜癌,说明LKB1能抑制子宫内膜癌的发生。本研究中,LKB1在子宫内膜癌组织中的表达明显低于正常子宫内膜和非典型增生子宫内膜组织(P<0.05)。进一步分析发现,LKB1的表达与组织分化程度和肌层浸润有相关性(P<0.05),提示LKB1与子宫内膜癌侵袭有关。但本研究未发现LKB1表达与子宫内膜癌的FIGO分期、淋巴结转移及组织病理类型有相关性,因此LKB1是否参与子宫内膜癌的转移有待进一步证实。
虽然目前关于NF-κB、COX-2、LKB1在子宫内膜癌中的研究较多,但均以单因素分析为主。本研究同时分析子宫内膜癌组织中NF-κB、COX-2、LKB1的表达与临床病理特征的关系,提示同时检测这三种蛋白的表达可能更有助于探讨子宫内膜癌的发病机制。然而本实验仅分析了三种蛋白的差异表达,对其内在联系及相互作用仍需进一步研究和证实。
[1]Creasman WT,Kohler MF,Odicino F,et al.Prognosis of papillary serous,clear cell,and grade 3 stage I carci-noma of the endometrium. Gynecol Oncol,2004,95(3):593-596.
[2]Dolcet X,Llobet D,Pallares J,et al.NF-κB in development and progression of human cancer[J].Virchows Arch,2005,446(5):475-482.
[3]Turini MF,DuBois RN.Cyclooxygenase-2:a therapeutic target[J]. Annu Rev Med,2002,53:35-57.
[4]Borun P,Bartkowiak A,Banasiewicz T,et al.High resolution melting analysis as a rapid and efficient method of screening for small mutations in the STK11 gene in patients with Peutz-Jeghers syndrome[J]. BMC Med Genet,2013,14:58.
[5]KarinM.Nuclear factor-κB incancer development andprogression[J]. Nature,2006,441:431-436.
[6]Wang D,Dubois N.Eicosanoids and cancer[J].Nature Rev Cancer,2010,10:181-193.
[7]Hirano S,Furutama D,Hanafusa T.Physiologically high concentrations of 17beta-estradiol enhanceNF-kB activity in human T cells[J]. AmJ Physiol Regul Integr Comp Physiol,2007,292(4):1465-1471.[8]Subbaramaiah K,Dannenberg AJ.Cyclooxygenase 2:a molecular target for cancer prevention and treatment[J].Trends Pharmacol Sci,2003,24(2):96-102.
[9]Faloppa CC,Baiocchi G,Cunha IW,et al.NF-κB and COX-2 expression in nonmalignant endometrial lesions and cancer[J].Am J Clin Pathol,2014,141(2):196-203.
[10]WangMT,Honn KV,NieD.Cyclooxygenases,prostanoids,and tumor progression[J].Cancer Metastasis Rev,2007,26:525-534.
[11]Liao CJ,Huang YH,Au HK,et al.The cancer marker neutrophil gelatinase-associated lipocalin is highly expressed in human endometrial hyperplasia[J].Mol Biol Rep,2012,39(2):1029-1036.
[12]Cao QJ,Einstein MH,Anderson PS,et al.Expression of COX-2,Ki-67,cyclin D1,and p21 in endometrial endometrioid carcinomas[J]. Int J Gynecol Pathol,2002,21(2):147-154.
[13]Contreras CM,Gurumurthy S,Haynie JM,et al.Loss of Lkb1 provokes highly invasive endometrial adenocarcinomas[J].Cancer Res,2008,68(3):759-766.
[2016-07-21收稿][2016-10-18修回][编辑江德吉]
NF-κB,COX-2 and LKB1 expression in endometrial cancer tissues and clinical significance
Wang Jianli1,He Junkui2,Pan Yueqiong2,Tang qiaoqiao2,Song Honglin1(1Department of Gynecology Oncology,Affiliated Tumor Hospital of Guangxi Medical University;2Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
Corresponding author:Song Honglin.E-mail:381783170@qq.com
Objective To analyze NF-κB,COX-2 and LKB1 expression in endometrial cancer tissues and normal controls,and assess clinical significance.Methods Immunohistochemistry was used to analyze expression of NF-κB,COX-2 and LKB1 in 60 endometrial cancer tissues,60 normal endometrial tissues from uterine myomas and 31 cases of atypical hyperplasia of endometrium.Possible relationships were explored between NF-κB,COX-2 and LKB1 expression and clinicopathological variables.Results The rate of NF-κB positivity was 63.3%for endometrial cancer tissue,41.9%for normal endometrial tissue,and 35.0%for atypical hyperplasia tissue. The corresponding results for COX-2 positivity were 70.0%,64.5%and 51.7%.The corresponding results for LKB1 positivity were 35.0%,61.3%and 93.3%.Expression of NF-κB and LKB1 varied significantly across the three types of tissue(P<0.05),but expression of COX-2 did not(P>0.05).Expression of none of the three proteins correlated with pathology type,clinical stage or lymph node metastasis;however,LKB1 expression correlated positively with myometrial invasion and histology grade(P<0.05),while NF-κB expression correlated with histology grade(P<0.05).Conclusion NF-κB is over-expressed and LKB1 under-expressed in endometrial cancer tissue.These proteins may be involved in the development and progression of endometrial cancer.
Uterine neoplasms;Endometrial cancer;NF-κB;COX-2;LKB1;Immunohistochemistry;Proten expression;Clinical significance
R737.33
A
1674-5671(2016)05-05
10.3969/j.issn.1674-5671.2016.05.03
广西自然科学基金资助项目(2011GXNSFA018253)
宋红林。E-mail:381783170@qq.com
