臭氧氧化脱硫及化学动力学研究*
2016-11-28邓优王震王寒露
邓优,王震,王寒露
(广东石油化工学院化学工程学院,广东茂名525000)
臭氧氧化脱硫及化学动力学研究*
邓优,王震,王寒露
(广东石油化工学院化学工程学院,广东茂名525000)
为除去燃油中的硫化物,采用了乙腈萃取-臭氧氧化的方法对模拟油(苯并噻吩-正庚烷)进行脱硫。结果表明:臭氧氧化苯并噻吩是零级反应,臭氧从气相传质到液相是反应控制步骤。乙腈作为萃取剂和反应溶剂,不仅可以萃取油品中的硫化物,而且能加快臭氧氧化苯并噻吩类硫化物的反应速率。在常温常压的条件下,将模拟油硫质量分数由200.00 μg/g脱除至78.86 μg/g,脱硫率达62.57%。研究该反应动力学曲线,计算其反应所需活化能为42.58 kJ/mol。
萃取;臭氧;氧化;氧化脱硫
石油是目前人类生存和进步的物质基础,是经济发展的命脉。石油燃烧产生的硫氧化物会导致酸雨等污染,还会使处理汽车尾气的催化剂永久性中毒,大幅度降低尾气处理效果。为保护自然环境和促进人类自身可持续发展,世界各国对液体燃料中硫化物含量的规定更严格,故油品脱硫是不可缺少的环节。脱硫方法主要分为两大类:加氢脱硫和非加氢脱硫。若使用加氢脱硫方法对油品进行深度脱硫,会影响油品的收率及辛烷值。此外,所用催化剂反应条件需要很高的温度和压力,会增加生产成本。在FCC汽油和柴油中,80%以上的含硫物质为噻吩类化合物,尤其是苯并噻吩和二苯并噻吩等,仅依靠加氢手段很难脱除。因此,石油行业专家逐渐将研究重点转移到非加氢脱硫技术[1]。
氧化脱硫(ODS)是近年发展起来的非传统脱硫技术之一。当添加氧化剂时,硫化物易于得到氧原子而被氧化为砜类化合物,极性得到强化,而更容易溶解于极性溶剂中,从而达到从烃类物质中脱除出硫化物的目的[2-3]。油品中有机硫化物的极性较小,萃取脱硫操作中多选用有较高极性的溶剂。张红星[4]利用过氧化氢作为氧化剂,使用1-丁基,3-甲基咪唑六氟磷酸盐作为萃取剂,脱硫率能达到99.8%以上;王强[5]使用三氟乙酸咪唑醋酸盐作为萃取剂,脱硫率达到93.58%。同加氢脱硫相比,氧化脱硫可在常温常压下进行,不需要氢气,生产成本低,对前种方法难以脱除的二苯并噻吩类化合物具有较高的脱硫效率。
本文采用的是乙腈萃取-臭氧氧化脱硫的体系。先于模拟油中通入一定浓度的臭氧,再将其与乙腈混合以进行萃取。在张伟[1]等人的基础上研究得到:在一定温度压力下,乙腈萃取剂油比(萃取剂与模拟油的质量比,下同)为1∶2时最佳,有比较理想的脱硫效果,生产成本较低。在假设臭氧氧化苯并噻吩反应为零级反应的条件下,通过实验获得不同温度下的动力学曲线,计算可得反应的活化能较小,反应速度较快,具有一定的研究价值和发展前景。
1 实验部分
1.1 实验材料和仪器
主要化学试剂有:苯并噻吩(C8H6S)(分析纯,阿拉丁科技有限公司);正庚烷(C7H16)、乙腈(CH3CN)(分析纯,天津光复精细化工公司)。
主要实验仪器有:气相色谱仪(GC9790型,上海福立电器有限公司);臭氧发生器(SH-805-10G/H型,广州盛环科技有限公司);转子流量计(LZB-3WB型,广州盛环科技有限公司);1μL的微量进样器(上海安亭科学仪器厂)。
1.2 模拟油正庚烷-苯并噻吩的制备
称取一定量的苯并噻吩和正庚烷,根据以下公式,称取0.143 g苯并噻吩于烧杯中,用正庚烷溶解,然后倒入至250mL容量瓶中,加入正庚烷定容,配得质量分数为200×10-6的苯并噻吩-正庚烷溶液。将苯并噻吩-正庚烷溶液放于冰箱中保存。
式中:C(S)为硫化物质量分数;m(BT)为苯并噻吩的质量,g;m(C8H18)为正辛烷的质量,g;M(S)为硫的摩尔质量,g/mol;M(BT)为苯并噻吩的摩尔质量,g/mol。
以苯并噻吩模拟油为母液,采用称重法分别稀释配制了质量分数为40×10-6,80×10-6,120×10-6, 160×10-6的标准溶液,加上母液共有5个苯并噻吩模拟油标准溶液。利用GC-9790型气相色谱仪测定油样的色谱图,以油样中的苯并噻吩质量分数为横坐标x,以苯并噻吩色谱的峰面积平均值为纵坐标y绘制散点图,通过线性回归可以得到标准曲线及其拟合方程。拟合方程为:y=26.643x+105.93,R2=0.999 91。苯并噻吩-正庚烷模拟油标准曲线如图1所示。
1.3 硫含量分析方法

图1 苯并噻吩-正庚烷模拟油标准曲线
利用GC-9790型气相色谱仪分析模拟油品中的硫含量。气相色谱条件:进样0.4μL,氮气作为载气。色谱柱长度、直径和膜厚为30m×0.32mm×0.25mm。柱箱温度为150℃,进样器温度为250℃,检测器温度为250℃。
2 结果与讨论
2.1 不同反应条件对臭氧脱硫效果的影响
2.1.1 反应时间对臭氧脱硫效果的影响
将流量为77mL/min、浓度为0.235 25mmol/L的臭氧通入20mL模拟油中,并不断搅拌,在20℃、常压条件下分别反应0.5、1、2、3、4、5min。在反应后的溶液中分别加入10mL乙腈萃取反应产物,剂油比为1∶2,在20℃下持续萃取10min。从图2中可以看出,当反应时间低于3min时,脱硫率随着时间的延长而增大,并在3min时脱硫率达到最大值,为59.78%。当时间超过3min时,脱硫率反而随着时间的推移降低,说明萃取达到平衡。反应在2min时脱硫率为57.45%,与3min相差不大,考虑到时间以及经济效应,故设2min为反应的最佳时间。

图2 反应时间对臭氧脱硫率的影响
2.1.2 反应温度对臭氧脱硫效果的影响
在流量和浓度保持不变的条件下将臭氧通入20mL模拟油中,并不断搅拌。分别在5、10、20、30、40℃五个温度梯度及常压下反应2min。反应后的溶液中各倒入10mL乙腈进行萃取,剂油比为1∶2,在20℃下持续萃取10min。脱硫效果如图3所示。可以看出,当温度低于20℃时,脱硫率随着温度的升高有显著提高。温度为5℃时脱硫率为46.26%,而当温度升高到20℃时脱硫率提高到56.68%,这说明温度对臭氧氧化苯并噻吩的氧化速率影响较大。当温度高于20℃时,脱硫率反而随着温度的升高略有降低,这可能是由于随着温度继续升高,臭氧的分解速度加快,臭氧在油品中的溶解度随着臭氧分解速度加快而下降。因此设定20℃是反应的最佳时间。
2.1.3 剂油比对脱硫效果的影响

图3 反应温度对臭氧脱硫率的影响
从前两步实验可得知反应的最佳时间和最佳温度分别为2min、20℃。选择乙腈作为萃取剂,剂油比梯度分别为1∶0.5、1∶1、1∶2、1∶3、1∶4、1∶5。通入20mL模拟油中,并不断搅拌。在20℃、常压下反应2min,然后倒入不同体积的乙腈萃取剂,在20℃下持续萃取10min。脱硫效果如图4所示。可以看出随着萃取剂的剂油比增大,脱硫率明显增大,这说明乙腈的使用量越高,脱硫效果越好。剂油比从1∶5到1∶0.5范围内,脱硫率从34.93%增加到64.02%,在1∶4到1∶2之间增幅最为明显,当剂油比超过1∶2或者低于1∶4的时候脱硫效果变化并不明显。考虑到经济因素,剂油比选择1∶2较为合理。

图4 剂油比对臭氧脱硫率的影响
2.2 臭氧氧化苯并噻吩的化学动力学研究
假设臭氧氧化苯并噻吩反应为零级反应,根据公式,则其反应速率方程可以表示为:

式中:k为反应速率,min-1;t为反应时间,min;CA为反应达到平衡时硫化物的质量分数。根据Ct=C0-kt,分别在10、15、20、25℃四个温度下拟合反应的零级动力学曲线如图5所示。
各曲线相关拟合方程及相关度分别为:

可以看出,各方程拟合曲线相关系数均在0.99以上。根据各直线的斜率,可得各温度下的反应速率。由速率单位换算成mmol/(L・min),则反应速率分别为0.130 75、0.166 80、0.234 1、0.321 4mmol/(L・min)。根据阿伦尼乌斯方程ln k=-Ea/(RT)+ln k0,通过各温度下反应速率拟合-ln k对1/T的相关曲线,如图6所示。

图5 不同反应时间下硫化物质量分数随温度的变化
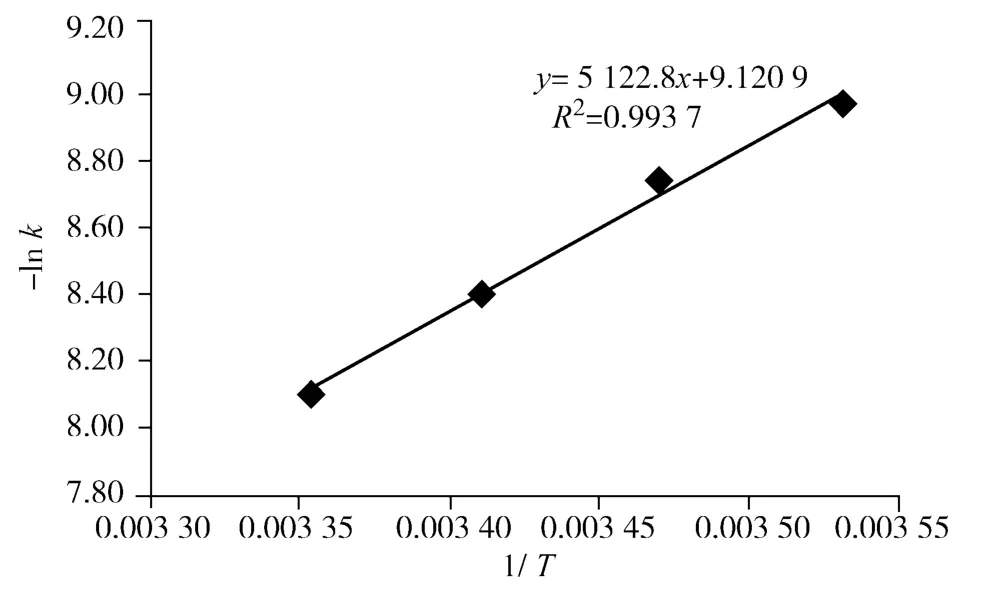
图6 -ln k对1/T作图
由此计算反应的活化能为Ea=k′×(-R)=5122×8.314×10-3=42.58 kJ/mol。由计算得到的活化能可知,该反应活化能较小,因此普通分子变为活化分子所需能量较小,活化分子所占比率变大,则反应速率常数就变大,反应速度增大。这也进一步解释了为何臭氧能在较短时间内氧化苯并噻吩并达到平衡。前人研究发现,H2O2氧化苯并噻吩的活化能约为80~90 kJ/mol[5-6]。对比可知,臭氧氧化脱硫活化能相对H2O2氧化脱硫的脱硫率更低,因此,臭氧氧化深度脱硫因其达到平衡时间较短,所需能量较低。
3 结论
本文采用臭氧氧化-乙腈萃取的方法对模拟油进行脱硫实验,对不同反应条件对氧化-萃取体系脱硫率的影响进行了研究。
(1)乙腈是一种良好的萃取剂,在模拟油-乙腈萃取体系中臭氧的氧化脱硫率较高。研究发现,当温度为20℃、反应时间为2min、乙腈萃取剂和模拟油质量比为1∶2时,脱硫率可以达到62.57%。
(2)臭氧氧化苯并噻吩反应时间较短,在3min内即可反应完全,达到平衡。
(3)对臭氧氧化苯并噻吩动力学进行研究,经计算得知反应活化能为42.58 kJ/mol。
[1]张伟.分子氧氧化法深度脱除燃油中有机硫研究[D].广州:华南理工大学,2014.
[2]Brown K N,Espenson J H.Stepwise Oxidation of Thiophene and Its DerivatIves by Hydrogen Peroxide Catalyzed by Methyltrioxorhenium(VII)[J].Inorganic Chemistry,1996,35(25):7211-7216.
[3]Zhu W,Li H,Jiang X,et al.Oxidative Desulfurization of Fuels Catalyzed by Peroxotungsten and Peroxomolybdenum Complexes in Ionic Liquids[J].Energy Fuels,2007,21(5):2514-2516.
[4]张红星.模型油中噻吩类硫化物的氧化和吸附脱硫方法研究[D].北京:北京化工大学,2012.
[5]王强.功能型离子液体的制备、性质及其在催化裂化汽油深度脱硫中的应用研究[D].上海:华东师范大学,2013.
[6]Te M,Fairbridge C,Ring Z.Oxidation Reactivities of Dibenzothiophenes in Polyoxometalate/H2O2and Formic Acid/H2O2Systems[J].Applied Catalysis a-General,2001,219(1-2):267-280.
A Study of Ozone Sulfur Oxide and Chemical Kinetics
DENG You,WANG Zhen,WANG Hanlu
(College of Chemical Engineering,Guangdong University of Petrochemical Technology,Maoming 525000,China)
To remove the sulfides in fuel,the research of oxidation extraction desulfurization is conducted by using themethod of ozone oxidation-acetonitrile extraction withmodel oil(benzothiophene-heptane).The results show that the ozone oxidation of benzothiophene is a zero order reaction,and ozone transferring from gas to liquid phase is the rate control step.Acetonitrile,as an extraction agent and solvent,can not only extract benzothiophene frommodel oil,but also speed up ozone oxidation of benzothiophene.Under normal temperature and pressure,the sulfur content of themodel oil is reduced from 200.00 μg/g to 78.86 μg/g,and the desulfurization rate is 62.57%.The reaction kinetics curve indicates that the activation energy required for the reaction is 42.58 kJ/mol.
Extraction;Ozone;Oxidation;Desulfurization
X701.3
A
2095-2562(2016)01-0004-04
(责任编辑:梁晓道)
2015-10-19;
2015-11-28
国家自然科学青年基金(21403038);广东省攀登计划(pdjh2015b0367);茂名市科技计划(2014084)
邓优(1995—),男,湖北安陆人,在读本科,主要从事臭氧氧化脱硫研究工作。
王寒露(1981—),女,湖南湘潭人,博士,副教授,主要从事催化化学与计算化学研究。
