低氧预适应减轻缺氧所致大鼠海马神经元线粒体膜改变*
2016-11-26张志发廖明锋罗爱林田玉科王学仁
陈 堃, 张志发, 廖明锋, 李 璐, 罗爱林, 田玉科, 王学仁
华中科技大学同济医学院附属同济医院麻醉科,武汉 430030
低氧预适应减轻缺氧所致大鼠海马神经元线粒体膜改变*
陈 堃, 张志发, 廖明锋, 李 璐, 罗爱林, 田玉科, 王学仁△
华中科技大学同济医学院附属同济医院麻醉科,武汉 430030
目的 通过观察低氧预适应处理对缺氧引起的神经元bcl-2表达、线粒体膜电位变化的影响,探讨低氧预适应处理对神经元缺氧性损伤保护作用的机制。方法 原代培养大鼠海马神经元细胞,分组处理后,采用免疫组织化学法对细胞bcl-2表达进行检测;采用罗丹明123染色测定线粒体膜电位,激光共聚焦扫描显微镜观察缺氧条件下各组细胞的线粒体膜电位变化。结果 低氧预处理组海马神经细胞在急性缺氧1 h复氧后,bcl-2表达阳性率为(74.5±9.8)%,较缺氧对照组(69.5±10.3)%明显提高,差异有统计学意义(P<0.05);线粒体膜电位测定发现,与缺氧对照组比较,低氧预处理组从缺氧第80 s开始,各时间点线粒体膜电位均高于缺氧对照组(均P<0.05)。结论 低氧预适应处理对原代培养大鼠海马神经元缺氧性损伤保护作用可能是通过增加缺氧后bcl-2表达,从而稳定线粒体膜,减慢神经元急性缺氧时线粒体膜电位降低的速度来实现的。
低氧预处理; 大鼠海马神经元; bcl-2; 线粒体膜电位
神经元对缺氧非常敏感,在研究神经元缺血缺氧损伤时发现预适应对神经元有保护作用[1],即短时间的脑缺血可以对其后的非致死性脑缺血损伤起保护作用[2],神经元预适应保护作用产生的分子机制目前尚不明确,既往的研究多数通过预适应引起的神经细胞内信号传递通路的改变来探讨[3-4]。
缺血缺氧时细胞内Ca2+浓度升高可导致线粒体功能障碍、线粒体去极化和线粒体通透性转换孔(mitochondrial permeability transitional pore,MPTP)开放,引起细胞死亡。线粒体是细胞产能的重要细胞器,并在调控细胞内Ca2+浓度中处于中心地位,由此推测,线粒体可能在预适应引起的神经保护作用中扮演非常重要的角色[5]。bcl-2基因所编码的膜内蛋白普遍存在于线粒体、内质网和核膜[6],脑缺血可以诱导bcl-2表达,其过表达可以增强神经元抗缺氧能力[7]。因此本实验通过观察低氧预适应处理对缺氧引起的神经元bcl-2表达、线粒体膜电位变化的影响,探讨低氧预适应处理对神经元缺氧性损伤保护作用的线粒体机制。
1 材料与方法
1.1 主要试剂
胎牛血清、马血清购于Gibco公司,DMEM/F12购于HyClone公司,0.25%胰蛋白酶-EDTA消化液和青、链霉素混合液、谷氨酰胺购于Solarbio公司,bcl-2免疫组化试剂盒购于武汉博士德公司,罗丹明123染料购于Sigma公司,ATP生物发光试剂盒购于Boehringer Mannheim公司。
1.2 实验方法
1.2.1 大鼠海马神经元原代培养 详细见参考文献[8],简述如下:取当天新生Wistar大鼠(同济医学院实验动物学部提供),消毒后分离出双侧海马并剪碎,0.125%胰蛋白酶37℃消化30 min、过滤、离心、接种于24孔培养板,置于37℃ 10%CO2培养箱,3~5 d后,加入细胞分裂抑制剂阿糖胞苷3 μg/mL,抑制非神经细胞增殖。培养7~11 d备用。种植培养液:DMEM/F12 80%、胎牛血清10%、马血清10%、青链霉素1%、谷氨酰胺100 μg/mL;饲养培养液:DMEM/F12 90%、马血清10%、青链霉素1%、谷氨酰胺100 μg/mL。
1.2.2 实验分组 分为正常对照组、缺氧对照组和低氧预处理组。正常对照组神经元置于37℃常氧(69%N2+21%O2+10%CO2)恒温容器中培养;缺氧对照组神经元则置于密闭的37℃无氧(90%N2+10%CO2)恒温容器中培养;低氧预处理组自细胞培养后第5天起,每天将培养的神经元置于密闭的37℃低氧(89%N2+1%O2+10%CO2)恒温容器中30 min,总共处理5 d。
1.2.3 bcl-2免疫组织化学染色 培养5 d的缺氧对照组和低氧预适应处理组置于密闭的37℃无氧恒温容器中作缺氧处理1 h后,置于正常培养条件下24 h后行多聚甲醛固定,按以下程序行免疫组织化学染色:①0.03%H2O2甲醇室温下孵育30 min,正常单血清(1:10)37℃作用1 h;②加入兔抗bcl-2血清(1:100)中4℃孵育72 h;③生物素化羊抗兔IgG(1:100)37℃作用1 h;④链霉亲和素-生物素复合物(1:100)37℃作用1 h,用葡萄糖氧化酶-硫酸镍胺法显色10 min。免疫组织化学图像分析:随机抽取50个相邻视野,在显微镜下分别计数视野中bcl-2免疫反应阳性和阴性神经元数目,计算阳性神经元所占百分率。应用TTTY-400TC真彩色细胞图像分析仪对各组阳性神经元进行平均吸光度分析。1.2.4 神经细胞内ATP含量测定 对照组和低氧预处理组置于密闭的37℃无氧(90%N2+10%CO2)恒温容器中缺氧处理1 h后,PBS冲洗3遍,用细胞匙刮下细胞,配成2 mL的细胞悬液,摇匀后1 mL用于测定蛋白质含量,1 mL用ATP生物发光试剂盒于LKB1251型生物发光仪测ATP含量。
1.2.5 线粒体膜电位测定 取溶于DMSO的罗丹明123染料加入培养7~11 d的神经细胞培养液中,终浓度为5 mg/L,避光于37℃孵育45 min,用37℃人工脑脊液冲洗培养皿2遍,置于Bio-Rad MRC600型激光共聚焦显微镜下,激光激发峰488 nm,发射峰525 nm,每40秒采集1次。以缺氧前最后一次采集的荧光强度为100%,缺氧后各时间点的值与之比较得出各自的数值(百分比表示)。
1.3 统计学分析

2 结果
2.1 低氧预适应处理对急性缺氧后再复氧诱导海马神经元bcl-2表达的影响
经低氧预适应处理后的培养海马神经元在1 h急性缺氧再复氧24 h后,bcl-2表达阳性的细胞数明显多于缺氧对照组,表达量较缺氧对照组明显增强,图像分析显示,低氧预处理组平均吸光度值明显高于缺氧对照组(P<0.05)(图1,表1)。

A:培养7 d的正常对照细胞;B:缺氧对照组细胞;C:低氧预处理组细胞;图中白色箭头所示为染色阳性细胞图1 海马神经元bcl-2蛋白表达(×400)Fig.1 Expression of bcl-2 in rat hippocampal neurons(×400)

组别nbcl⁃2阳性细胞(%)平均吸光度值正常对照组714.30±2.50 0.12±0.03缺氧对照组669.50±10.30∗0.66±0.21∗低氧预处理组674.50±9.80∗#1.01±0.16∗#
与正常对照组比较,*P<0.05;与缺氧对照组比较,#P<0.05
2.2 低氧预适应处理提高缺氧时海马神经元胞内ATP水平
低氧预适应处理后的海马神经元在1 h急性缺氧后,其细胞内ATP含量为[(1.23±0.45) μmol/g蛋白质],与缺氧对照组海马神经元细胞内ATP含量[(0.65±0.23) μmol/g蛋白质]相比较,差异有统计学意义(P<0.05)。
2.3 低氧预适应处理对缺氧时海马神经元线粒体膜电位变化的影响
罗丹明123的荧光信号主要集中于线粒体,其荧光强度的变化反映了线粒体膜电位(ΔΨm)的变化。如图2所示,自缺氧第80 s开始,缺氧对照组(n=6)神经元线粒体膜电位明显低于正常对照组(n=7,P<0.05),随时间推移,线粒体膜电位逐渐降低,各时间点测量荧光强度之间具有显著性差异。而经过低氧预处理培养的海马神经元(n=7),从缺氧第80 s开始,线粒体的荧光强度即明显高于缺氧对照组(均P<0.05),提示低氧预处理可以减慢缺氧时海马神经元膜电位的降低速度。
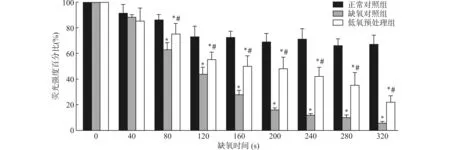
与正常对照组比较,*P<0.05;与缺氧对照组比较,#P<0.05图2 低氧预适应处理改变缺氧时海马神经元线粒体膜电位Fig.2 Effect of hypoxic preconditioning on the mitochondrial membrane potential(ΔΨm)in hippocampal neurons exposed to acute anoxia
3 讨论
缺血缺氧导致神经细胞内Ca2+浓度升高、线粒体去极化进而MPTP开放,细胞死亡,说明线粒体功能障碍在神经元缺氧损伤发生过程中起着重要作用[8-10]。有研究提示线粒体在预适应引起的神经保护作用中起非常关键的作用[5],因此应该了解线粒体在应对外界缺血缺氧刺激时功能是否正常。检测线粒体膜电位(ΔΨm)是研究线粒体功能的主要手段,ΔΨm代表的氢离子跨膜电化学梯度占总呼吸能量的90%[11]。可以通过荧光染料或者电化学探针来测量ΔΨm,我们是通过亲脂性阳离子荧光染料罗丹明123的荧光强度的变化来检测ΔΨm。神经元缺血缺氧损伤可以导致细胞坏死或凋亡[7],bcl-2是线粒体的调节因子,可以抑制缺氧导致的神经元凋亡。ΔΨm主要由线粒体膜的通透性决定,bcl-2是位于线粒体膜蛋白,在调控线粒体膜通透性中起着非常重要的作用,可以防止线粒体膜电位的耗散,抑制缺氧引起的凋亡发生[9-10,12]。
本研究发现低氧预处理可以增加神经元在缺氧条件下bcl-2表达,可以减慢缺氧时线粒体膜电位降低的速度。因此低氧预适应对神经元的保护可能是通过增加bcl-2表达,从而稳定线粒体膜通透性进而稳定线粒体膜电位来实现的。
[1] Lu G W,Yu S,Li R H,et al.Hypoxic preconditioning a novel intrinsic cytoprotective strategy[J].Mol Neurobiol,2005,31(1-3):255-271.
[2] Kirino T.Ischemic tolerance[J].J Cereb Blood Flow Metab,2002,22(11):1283-1296.
[3] Stenzel-Poore M P,Stevens S L,King J S,et al.Preconditioning reprograms the response to ischemic injury and primes the emergence of unique endogenous neuroprotective phenotypes:a speculative synthesis[J].Stroke,2007,38(Suppl 2):680-685.
[4] Gidday J M.Cerebral preconditioning and ischaemic tolerance[J].Nat Rev Neurosci,2006,7(6):437-448.
[5] Sisalli M J,Annunziato L,Scorziello A.Novel cellular mechanisms for neuroprotection in ischemic preconditioning:A view from inside organelles[J].Front Neurol,2015,6:155.
[6] Gimenez-Cassina A,Danial N N.Regulation of mitochondrial nutrient and energy metabolism by Bcl-2 family proteins[J].Trends Endocrinol Metab,2015,26(4):165-175.
[7] Ivana P,Katarina K,Maria C,et al.Possible contribution of proteins of Bcl-2 family in neuronal death following transient global brain ischemia[J].Cell Mol Neurobiol,2015,35(1):23-31.
[8] 王学仁,刘卫,袁世荧,等.氯胺酮对培养大鼠颈上交感神经元烟碱样乙酰胆碱受体门控电流的影响[J].中华麻醉学杂志,2011,31(7):809-811.
[9] Jonas E.Molecular participants in mitochondrial cell death channel formation during neuronal ischemia[J].Exp Neurol,2009,218(2):203-212.
[10] Gross A.BCL-2 family protein as regulators of mitochondia metabolism[J].Biochim Biophys Acta,2016,1857(8):1243-1246.
[11] Palmeira C M,Rolo A P.Mitochondrial membrane potential(ΔΨ)fluctuations associated with the metabolic states of mitochondria[J].Methods Mol Biol,2012,810:89-101.
[12] Soane L,Fiskum G.Inhibition of mitochondrial neural cell death pathways by protein transduction of Bcl-2 family proteins[J].J Bioenerg Biomembr,2005,37(3):179-190.
(2016-06-22 收稿)
Effect of Hypoxic Preconditioning on Anoxia-induced Changes in Mitochondrial Membrane Potential in Rat Hippocampal Neurons
Chen Kun,Zhang Zhifa,Liao Mingfeng et al
Department of Anesthesiology,Tongji Hospital,Tongji Medical College,Huazhong University of ScienceandTechnology,Wuhan430030,China
Objective To investigate the effect of hypoxic preconditioning(HP)on anoxia-induced expression of bcl-2 and mitochondrial membrane potential(ΔΨm)in rat hippocampal neurons in an attempt to understand the mechanism by which HP protects against anoxia-induced neuronal injury.Methods Primary rat hippocampal neurons were cultured,subjected to HP and then to acute hypoxia.The expression of bcl-2 was measured by immunohistochemistry,and the mitochondrial membrane potential by rhodamine-123 staining and laser confocal scanning microscopy.Results ①After 1-hour acute anoxia and then reoxygenation,the positive expression rate of Bcl-2 was(74.5±9.8)% in hippocampal neurons,significantly higher than that in anoxia control group(69.5±10.3)%(P<0.05).②The mitochondrial membrane potential was significantly increased in HP group as compared with anoxia control group at detected time points after 80-second anoxia(P<0.05).Conclusion HP protects hippocampal neurons against anoxia-induced injury by increasing the expression of bcl-2,stabilizing the mitochondrial membrane potential and slowing down the decrease of the mitochondrial membrane potential in acute anoxia.
hypoxic-preconditioning; rat hippocampal neuron; bcl-2; mitochondrial membrane potential
*国家自然科学基金资助项目(No.81371251);国家临床重点专科建设项目
R363.2
10.3870/j.issn.1672-0741.2016.05.005
陈 堃,男,1981年生,主治医师,医学博士,E-mail:xiangfanck@163.com
△通讯作者,Corresponding author,E-mail:xrwang@hust.edu.cn
