线粒体分裂抑制剂通过抑制自噬加重OGD/R损伤
2016-11-25彭程张磊饶维费舟第四军医大学西京医院神经外科陕西西安710032
彭程 张磊 饶维 费舟 (第四军医大学西京医院神经外科,陕西 西安 710032)
·脑血管疾病研究·
线粒体分裂抑制剂通过抑制自噬加重OGD/R损伤
彭程 张磊 饶维 费舟*
(第四军医大学西京医院神经外科,陕西 西安 710032)
目的探讨线粒体分裂抑制剂(Mdivi-1)处理对原代培养的皮层神经元缺血再灌注损伤的作用及其机制研究。方法在原代培养的小鼠皮层神经元上建立氧糖剥夺/复氧复糖(OGD/R)模型模拟体内缺血再灌注损伤,根据再灌注时间长短检测自噬的发生情况,并进一步选取自噬发生最明显的时间点。然后分别采用自噬抑制剂-3-MA、自噬激动剂-雷帕霉素(rapamycin)、Mdivi-1以及联合rapamycin和Mdivi-1进行干预,分别从mRNA以及蛋白水平检测自噬相关分子的改变,并同时检测神经元损伤情况。结果OGD/R处理后,神经元自噬随再灌注时间增长而上调,在OGD 2 h/R 24 h时,Beclin 1以及微管相关轻链蛋白3 II/I(LC3 II/I)比值均达峰值(P<0.001,P<0.01)。细胞活力结果显示,rapamycin可减轻OGD/R损伤(P<0.01),Mdivi-1则会加重OGD/R损伤(P<0.05),但rapamycin可通过增加自噬来减轻Mdivi-1造成的损伤(P<0.05)。蛋白检测结果显示,OGD/R处理后,Mdivi-1可明显降低神经元细胞内Beclin 1和LC3 II的表达(P<0.05)。结论Mdivi-1可能通过抑制自噬的发生,从而加重神经元OGD/R损伤。
脑缺血再灌注损伤; 线粒体分裂; 自噬
线粒体作为细胞的能量工厂,在机体生理以及病理条件下都发挥着至关重要的作用。其一直处于不断分裂以及融合的动态平衡之中,而这种平衡一旦失调就会引起线粒体形态以及功能的损伤,从而导致机体发生各种病理性改变[1]。目前已有文献研究表明,线粒体的动态平衡失调在脑缺血再灌注I/R损伤中发挥重要作用,但其具体的调控机制仍不明确。近来,自噬作为神经退行性疾病中的研究热点,不但被证实在脑I/R损伤中具有一定的保护性作用,而且大量研究发现其与线粒体分裂过程密切相关[2]。自噬是通过自噬小体-自噬溶酶体系统对自身细胞内异常的细胞器和代谢产物进行吞噬降解的生理过程,对维持细胞生长以及机体发育具有重要作用,并被认为是细胞进行自我保护的一种重要机制[3]。为进一步研究线粒体动态平衡在脑I/R损伤中的具体作用机制,本次研究利用小鼠的原代神经元细胞建立氧糖剥夺后再复氧模型(oxygen-glucose deprivation/reperfusion, OGD/R),采用线粒体分裂抑制剂进行干预,并进一步结合自噬相关抑制剂和激动剂,分别提取RNA和蛋白质,检测Beclin 1、 微管相关轻链蛋白3 II (microtubule-associated protein light chain 3 II, LC3 II) 等自噬相关分子的表达改变,进而通过研究自噬探讨线粒体分裂在脑I/R损伤中过程发挥的作用,阐明自噬是否可作为线粒体动态平衡与脑I/R损伤的研究桥梁。
材料与方法
一、主要试剂及抗体
NeurobasalTM、B27、谷氨酰胺、双抗(100 IU/ml青霉素、100 μg/ml链霉素)、改良Eagle培养基(Dulbecco's modified Eagle's medium, DMEM)、无糖培养基(Gibco);3-甲基腺嘌呤(3-methyladenine, 3-MA)、雷帕霉素(rapamycin)、Mdivi-1(Sigma);兔源性LC3 II抗体、兔源性Beclin 1抗体、鼠源性β-actin抗体(cell signaling technology);Trizol、RNA反转录试剂盒、实时定量 PCR试剂盒(Takara);Cell counting kit-8(上海生工)。
二、小鼠原代皮层神经元培养
冰上颈椎脱臼处死孕15 d左右的C57BL/6小鼠,分离、剪开子宫,取出胎鼠并放于空培养皿中。显微镜下取胎鼠脑皮层组织,置于含有预冷的磷酸盐缓冲液(phosphate buffer solution, PBS)的小培养皿中,剪碎后用0.25%胰蛋白酶37℃消化30 min后终止消化。玻璃滴管火焰抛光后,轻柔吹打。用DMEM培养基稀释成5×105/mm3的密度接种到经多聚赖氨酸包被的培养皿中,孵育4~6 h后,显微镜下观察神经元贴壁后,改用含B27和谷氨酰胺的Neurobasal继续培养箱内培养。以后每3 d半量换液一次,培养10~12 d左右,待神经元成熟后用于实验。整个过程中注意不用剧烈晃动神经元,否则可能造成轴突断裂,影响神经元状态。
三、OGD/R模型的制备
取成熟的原代神经元,将培养液更换为无糖培养基。将细胞置于缺氧孵箱中,通入5% CO2和95% N2的混合气,使孵箱内氧浓度低于1%。培养2 h后,将培养基换为含B27和谷氨酰胺的Neurobasal培养液,再置于正常孵箱内孵育不同指定时间。
四、细胞活力检测(cell counting kit-8, CCK-8)
同时种植于两个96孔板培养的神经元一板为OGD/R(-)组,另一板为OGD/R(+)组。按指定分组加入相应药物,药物浓度如下:Mdivi-1 (100 μM)、3-MA (10 mM)、rapamycin (100 nM)。OGD 2 h后加入相应药物,再进行复氧(R)。复氧24 h后,每100 μl培养基中加入10 μl CCK-8工作液。2~4 h后,酶标仪450 nm波长处检测各孔的吸光度值。按照公式计算神经元细胞活力:细胞活力=(实验组-空白组)/(对照组-空白组)× 100 %。
五、实时定量 PCR检测
按照Trizol RNA提取试剂盒说明书,提取神经元细胞总RNA,并用紫外分光光度仪测量RNA浓度。以总RNA为模板,按照说明书步骤逆转录为合成cDNA,再以cDNA为模板按Tap酶说明书进行PCR扩增。引物均由Takara设计合成,Map1lc3上游引物:5-GCG CTT GCA GCT CAA TGC TA-3,下游引物:5-GTA CAC TTT CGG AGA TGG GAG TGG-3;Beclin 1上游引物:5-GGG TCA CCA TCC AGG AAC TCA-3,下游引物:5-CAC CAT CCT GGC GAG TTT CA-3;GAPDH上游引物:5-GGG TCA GAA GGA TTC CTA TG-3,下游引物:5-GGT CTC AAA CAT GAT CTG GG-3。结果以GAPDH为内参进行比较,计算各个基因mRNA水平的改变。
六、蛋白质免疫印迹检测(Western blot)
轻轻吸净培养皿中培养液,并用PBS洗1~2遍,然后加入混有1%蛋白酶抑制剂的裂解液充分裂解细胞,12 000 r/min离心25 min后吸上清。用二喹啉甲酸(bicinchoninic acid, BCA)定量后于12% SDS凝胶上电泳分离,上样量为20 μg,再转印至硝酸纤维素膜上,用5%脱脂牛奶室温封闭1~2 h,然后分别用LC3 II一抗 (1 ∶1 000 )、Beclin 1 (1 ∶2 000) 一抗和β-actin(1 ∶5 000)一抗4℃孵育过夜。用含0.1%Tween20的PBS充分洗膜,然后二抗室温孵育1 h,再用PBS充分洗膜,最后用增强的化学发光液发光。用Gel-pro分析软件进行分析各个条带的灰度值,并以β-actin作为内参进行比较,得出各个基因蛋白水平的改变。
七、统计学处理
数据均采用GraphPad Prism 6软件进行统计分析。所得数据均以均数±标准误(mean±SEM)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间多重比较采用LSD-t检验。所有数据比较,P< 0.05认为有统计学差异。
结 果
一、在原代培养的小鼠皮层神经元中,OGD/R处理后自噬发生上调
原代培养的小鼠脑皮层神经元OGD/R处理后,观察到的结果与国外学者研究相一致,发现原代神经元内Beclin 1蛋白表达水平随复氧处理的时间延长而显著升高,在本研究中复氧时长最长观察到24 h,此时Beclin 1蛋白水平升高至峰值(P<0.001)(图1 A, B)[4]。同样,在OGD/R处理下,LC3 II/I比值在复氧6 h 后开始显著升高,并在12 h和24 h 时达到峰值(P<0.01)(图1 A, C)。进一步通过实时定量 PCR检测Beclin 1和Map1lc3在mRNA水平的改变,发现两者的变化趋势与各自蛋白表达的变化趋势基本一致,也均有显著改变(图1 D, E)。结果提示,OGD/R处理后,神经元自噬上调。

图1 Western blot和RT-PCR检测OGD/R后自噬相关分子表达
Fig 1 Autophagy related molecules were detected by Western blot and RT-PCR
A: Beclin 1, LC3 II/I and β-actin were detected by Western blot; B: Quantity of Beclin 1 detected by Western blot (aP<0.05,bP<0.01,cP<0.001,dP<0.001, all of themvsnormal group); C: Quantity of LC3 II/I detected by Western blot (aP<0.05,bP<0.01,cP<0.01, all of themvsnormal group); D: Quantity of Beclin 1 detected by RT-PCR (aP<0.05,bP<0.05,cP<0.01,dP<0.01,eP<0.01, all of themvsnormal group); E: Quantity of Map1lc3 detected by RT-PCR (aP<0.05,bP<0.01,cP<0.01, all of themvsnormal group).
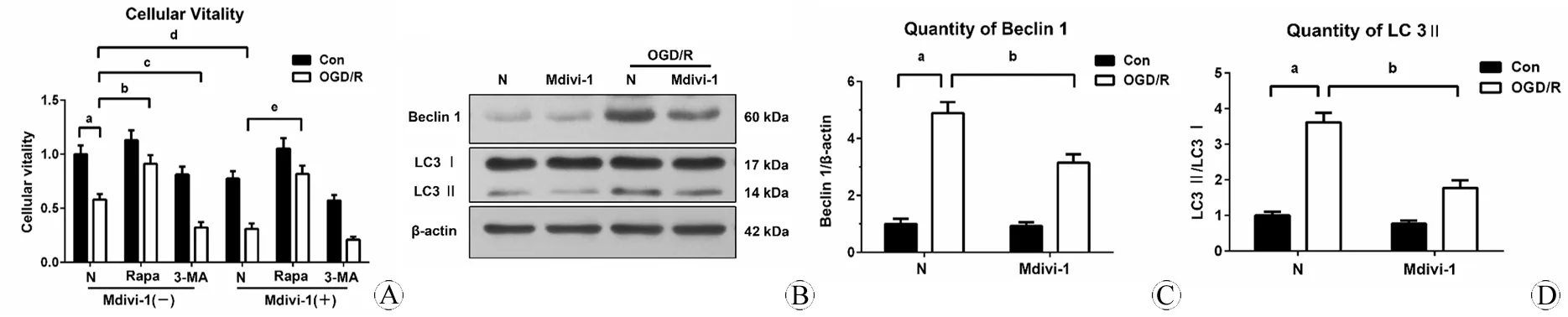
图2 检测各不同处理组的细胞活力和Mdivi-1对自噬相关分子的影响
Fig 2 Detection of cellular vitality in all groups and role of Mdivi-1 on autophagy related molecules
A: Cellular vitality in different groups were detected by CCK-8 (aP<0.01, Mdivi-1(-): NvsOGD/R;bP<0.01, Mdivi-1(-): OGD/RvsOGD/R-Rapa;cP<0.05, Mdivi-1(-): OGD/RvsOGD/R-3-MA;dP<0.05, OGD/R: Mdivi-1(-)vsMdivi-1(+);eP<0.05, Mdivi-1(+): OGD/RvsOGD/R-Rapa); B: Beclin 1 and LC3 II/I were detected by Western blot after treatment of Mdivi-1 and OGD/R;C: Quantity of Beclin 1 detected by Western blot (aP<0.001, N-ConvsN-OGD/R;bP<0.05, OGD/RvsOGD/R-Mdivi-1); D: Quantity of LC3 II/I detected by Western blot (aP<0.01, NvsOGD/R;bP<0.05, OGD/RvsOGD/R-Mdivi-1).
二、线粒体分裂抑制剂通过抑制自噬发生,进而加重OGD/R损伤
Mdivi-1是线粒体分裂抑制剂,它抑制了线粒体分裂蛋白(dynamin-related protein 1, Drp1)向线粒体迁移,从而抑制了Drp1介导的线粒体分裂功能。在本研究中,选取自噬最为活跃的时间点OGD 2 h/R 24 h作为OGD/R的处理条件,观察研究神经元损伤情况以及Mdivi-1对其影响。CCK-8结果显示:OGD/R处理后,神经元细胞活力下调(P<0.01),在添加自噬抑制剂3-MA后,细胞活力下调更为明显(P<0.05);然而当自噬激动剂rapamycin存在时,细胞活力有明显改善(P<0.01)。采用Mdivi-1干预后,结果显示:OGD/R处理后,添加Mdivi-1组神经元活力较未添加Mdivi-1组明显下调(P<0.05);但是研究发现,在添加rapamycin后,Mdivi-1组细胞活力上调(P<0.05)。上述结果提示,OGD/R处理后,Mdivi-1对神经元活力的影响与3-MA相似,同时其对细胞活力的影响可被rapamycin改善。
为进一步研究Mdivi-1是否通过影响自噬进而参与OGD/R损伤机制,利用Western blot检测了其对自噬相关分子的影响。结果显示:在OGD/R损伤中,Mdivi-1可明显降低Beclin 1(P<0.05, 图2 B,C)和LC3 II的表达(P<0.05, 图2 B,D)。上述Western和CCK-8结果共同提示,OGD/R处理后,Mdivi-1可通过降低自噬从而加重损伤。
讨 论
自噬是目前在退行性疾病中较为热门的研究方向,其与阿尔茨海默病 (Alzheimer disease)、帕金森病(Parkinson's disease)以及脑缺血疾病的关系已有国内外文章相继报道[5]。目前,多数研究认为自噬是维持细胞正常状态的生理过程,但在一些外界刺激的作用下,自噬也会通过清除细胞内受损的细胞器或一些多余的代谢产物对细胞起到一定保护作用[6]。体内和体外的研究均表明,在脑I/R损伤中,细胞会启动自噬清除机制,从而减轻损伤[7]。线粒体在I/R损伤以及自噬中都发挥重要作用,而近来有学者发现,线粒体也可介导自噬(线粒体自噬,mitophagy),其在自噬中占有很大比重,尤其是在缺血缺氧的病理疾病中,线粒体自噬发挥着重要作用[3]。然而,线粒体不仅能介导诱发线粒体自噬过程,而且其内的特定分子还可参与自噬体膜的形成,从而促进自噬发生[8]。无论是线粒体介导的线粒体自噬还是线粒体参与形成的自噬,两者均与线粒体的正常功能密切相关。而线粒体的融合与分裂的动态平衡则是维持线粒体功能的基本过程,一旦这种平衡发生紊乱,线粒体功能就会受损,那么与线粒体相关的各种生理或病理进程都将受到影响[9]。线粒体的融合与分裂是两个相反的过程,而本研究的主要关注点是线粒体分裂相关过程。Mdivi-1是一种特异性的线粒体分裂抑制剂,其作用靶点就是调控线粒体分裂的重要蛋白-Drp1[10]。J Grohm等提出Mdivi-1可以减少OGD/R引起的凋亡,从而起到神经保护性作用[11]。这一结果与本研究并不矛盾,在上述研究与本研究中,Mdivi-1的使用时间和浓度有显著区别。Ikeda, Y等证实:长时间、高浓度量Mdivi-1可抑制Drp1向线粒体迁移,从而抑制线粒体分裂,其所起作用与Drp1敲除相似[2]。所以在本研究中,为了有效达到抑制Drp1的效果,从而使用的是较高浓度的Mdivi-1。
本研究在原代培养的神经元OGD/R模型中,通过联合Mdivi-1与自噬抑制剂/激动剂进行干预,探讨自噬在Mdivi-1与OGD/R损伤中的机制。结果提示,首先证实在OGD 2 h/R 24 h处理条件下,自噬上调且对神经元I/R损伤起适应性保护作用;结合模型进一步观察到100 μM的Mdivi-1可加重神经元OGD/R损伤,其机制可能为抑制了Drp1向线粒体转运,使线粒体分裂功能受损,进而抑制了自噬的发生,加重I/R损伤。因此,在OGD/R处理后,抑制线粒体分裂可通过抑制自噬发生,从而加重OGD/R损伤,为预防I/R损伤的进一步损伤提供了新靶点。
1Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy [J]. Autophagy, 2012, 8(4): 445-544.
2Ikeda Y, Shirakabe A, Maejima Y, et al. Endogenous Drp1 mediates mitochondrial autophagy and protects the heart against energy stress [J]. Circ Res, 2015, 116(2): 264-278.
3Klionsky DJ, Emr SD. Autophagy as a regulated pathway of cellular degradation [J]. Science, 2000, 290(5497): 1717-1721.
4Zhang X, Yan H, Yuan Y, et al. Cerebral ischemia-reperfusion-induced autophagy protects against neuronal injury by mitochondrial clearance [J]. Autophagy, 2013, 9(9): 1321-1333.
5Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues [J]. Cell, 2011, 147(4): 728-741.
6Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion [J]. Nature, 2008, 451(7182): 1069-1075.
7Urbanek T, Kuczmik W, Basta-Kaim A, et al. Rapamycin induces of protective autophagy in vascular endothelial cells exposed to oxygen-glucose deprivation [J]. Brain Res, 2014, 1553: 1-11.
8Hailey DW, Rambold AS, Satpute-Krishnan P, et al. Mitochondria supply membranes for autophagosome biogenesis during starvation [J]. Cell, 2010, 141(4): 656-667.
9Karbowski M, Youle RJ. Dynamics of mitochondrial morphology in healthy cells and during apoptosis [J]. Cell Death Differ, 2003, 10(8): 870-880.
10Chang CR, Blackstone C. Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1 [J]. Ann N Y Acad Sci, 2010, 1201: 34-39.
11Grohm J, Kim SW, Mamrak U, et al. Inhibition of Drp1 provides neuroprotection in vitro and in vivo [J]. Cell Death Differ, 2012, 19(9): 1446-1458.
MitochondrialfissioninhibitoraggravatesOGD/R-inducedinjurythroughinhibitionofautophagy
PENGCheng,ZHANGLei,RAOWei,FEIZhou
DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032, China
ObjectiveThe objective of the research is to study the roles and mechanisms of mitochondrial fission inhibitor (Mdivi-1) in primary cultured cortex neurons of mice after Oxygen-glucose deprivation/Reperfusion (OGD/R) injury.MethodsOccurrence of autophagy was detected after establishing OGD/R model in primary cultured cortex neurons. The mRNA and protein levels of autophagy-related genes were detected accompanied treatment with autophagy inhibitor (3-MA), autophagy agonist (rapamycin) and Mdivi-1. Moreover, the neural injury was measured.ResultsFollowing OGD/R treatment, autophagy was increased dependent on reperfusion times. And both levels of Beclin 1 and Microtubule-associated protein light chain 3 II (LC3 II) peaked at 24 h (P<0.001,P<0.01). Results of cell counting kit-8 (CCK-8) after OGD/R treatment showed that Mdivi-1 could aggravate the injury (P<0.05), however, rapamycin could reduce not only the OGD/R injury (P<0.01), but also the aggravating damage induced by Mdivi-1 (P<0.05). Furthermore, Mdivi-1 significantly reduced the levels of Beclin 1 and LC3 II following OGD/R injury (P<0.05).ConclusionMdivi-1 could aggravate the injury induced by OGD/R through inhibiting the occurrence of autophagy.
Cerebral ischemia/reperfusion injury; Mitochondrial fission; Autophagy
1671-2897(2016)15-101-04
R 651.15
A
国家自然科学基金资助项目(81430043)
彭程,医师,博士研究生,E-mail: doctorpc@163.com
*通讯作者: 费舟,教授、主任医师,博士生导师,E-mail: feizhou@fmmu.edu.cn
2015-09-14;
2015-12-20)
