幕上IDH突变型低级别胶质瘤MRI特征与病理相关研究
2016-11-25张劲松尚磊叶菁张广文赵永波王彦刚第四军医大学西京医院放射科统计学教研室病理学教研室西京医院神经外科陕西西安700
张劲松 尚磊 叶菁 张广文 赵永波 王彦刚 (第四军医大学: 西京医院放射科; 统计学教研室; 病理学教研室; 西京医院神经外科, 陕西 西安 700)
幕上IDH突变型低级别胶质瘤MRI特征与病理相关研究
张劲松1尚磊2叶菁3张广文1赵永波1王彦刚4*
(第四军医大学:1西京医院放射科;2统计学教研室;3病理学教研室;4西京医院神经外科, 陕西 西安 710032)
目的分析对比幕上异柠檬酸脱氢酶(IDH)突变型及野生型低级别胶质瘤的影像学特征,并与病理相关指标进行统计及相关性分析。方法手术及病理证实82例低级别胶质瘤(WHOⅡ级),其中IDH突变型39例,IDH1野生型43例,术前行核磁共振影像(MRI)增强扫描61例,按照无强化、轻度强化、中度强化、重度强化分别进行统计,并与增殖细胞核抗原Ki-67(Ki-67)标记 指数、钙黏蛋白(CD34)CD34及1号染色体短臂/19号染色体长臂(1p/19q)杂合性联合缺失(co-deleiton)情况进行统计及相关性分析。结果IDH突变低级别胶质瘤好发于右侧额叶,其次为右侧颞叶和左侧颞叶,IDH野生型低级别胶质瘤好发于左侧额叶,其次为左侧颞叶和右侧颞叶,经Fisher's Exact Test检验,二者间有统计学差异(P<0.05)。肿瘤IDH是否突变导致的肿瘤强化程度、Ki-67、CD34及1p/19q联合缺失差异均无统计学意义(P>0.05)。肿瘤强化程度与Ki-67指标呈正相关性(Spearman秩相关分析),与CD34和1p/19q联合缺失,无统计学意义的相关性。结论IDH1突变低级别胶质瘤具有显著的好发部位,以右侧额叶为主,右侧颞叶其次,低级别胶质瘤无论IDH是否突变其常规增强MRI表现无明显差异。
核磁共振增强扫描; 胶质瘤; 异柠檬酸脱氢酶
2008年,Parsons等[1]发现异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)突变与脑胶质瘤的诊断、治疗及预后判断有着非常重要的意义。随后研究发现,IDH突变胶质瘤的预后明显好于IDH野生型胶质瘤,IDH1可能成为新的化疗靶点[2]。因此,如何术前诊断胶质瘤是否发生IDH1突变具有重要的临床意义。近来,有作者通过基于体素的症状性病灶图(voxel based symptomatic lesion map, VLSM)分析处理方法发现TP53突变的低级别胶质瘤特异性地发生在右侧颞极及左侧颞岛叶[3]。那么, IDH突变的胶质瘤是否也具有自己的定位特点呢?此外,现有研究表明,IDH突变能够通过增加低氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)水平及活性增加血管生成,后者是否会导致其影像增强表现出一定的特殊性?另外,IDH1突变与肿瘤分级和预后相关,是否也与Ki-67增殖指数相关呢?为此,本文对此进行了相关研究。
对象及方法
一、一般性资料
回顾性分析2012年11月至2015年9月住院并手术证实为幕上低级别胶质瘤(均为WHOⅡ级)82例,全部在本院行IDH基因检测,其中IDH突变病例39例,包括弥漫星形细胞瘤12例,少突胶质瘤8例,少突星形细胞胶质瘤19例;无IDH突变(野生型)病例43例,包括弥漫星形细胞瘤17例,少突胶质瘤10例,少突星形细胞胶质瘤16例。临床表现主要为头痛,部分表现为癫痫、恶心、呕吐及肢体感觉活动障碍等症状。
二、影像学资料
患者术前全部行CT和/或MRI检查,其中61例在本院行增强MRI(其它为外院资料无法回顾),包括IDH突变组27例,IDH野生型组34例。增强MRI采用Trio Tim3.0T磁共振仪(Siemens公司),扫描参数为:重复时间(repetition time, TR) 440 ms,回波时间(echo times, TE) 25 ms,视野(field of view, FOV)22 cm,矩阵256×256,层厚5 mm,层间距0 mm,钆喷酸葡胺(gadolinium-diethylenetriaminepentaacetic acid, Gd-DTPA) 对比剂 静脉注射,剂量0.1 mmol/kg,注药后即行 T1WI 矢、冠、轴位增强扫描。图像分析:由两名高年资影像科医师分别评估病灶的大小、部位及强化程度,如果不一致时进行协商统一意见。其中,病灶大小只测量肿瘤实性部分最大径,病灶强化程度的评判标准:选取肿瘤最大强化区域作为感兴趣区(region of interest, ROI)进行测量,采用病灶增强后信号强度减去病灶增强前信号强度计算肿瘤信号强化程度(signal degree of contrast, SDC),同时计算病灶增强前后图像的背景噪声差(noise of difference, ND)以校正计算误差,最终将校正后的肿瘤信号强化程度按照计算值分为无强化(<10)、轻度强化(10~100)、中度强化(100~300)、重度强化(>300)进行分类统计。
三、病理学资料
所有胶质瘤手术标本,均采用10%中性福尔马林固定,常规石蜡包埋和HE染色,病理诊断由两名高资历病理医师完成。胶质瘤的Ki-67标记指数、CD34和IDH(R132H)免疫组化染色由罗氏全自动免疫组化机完成。采用荧光原位杂交技术检测胶质瘤1p/19q联合缺失,探针为LSI 1p36 /LSI 1q25和LSI 19q13 /19p13 Dual Color Probe(美国Vysis公司)。此外,所有胶质瘤IDH1/2基因突变情况,均采用测序方法进行。
四、统计分析
采用SPSS 19.0软件及相应统计学方法分析IDH突变型组与野生型组在发病年龄、性别、病灶大小、发病部位、强化程度以及各种病理学检查指标间的统计学差异。
结 果
一、发病年龄与性别因素
1.发病年龄:IDH突变组平均年龄(41.2±9.9)岁,IDH野生组平均(40.5±10.2)岁,经组间t检验,t=0.303,P=0.762,两组间无明显统计学差异。
2.发病性别:IDH突变病例中男20例、女19例, IDH野生型病例中男30例、女13例,经卡方检验,χ2=7.098,P=0.01,两组间差异具有统计学意义。
二、病灶大小及发病部位
1.肿瘤病灶大小:IDH突变组(5.2±1.5)cm,IDH野生型组(5.0±1.7)cm,采用独立样本t检验,t=0.890,P=0.376,两组间差别无统计学意义。
2.发病部位:IDH突变组中32例累及单个脑叶,7例累及2个及多个脑叶,以右侧额叶和颞叶为主要发病部位;IDH野生型组中31例累及单个脑叶,12例累及2个及多个脑叶,以左侧额叶和颞叶为主要发病部位。两组间发病部位存在明显统计学差异(表1,P=0.001)。本组病例顶枕叶发生率低,且多合并其它部位共同受累,IDH突变组病例未累及双侧枕叶。
三、病灶强化程度
两组病灶的强化程度的统计结果见表2,经卡方检验,χ2=6.599,P=0.086,两组间无统计学差异。
表1 IDH突变组与IDH野生型组肿瘤发生部位的统计学差异(例, %)
Tab 1 Statistical difference of tumor locations between IDH+ and IDH- group(n, %)
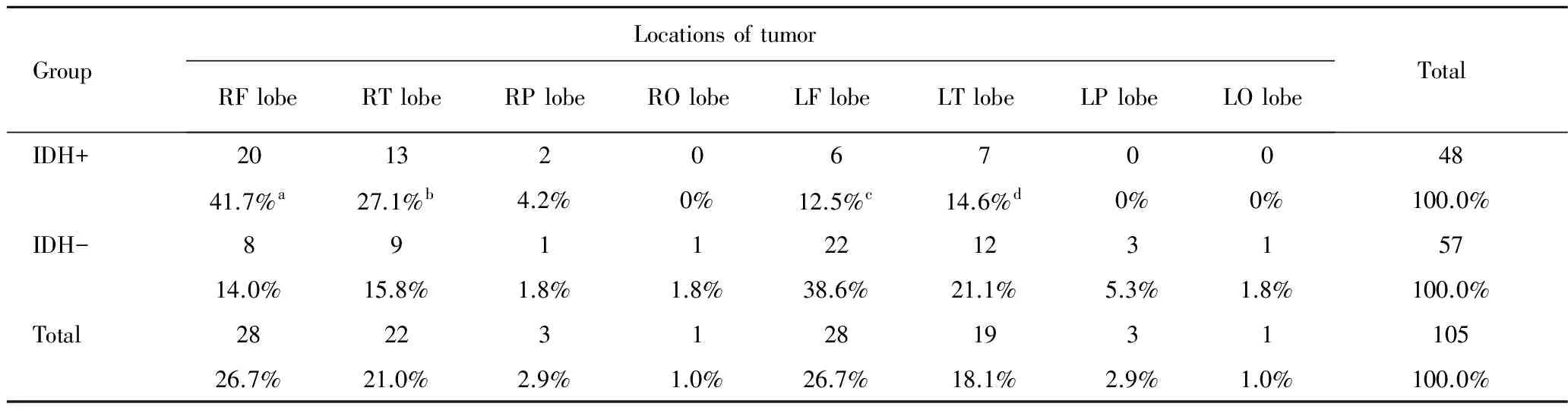
GroupLocationsoftumorRFlobeRTlobeRPlobeROlobeLFlobeLTlobeLPlobeLOlobeTotal IDH+201320670048 41.7%a27.1%b4.2%0%12.5%c14.6%d0%0%100.0% IDH-891122123157 14.0%15.8%1.8%1.8%38.6%21.1%5.3%1.8%100.0% Total282231281931105 26.7%21.0%2.9%1.0%26.7%18.1%2.9%1.0%100.0%
Fisher's Exact Test, χ2= 20.669
aP<0.01,vsIDH-;bP<0.01,vsIDH-;cP<0.01,vsIDH-;dP<0.01,vsIDH-
Not: RF: right frontal; RT: right temperal; RP: right parietal; RO: right occipital; LF: left frontal; LT: left temperal; LP: left parietal; LO: left occipital; IDH+ means IDH1 mutation; IDH-means IDH1 wild-type.
表2 IDH突变组与IDH野生型组病灶MR强化程度比较(例)
Tab 2 Comparison of enhancement of tumors in contrast-enhanced MRI between IDH+ and IDH- group (n)

GroupDegreeofenhancement NoneSlightMediumSevereTotal IDH+group7146027 IDH-group15124334 Total222610361
Chi-Square Tests, χ2=6.599,P=0.086
IDH+ means IDH mutation; IDH-means IDH wild-type
四、病理学指标间比较及与病灶强化程度的相关性分析
1.CD34表达:CD34是血管标志物,可以观察胶质瘤中血管的数量。IDH突变组共检测29例(29/39),其中阳性10例,阴性19例;IDH野生型组检测27例(27/43),其中,阳性10例,阴性17例,采用卡方检验比较,χ2=0.040,P=0.842,其差别无统计学意义。
2.Ki-67指数:所有病例均进行检测,IDH突变组平均值为8.1%±7.1%,IDH野生型组平均值为5.8%±4.2%,采用独立样本t检验,t=2.041,P=0.054,两组间ki67指数无统计学差异。
3.1p/19q联合缺失:IDH突变组检测19例,其中有缺失14例,无缺失5例;IDH野生型组检测11例,其中有缺失9例,无缺失2例,采用卡方检验比较,χ2=0.258,P=0.612,两组无统计学差异。
4.病灶强化程度与病理指标间的相关分析:Spearman秩相关分析发现,ki-67指数和增强程度间秩相关系数(rs=0.288,P=0.020)两者间有正相关关系。经Fisher's Exact Test检验比较CD34阳性组与阴性组间增强程度的差异,结果显示χ2=1.899,P=0.636,两者间差异无统计学意义。采用Mann-Whitney U检验,1p/19q联合缺失与病灶强化程度的差异比较,结果显示统计检验量40.5,P=0.895,即1p/19q联合缺失所导致的病灶强化差异无统计学意义。
总之,在IDH突变组和野生组间,肿瘤强化程度与相关病理指标间均无明显统计学差异。
讨 论
Parson等[1]最早证实,发生IDH突变的胶质瘤患者与未发生突变的患者相比表现出不同的临床特点及预后。Yan等[1]对恶性胶质瘤患者的研究显示:大于70%的WHO Ⅱ~Ⅲ级星形细胞瘤与少突胶质细胞瘤均发生 IDH突变,较野生型相比表现出更好的治疗效果及预后。Houillier等[4]发现,1p/19q联合缺失、IDH突变或者两者均存在时,这些因素均可以作为影响替莫唑胺化疗临床反应结果的独立预测指标,说明IDH突变是对临床化疗反应的一个重要预测指标。因此,目前研究倾向IDH突变是一种与胶质瘤密切相关的癌基因,伴有IDH 基因突变的肿瘤具有独特的遗传学和临床特点。本组病例共纳入82例低级别胶质瘤,其中IDH突变发生率约为47.6%,与Qi等[5]报道相似40%~50%,但低于欧美等国的发生率为50%~ 90%[6,7],目前我们尚不清楚其中原因。本组IDH突变型与野生型间发病年龄无明显差别,不同于Metellus等[8]报道的IDH野生型发病年龄相对偏大。但是,在发病性别方面,本组病例显示IDH野生型组更好发于男性,且结果具有统计学意义。
Metellus[8]最早发现IDH野生型胶质瘤好发于额颞岛叶,并且肿瘤的体积相对较大。Qi等[9]进一步发现IDH突变型胶质瘤很少发生于手术风险高的区域如脑干或间脑,而主要发生于额颞叶相对容易手术切除的部位。 Sonoda[10]也证实IDH突变的间变性胶质瘤仅发生于大脑皮层。从本组病例看,也具有一些类似的特点,如IDH突变的低级别胶质瘤仅发生在大脑,为了便于对比,本组去除了一些发生在幕下的IDH野生型低级别胶质瘤。此外,本组病例发现IDH突变与否会导致显著的侧别定位的差异,IDH突变型胶质瘤好发于右侧额颞叶,而IDH野生型胶质瘤则好发于左侧额颞叶,二者定位具有显著性差异。
关于肿瘤强化特点:研究[9]发现IDH突变胶质瘤倾向于单侧生长、信号较均匀,强化相对较弱,相应侵袭性较低。这种强化的差异在胶质母细胞瘤中更加明显[11]。本组病例均为低级别胶质瘤(WHOⅡ级),血脑屏障破坏相对较轻,因此强化程度相对较低。其中,IDH突变组主要表现为无或轻中度强化,IDH野生型虽然出现了3例重度强化,但大多数也只表现出无或轻度强化,两组间并无统计学差异。此外,本研究发现病灶强化程度与ki-67指数呈正相关,这也再次证明通过增强扫描是可以在一定程度上反映胶质瘤的良恶性程度的。同时,IDH突变可能与胶质瘤细胞增殖活性相关,虽然本组病例ki-67指数在IDH突变组和无突变组间并无统计学差异,但结果已经表现出IDH突变组为(8.1%±7.1%)高于IDH野生型组(5.8%±4.2%)的趋势。为了进一步明确强化程度与肿瘤血管的关系,本组分析了CD34(反映血管增生指标)与肿瘤强化程度之间的关系,但是没有发现统计学差异,这一方面可能是由于低级别胶质瘤的微血管增生程度本身不高,IDH突变产生的区别相对较小,另一方面,由于MR增强扫描主要反映肿瘤血脑屏障的破坏程度,无法显示增生的肿瘤微小血管,因此更降低了病灶强化程度与CD34之间的相关性,进一步的研究可以采用MR灌注扫描等方法来显示肿瘤新生微小血管。
IDH突变常并发1p/19q 联合缺失[7,12],1p/19q 联合缺失也是预后较好的独立因素。少突胶质细胞瘤合并IDH突变和1p/19q联合缺失常累及额叶或岛叶,并倾向表现出强化较弱、边缘模糊的影像特点[13]。本组并未发现肿瘤强化程度与1p/19q 联合缺失之间存在统计学差异,可能与检测数量不足、肿瘤级别较低有关。
本文的局限性主要是由于回顾性研究,样本可能存在偏倚,另外,样本数还不够大,部分检查不全、数量偏少,结论尚需更多数据加以验证。
1Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme [J]. Science, 2008, 321(5897): 1807-1812.
2Leu S, von Felten S, Frank S, et al. Idh/mgmt-driven molecular classification of low-grade glioma is a strong predictor for long-term survival [J]. Neuro Oncol, 2013, 15(4): 469-479.
3Wang YY, Zhang T, Li SW, et al. Mapping p53 mutations in low-grade glioma: A voxel-based neuroimaging analysis [J]. AJNR Am J Neuroradiol, 2015, 36(1): 70-76.
4Houillier C, Wang X, Kaloshi G, et al. Idh1 or idh2 mutations predict longer survival and response to temozolomide in low-grade gliomas [J]. Neurology, 2010,75(17): 1560-1566.
5Qi ST, Yu L, Lu YT, et al. Idh mutations occur frequently in chinese glioma patients and predict longer survival but not response to concomitant chemoradiotherapy in anaplastic gliomas [J]. Oncol Rep, 2011,26(6):1479-1485.
6Hartmann C, Meyer J, Balss J, et al. Type and frequency of idh1 and idh2 mutations are related to astrocytic and oligodendroglial differentiation and age: a study of 1,010 diffuse gliomas [J]. Acta Neuropathol, 2009, 118(4): 469-474.
7Kim W, Liau LM. Idh mutations in human glioma [J]. Neurosurg Clin N Am, 2012, 23(3): 471-480.
8Metellus P, Coulibaly B, Colin C, et al. Absence of idh mutation identifies a novel radiologic and molecular subtype of who grade ii gliomas with dismal prognosis [J]. Acta neuropathol, 2010, 120(6): 719-729.
9Qi S, Yu L, Li H, et al. Isocitrate dehydrogenase mutation is associated with tumor location and magnetic resonance imaging characteristics in astrocytic neoplasms [J]. Oncol Lett, 2014, 7(6): 1895-1902.
10Sonoda Y, Shibahara I, Kawaguchi T, et al. Association between molecular alterations and tumor location and mri characteristics in anaplastic gliomas [J]. Brain Tumor Pathol, 2015, 32(2): 99-104.
11Wang K, Wang Y, Fan X, et al. Radiological features combined with idh1 status for predicting the survival outcome of glioblastoma patients [J]. Neuro Oncol, 2015, 25. pii: nov239. [Epub ahead of print].
12Labussiere M, Idbaih A, Wang XW, et al. All the 1p19q codeleted gliomas are mutated on IDH1 or IDH2 [J]. Neurology, 2010, 74(23): 1886-1890.
13Xiong J, Tan W, Wen J, et al. Combination of diffusion tensor imaging and conventional mri correlates with isocitrate dehydrogenase 1/2 mutations but not 1p/19q genotyping in oligodendroglial tumours [J]. Eur Radiol, 2015, 22. [Epub ahead of print].
RelationshipbetweenMRimagingfeaturesandpathologicchangesinhumansupratentoriallowgradegliomaswithIDHmutation
ZHANGJinsong1,SHANGLei2,YEJing3,ZHANGGuangwen1,ZHAOYongbo1,WANGYangang4
1DepartmentofRadiology,XijingHospital;2DepartmentofHealthStatistics;3DepartmentofPathology;4DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032, China
ObjectiveThe imaging features and related pathological indicators between the Isocitrate dehydrogenase (IDH) mutation group and wild-type group in human superatentorial low grade gliomas are investigated.MethodsA total of 82 cases of gliomas (WHO grade Ⅱ) confirmed by surgery were involved, including 39 cases of IDH mutation and 43 cases of IDH wild type. Sixty-one cases of them were performed contrast enhanced MRI before operation. Degrees of tumors' enhancement including none, slight, medium and severe enhancement were recorded respectively and its relationship with pathological indicators such as proliferating cell nuclear antigen Ki-67(Ki-67), cadherin CD34 (CD34) and 1p/19q co-deletion by SPSS 19.0 software was analyzed.ResultsLow grade gliomas with IDH mutation likely occurred in right frontal lobe and then right and left temporal lobe, while IDH wild type group likely occurred in left frontal lobe and then left and right temporal lobe. There was significant difference between two groups by Fisher's Exact Test(P<0.05).There were no significant differences in enhancement degree, Ki-67, CD34 and the short arm of chromosome 1 /the long arm of chromosome 19 (1p/19q) co-deletion between IDH mutation group and IDH wild type group (P>0.05). There was positive correlation between degree of enhancement and Ki-67 index (rs=0.288,P=0.020, Spearman rank correlation analysis). There were no significant differences between enhancement degree and CD34 or 1p/19q co-deletion.ConclusionLow grade glioma with IDH mutation have marked tendency to occur in right frontal lobe and then temporal lobe. There is no significant difference in enhancement degree between IDH mutation group and IDH wild type group in low grade gliomas.
Contrast enhanced MR; Low grade glioma; IDH
1671-2897(2016)15-140-04
·论著·
R 739
A
陕西省自然科学基础研究计划资助项目(2014JM4099)
张劲松,副教授、副主任医师,E-mail: zhangjs@fmmu.edu.cn
*通讯作者: 王彦刚,副教授、副主任医师,E-mail: yg-wang@163.com
2015-10-20;
2015-12-30)
