性成熟前期尼罗罗非鱼雌雄性别生长差异与性类固醇激素水平比较
2016-11-24岳蒙蒙赵金良唐首杰赵永华
岳蒙蒙,赵金良,唐首杰,王 燕,赵永华
(上海海洋大学 农业部淡水水产种质资源重点实验室,上海 201306)
性成熟前期尼罗罗非鱼雌雄性别生长差异与性类固醇激素水平比较
岳蒙蒙,赵金良*,唐首杰,王 燕,赵永华
(上海海洋大学 农业部淡水水产种质资源重点实验室,上海 201306)
利用分子标记法、醋酸洋红压片法、组织切片技术等方法进行个体性别鉴定,比较了性成熟前期(0.5~4.0月龄)尼罗罗非鱼雌、雄鱼生长差异,并检测了2.5~4.0月龄雌、雄鱼血清睾酮(T)、雌二醇(E2)激素含量。结果发现,雌、雄鱼全长、体质量分别自3.0月龄、2.5月龄开始出现差异显著(P<0.05)。Logistic拟合全长、体质量生长方程为:Lt(♀)=16.443/(1+e(2.821-1.363*t)),Lt(♂)=18.248/(1+e(2.752-1.295*t));Wt(♀)=107.704/(1+e(5.157-1.464*t)),Wt(♂)=134.796/(1+e(5.080-1.417*t)),雌、雄鱼体质量生长拐点分别为3.523、3.585月龄,拐点体质量分别为52.352、67.398 g。雄鱼全长、体质量生长速度始终大于雌鱼,雄鱼快速增长期区间长度、体质量增加量大于雌鱼。2.5月龄之后,雌、雄鱼E2含量差异显著(P<0.05),3.0月龄之后,雌、雄鱼T含量差异显著(P<0.05),推测E2、T含量差异是引起尼罗罗非鱼雌雄性别生长差异的原因之一。
尼罗罗非鱼;雌雄性别;性类固醇激素
雌雄生长差异是雌雄异体动物两性异形(sexual dimorphism)的重要表现之一[1]。鱼类中,两性生长差异也有不同类型,如鲆鲽类鱼类,一般是雌性生长快于雄性[2],而罗非鱼则相反,雄性快于雌性[3],还有一些鱼类,某一发育阶段雌鱼生长快、另一发育阶段则是雄鱼生长快[4-5]。由于鱼类两性生长间存在明显差异,生产上常利用单性苗种养殖,提高养殖产量[6]。
尼罗罗非鱼(Oreochromisniloticus)因生长快、繁殖周期短、适应性强等特点,成为我国主要淡水养殖鱼类之一。性成熟阶段,尼罗罗非鱼雌、雄鱼生长差异显著,雄鱼比雌鱼生长快20%~48%[3];鱼类性别生长差异可能与性腺发育、性类固醇激素分泌水平存在某种密切关联,但关于何时产生雌雄生长差异及差异原因却鲜有报道。研究表明,尼罗罗非鱼性别分化约在孵化后30 d内完成,性腺成熟约在孵化后100~130 d[7]。为此,本研究利用性别分子标记法、性腺组织醋酸洋红压片法、H.E染色法、性腺及生殖孔观察等方法,对0.5~4.0月龄尼罗罗非鱼个体进行性别鉴定,研究性成熟前雌、雄鱼的生长发育规律,及性类固醇激素(睾酮T、雌二醇E2)含量水平。通过拟合雌、雄鱼生长方程、生长曲线,分析雌、雄鱼生长显著差异的时间阶段,以及性类固醇激素水平与雌、雄鱼生长差异间的关联性,以期为尼罗罗非鱼雌雄性别生长规律提供基础生物学资料,也为其合理养殖提供科学依据。
1 材料与方法
1.1 材料
尼罗罗非鱼取自于上海海洋大学罗非鱼种质资源试验站,为新吉富罗非鱼。选择2015年5月30日出苗的同批鱼苗在水泥池(7.7 m×3.9 m×1.3 m)中培育,养殖密度依苗种规格逐步调整,饲料选用宁波天邦公司罗非鱼专用配合饲料,每日投喂两次,时间分别为8:00、18:00。每15 d抽样一次,每次随机采集60尾鱼。
1.2 方法
1.2.1 全长、体质量测量
对全部抽取样本进行常规生物学测量,用游标卡尺测量全长(精确至0.1 mm),体质量使用电子天平测量(精确至0.01 g)。
1.2.2 性别鉴定
分子标记法:0.5~1.0月龄个体,剪取尾鳍保存于无水乙醇中,采用动物组织基因组DNA快速提取试剂盒提取DNA。用微量分光光度计测定浓度并用无菌水稀释至20 ng·μL-1,-20 ℃冰箱备用。性别分子标记选择参照Sun等[8],Marker-5引物序列:Marker-5F TAAATTAATGACATTTCAGTTATG;Marker-5R CAGAAATGTAGACGCCCAGGTATC,由生工生物工程(上海)有限公司合成。PCR反应体系为10 μL:上下游引物(10 μmol·L-1)各0.5 μL;模板DNA 1.0 μL;2×TaqPCR Master Mix 5.0 μL,ddH2O 3.0 μL。反应条件为:94 ℃ 3 min; 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,34个循环;72 ℃ 10 min。产物进行1.5%琼脂糖凝胶电泳,凝胶成像系统拍照,根据扩增特异条带鉴定性别。
醋酸洋红压片法:1.5~2.0月龄个体,采用醋酸洋红压片法鉴别(SC/T1105—2007《罗非鱼鱼种性别鉴定方法》)。鱼苗腹腔注射5%冰醋酸溶液0.2~0.3 mL,30 s后剪开腹部,取出性腺组织。将性腺组织放在预先滴有醋酸洋红溶液的载玻片上,再滴入1滴结晶紫乙醇溶液,染色3~5 min,盖上盖玻片,轻轻压平性腺。在Olympus BX41显微镜下观察,根据生殖细胞大小、排列方式等特征进行性别鉴定。
组织切片法:2.0~3.0月龄个体,解剖后取性腺组织,用Bouin’s液固定。经石蜡包埋后,常规切片,厚度5~6 μm,H.E染色、脱水,中性树胶封片。Olympus BX41显微镜下观察。
性腺、生殖孔外观观察法:3.0~4.0月龄个体,解剖后取性腺,外观观察进行性别鉴定;或直接通过生殖孔外观观察鉴定性别。
1.2.3 生长方程拟合
生长曲线模型能反映个体生长发育的变化规律,雌、雄鱼全长—体质量关系用幂函数关系式W=aLb表示;W是体质量,L是全长,a和b是参数。
选用逻辑斯蒂(Logistic)方程拟合尼罗罗非鱼雌、雄鱼的生长曲线,描述雌、雄鱼生长特征。
Logistic :Lt=a/(1+e(b-k×t)),Wt=a/((1+e(b-k×t)f)
拐点月龄b/k;拐点体质量a/2;最大月增重即一阶导数dW/dt=kW/2;在上述模型中,t表示月龄,Lt表示t时全长,Wt表示t时体质量,a、b、k、f 为方程参数,生长参数估算采用三点法及最小二乘法[9]。
1.2.4 性类固醇激素含量测定
2.5~4.0月龄,采用断尾采血或尾柄静脉抽血1~2 mL,4 ℃冰箱中静置3~4 h。待血液完全凝集,3 500 r·min-1离心20 min,吸取上层血清。使用上海酶联生物科技有限公司提供的鲤鱼ELISA试剂盒检测雌二醇(E2)、睾酮(T)含量。采用酶联免疫吸附的方法,在BioTek Synergy酶标仪450 nm波长下测定各自吸光度(D值),绘制标准曲线得出公式并计算各样品中E2、T含量。
1.2.5 数据分析
所有数据均用Excel 2007软件进行整理,结果用平均值±标准差(Mean±SD)形式表示。使用SPSS 19.0统计软件进行差异显著性分析;双曲线绘制采用Sigma Plot10.0制作图表;部分数据求导及运算使用Microsoft Mathematics软件。
2 结果与分析
2.1 不同发育时期雌、雄个体性别鉴定
分子标记鉴定中,Marker-5扩增产物表现为1个条带(产物大小为293 bp)的个体为雄性,无该特异条带的个体判为雌性(图1)。醋酸洋红压片鉴定中,生殖细胞(精原细胞)紧密堆积在一起,体积较小,细胞间隔不易区分的性腺为精巢;生殖细胞(卵母细胞)体积较大,呈圆形或卵圆形,细胞间隔容易分辨,边缘清晰的性腺为卵巢(图2)。组织切片鉴定中,卵巢可见圆形、卵圆形或多角圆形卵母细胞,具有很薄的细胞膜和滤泡膜;同期,精巢中可见成群成簇排列的精原细胞,其直径和核径均较卵母细胞小(图3)。性腺外观观察中,卵巢肉色或淡黄色,外形小囊状,囊内可见微细的卵粒零散分布;精巢肉白色,呈带状或扁平三棱柱状,背面有纵行血管。生殖孔外观观察法:雌鱼腹部有三开孔(泌尿孔、生殖孔、肛门);雄鱼腹部有两个开孔(泄殖孔、肛门),泄殖孔位于前端圆形凸起上。各时期雌雄鱼个体数见表1。

1、2、4、6、8、9为雄性; 3、5、7为雌性1, 2, 4, 6, 8, 9 were male; 3, 5, 7 were female图1 尼罗罗非鱼性别鉴别Marker-5分子标记Fig.1 Sex identification of Oreochromis niloticus individuals by using Marker-5

A,卵巢Ovary(10×10); B,精巢Testis(10×10)图2 尼罗罗非鱼性别鉴定醋酸洋红染色Fig.2 Sex identification of Oreochromis niloticus gonads by using acid red dyeing method
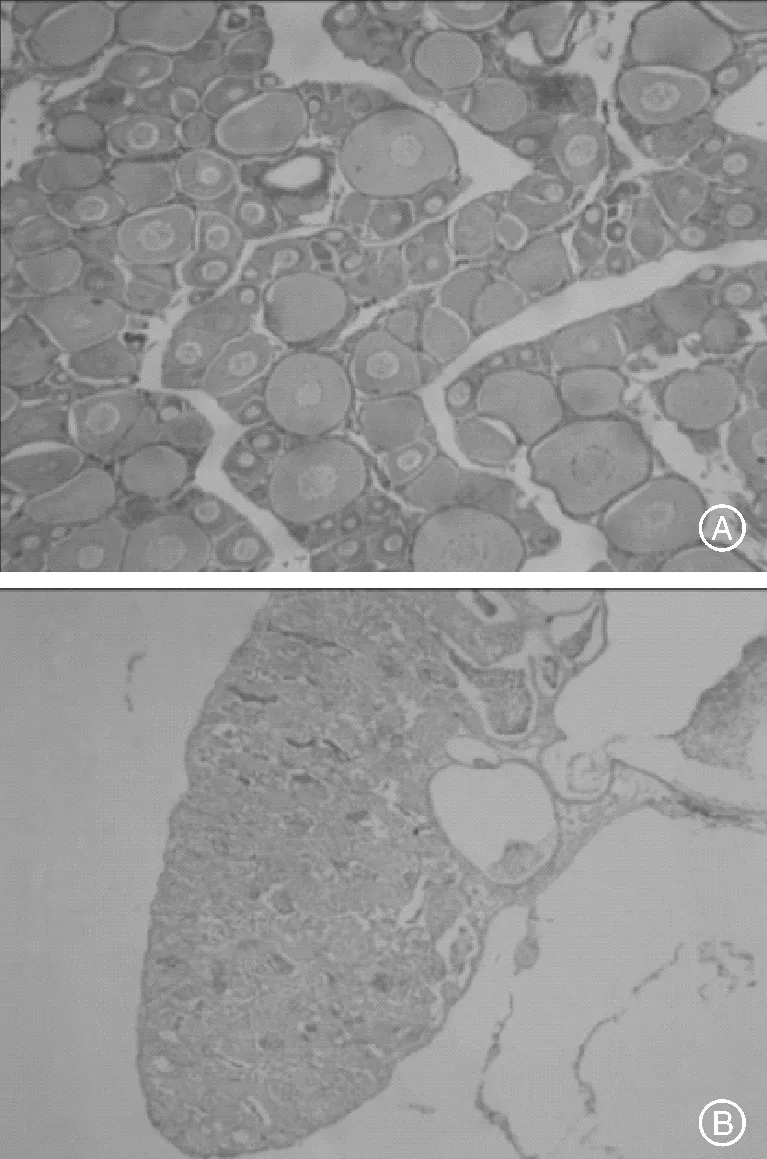
A,卵巢Ovary(10×10); B,精巢Testis(10×10)图3 尼罗罗非鱼性别鉴定H.E染色Fig.3 Sex identification of Oreochromis niloticus gonads by using H.E staining
2.2 雌、雄鱼生长特征
2.2.1 雌、雄鱼全长和体质量生长比较
不同月龄尼罗罗非鱼雌、雄鱼的实测平均全长和体质量列于表1。雌、雄鱼全长和体质量出现显著差异时间分别出现在3.0和2.5月龄。
各月龄雌雄鱼的实测全长(L)与体质量(W)散点分布图见图4,体质量与全长生长关系回归雌、雄鱼体质量—全长生长方程差异明显,雌鱼b值大于3,呈匀速生长;雄鱼b值接近于3,略呈异速生长。

图4 尼罗罗非鱼雌雄全长—体质量生长关系Fig.4 Relationship between total length and body weight of female and male Oreochromis niloticus
表1 尼罗罗非鱼雌雄鱼全长、体质量实测值
Table 1 Total length, body weight of female and maleOreochromisniloticusat different month ages

采样时间Samplingdate月龄Monthage♀全长Totallength/cm体质量Bodyweight/g样本数SampleNo.♂全长Totallength/cm体质量Bodyweight/g样本数SampleNo.2015-06-150.51.711±0.1910.101±0.038281.756±0.2200.131±0.036322015-06-301.03.329±0.2830.485±0.175373.467±0.4630.577±0.255232015-07-151.55.254±0.7872.611±0.887275.906±0.4563.668±0.633332015-07-302.08.059±0.6247.989±1.642368.868±0.80210.962±1.013242015-08-152.510.871±0.80524.052±3.519*2211.603±0.92530.323±3.574382015-09-013.013.197±0.939*42.571±10.134**3114.013±1.30250.897±11.967292015-09-153.514.938±1.581**49.369±11.048**2616.002±1.36962.215±13.751342015-10-014.015.375±1.519**76.810±17.666**3517.150±1.61394.950±18.34625
*显示同一指标雌雄鱼间差异显著(P<0.05),**显示差异极显著(P<0.01)。表4同。
*means the difference in the same index of the female and maleOreochromisniloticuswas significant (P<0.05), and**means the difference was extremely significant (P<0.01). The same as Table 4.
关系为:
W(♀)=0.016L3.017(R2=0.995,n=242)
W(♂)=0.020L2.938(R2=0.995,n=238)
2.2.2 雌、雄鱼Logistic 生长方程
雌、雄鱼全长、体质量Logistic 生长方程参数见表2,拟合曲线见图5。雌、雄鱼全长、体质量的拟合度R2均大于0.94,拟合效果均较好。随着月龄增加,雌、雄鱼全长、体质量差异逐渐增大,全长生长速度最大时月龄为2.069和2.125,全长生长曲线不具拐点,随着月龄的增加,逐渐趋向渐进值;体质量的拐点月龄为3.523和3.585,拐点体质量值为52.352和67.398 g,雄鱼体质量拐点月龄与拐点体质量值均大于雌鱼。
表2 尼罗罗非鱼雌雄鱼Logistic 方程模型参数及拟合度
Table 2 The parameter values and the fit goodness of Logistic models of female and maleOreochromisniloticus
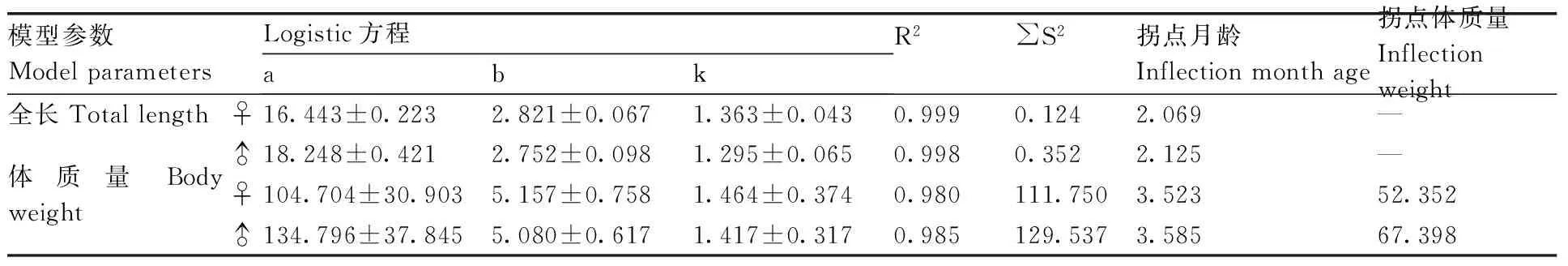
模型参数ModelparametersLogistic方程abkR2S2拐点月龄Inflectionmonthage拐点体质量Inflectionweight全长Totallength♀16.443±0.2232.821±0.0671.363±0.0430.9990.1242.069—♂18.248±0.4212.752±0.0981.295±0.0650.9980.3522.125—体质量Bodyweight♀104.704±30.9035.157±0.7581.464±0.3740.980111.7503.52352.352♂134.796±37.8455.080±0.6171.417±0.3170.985129.5373.58567.398
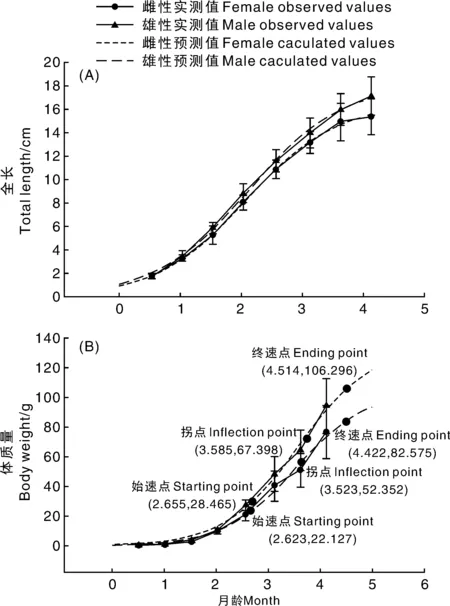
图5 尼罗罗非鱼雌雄全长(A)、体质量(B)实测值和预测值的生长曲线Fig.5 Growth curves of observed and predicted values of total length(A) and body weight(B) of female and male Oreochromis niloticus
对Logistic方程求一阶导数和二阶导数,分别得雌、雄鱼生长速度、生长加速度。雌、雄鱼的全长、体质量生长速度均是先上升后下降,呈倒钟形(图6)。雄鱼全长、体质量生长速度始终大于雌鱼;随着生长发育,雌、雄鱼体质量差异逐渐增大,体质量生长速度的差异也逐渐增大。生长速度曲线的顶点即为生长拐点。雌、雄鱼全长生长速度分别在2.069和2.125月龄达到顶点,体质量生长速度分别在3.523和3.585月龄达到最大值。
雌、雄鱼全长、体质量生长加速度变化规律类似,呈上升—下降—上升趋势(图6)。在全长生长速度最大时,加速度为零,此后为负值,生长速度减小。在生长拐点之前,雄鱼体质量生长加速度大于雌鱼,雌、雄鱼体质量生长速度差异逐渐增大;拐点之后,生长加速度小于零,生长速度减小。

(A)全长Total length; (B)体质量Body weight图6 尼罗罗非鱼雌雄生长速度、生长加速度Fig.6 Speed and additive speed of growth for the female and male Oreochromis niloticus
体质量生长加速度的最大值和最小值(两个极值)分别对应始速点和终速点(图6-B)。据此可将生长过程分成3个时期:缓慢生长期、快速生长期和渐进生长期(表3)。雌鱼进入快速生长期的始速点(2.623月龄)和终速点(4.422月龄)都比雄鱼(2.655月龄,4.514月龄)提前,雄鱼快速增长期的净增长量(77.831 g)和快速增长期持续时间(1.859月龄)均大于雌鱼(60.525 g,1.799月龄),雄鱼体质量增加显著大于雌鱼(图5-B)。
2.3 雌、雄鱼血清睾酮和雌二醇含量
随月龄增加,雌、雄鱼血清睾酮(T)、雌二醇(E2)含量随之升高,且差别逐渐增大。2.5月龄,雌、雄鱼血清雌二醇含量差异显著(P<0.05),3.0月龄,睾酮、雌二醇含量均差异显著(P<0.05);3.5月龄和4.0月龄后,雌、雄鱼睾酮、雌二醇含量差异极显著(P<0.01)(表4)。
表3 尼罗罗非鱼雌雄体质量生长过程区间
Table 3 Three growth intervals of body weight of female and maleOreochromisniloticus

性别Gender缓慢生长期Slow-growthperiod月龄Monthage体质量Bodyweight/g快速生长期Fast-growthperiod月龄Monthage体质量Bodyweight/g渐进生长期Asymptoticgrowthperi-od月龄Monthage体质量Bodyweight/g♀0~2.62322.0512.623~4.42222.051~82.5754.42282.575♂0~2.65528.4652.655~4.51428.465~106.2964.514106.296
表4 尼罗罗非鱼雌雄鱼血清睾酮和雌二醇含量变化
Table 4 Changes of blood serum T and E2of female and maleOreochromisniloticusat different month ages

月龄Monthage睾酮T/(nmol·L-1)♀♂雌二醇E2/(ng·L-1)♀♂2.514.985±2.41918.776±2.595120.119±19.991110.441±16.355*3.015.343±3.44120.398±3.590*128.249±29.331115.238±28.835*3.517.236±3.99823.441±5.397**140.353±33.453125.243±30.304**4.020.329±5.02127.309±7.497**154.602±38.302133.902±32.497**
3 讨论
近年来,Logistic、Gompertz[10-11]和 von Bertalanffy[12]等非线性方程被广泛用于鱼类雌雄生长过程研究。本研究用Logistic方程拟合了0.5~4.0月龄尼罗罗非鱼雌、雄全长和体质量生长特征,全长为:Lt(♀)=16.443/(1+e(2.821-1.363*t)),Lt(♂)=18.248/(1+e(2.752-1.295*t));体质量为:Wt(♀)=107.704/(1+e(5.157-1.464*t)),Wt(♂)=134.796/(1+e(5.080-1.417*t))。雄鱼全长生长速度最大时的月龄、体质量拐点月龄、拐点体质量值均大于雌鱼。雌、雄鱼体质量生长拐点分别在3.523、3.585月龄时,生长速度及其差异达到最大,雌鱼进入快速生长期的始速点和终速点均较雄鱼提前,但雄鱼快速生长区间时长及体质量净增长量均大于雌鱼,雌雄生长特征存在差异显著。
该研究发现,性成熟前尼罗罗非鱼雌、雄鱼生长差异已开始出现,全长、体质量出现显著差异时间分别始于3.0、2.5月龄,随着月龄增加,雌、雄性别间生长差异显著性增加。这可能与雌、雄鱼在性腺发育过程中进行的生殖投入不同有关。普遍认为,处于性腺发育周期的大部分能量都要用于性腺发育,但雌性和雄性的能量代谢配置不同,雄性较雌性分配更多能量到生长,生殖则相对较少[1]。研究发现,尼罗罗非鱼鱼苗自孵化15 d时性腺原基向卵巢发育已定型,精巢在孵化后30 d完成分化,较卵巢晚;雄鱼性成熟约在3.6月龄,较雌鱼(4.3月龄)早[13-14]。因此,尼罗罗非鱼雄鱼性腺发育周期短,性腺成熟周期内供性腺发育所耗能量较雌鱼少,能量分配更多用于增加体质量。
罗非鱼两性生长分化差异主要来自性腺发育及性别分化引起的性激素水平不同。关于尼罗罗非鱼性腺发育过程报道较多。王令玲等[7]报道,出膜后2~3 d,性腺原基形成;约30日龄,生殖细胞开始分化成卵原细胞或精原细胞。朱云林[15]研究表明,出膜后第3日龄,开始出现原始生殖嵴,10~20日龄是性别分化时期。Hines等[16]研究发现,孵化后36 d可分辨卵巢。Ijiri等[17]认为,孵化后3~5 d为生殖嵴发育时期,孵化后25~30 d,XX型性腺开始减数分裂。陈汉兴[18]认为,孵化后5 d出现生殖嵴,孵化后28 d可清晰辨认卵原细胞,呈现明显的性腺分化组织学特征,孵化后42 d可辨认精原细胞。但Rothbard等[20]认为,孵化后20 d即可从组织学上分辨出雌雄。这些结果表明,尼罗罗非鱼性别分化大约在孵化后30 d左右完成,性腺分化前期也未发现雌、雄鱼生长间存在明显差异。
性腺发育是内源性类固醇激素分泌的前提基础。研究表明,在性别分化期前、中、后不同阶段,罗非鱼内源性类固醇激素水平存在变异[21]。雄激素在卵中较高,受精后、性腺形成前则急剧下降,孵化后22 d迅速升高,而此间雌激素水平极低甚至未被检测;两性性别分化后,雌激素在孵化后43 d迅速升高,雄激素在孵化后57~64 d出现双峰[16]。内源性类固醇激素的合成是在性腺分化后,由卵巢、精巢中性固醇分泌细胞分别合成分泌;性腺分化后,雌激素出现早于雄激素,推测雌雄鱼生长差异出现时间与该时期雌、雄性激素分泌差异存在关联。
本研究表明,2.5月龄尼罗罗非鱼雌、雄鱼雌二醇含量差异显著;3.0月龄雌、雄鱼睾酮和雌二醇含量差异显著(P<0.05),之后差异逐渐增大。推测雌雄性别生长差异可能与性固醇激素水平间存在一定关联。一方面,性固醇激素可提高鱼类摄食水平、食物转化率。研究表明,尼罗罗非鱼雄鱼血清11-KT浓度高于雌鱼,11-KT可增加雄鱼摄食量、提高食物转化率[21]。在投喂不同浓度甲基睾酮饲料后,随着雄性激素剂量增加,鲤(Cyprinuscarpio)的食物转化率也有增加表现[22]。另一方面,性固醇激素可通过GH-IGF通路调节生长发育。虹鳟(Oncorhynchusmykiss)中,雌二醇可降低肝脏对GH信号因子敏感性,下调igf-1表达量;睾酮则可上调igf-1表达量[23-25]。在莫桑比克罗非鱼(O.mossambicus)中,E2可降低雌、雄鱼igf-1 mRNA表达量,降低雄鱼igfbpmRNA表达量,增加雌鱼igfbpmRNA表达量,进而调节肝脏GH-IGF信号通路[26-27]。马细兰等[28]研究指出,E2可下调雄性尼罗罗非鱼垂体GH mRNA和肝脏GHR mRNA表达量。
本研究中,尼罗罗非鱼雌、雄鱼中雄激素水平显著差异出现在3月龄,雄鱼大于雌鱼;雌激素水平显著差异出现在2.5月龄,雌鱼大于雄鱼。不同性别中雌、雄激素水平与其生长性能间存在一定关联,即雄鱼雄激素水平高、雌激素水平低,生长更快;而雌鱼雄激素水平相对低,雌激素水平高,生长较慢。因此认为,尼罗罗非鱼个体生长可能受雌、雄激素水平(相对高低)影响调控。
[1] 马细兰,张勇,周立斌,等. 脊椎动物雌雄生长差异的研究进展[J].动物学杂志, 2009, 44(2):141-146.
MA X L, ZHANG Y, ZHOU L B, et al. Studies of growth sexual dimorphism in vertebrate[J].JournalofZoology,2009,44(2):141-146. (in Chinese with English abstract)
[2] 李虎,陈四清,刘海金,等.半滑舌鳎养殖群体的性比与雌雄形态差异比较[J]. 水产学报,2012,36(9):1331-1336.
LI H, CHEN S Q, LIU H J, et al. Study on sex ratio and comparison of morphological variation between genders of cultured half-smooth tongue sole(Cynoglossussemilaevis) [J].JournalofFisheriesofChina, 2012,36(9):1331-1336.(in Chinese with English abstract)
[3] 李思发.淡水鱼类种群生态学[M]. 北京: 农业出版社,1990.
[4] 王晓清,李传武,谢中国,等.鳜雌雄生长差异的研究[J]. 淡水渔业,2006,36(3):34-37.
WANG X Q, LI C W, XIE Z G, et al. Studies on the growth difference of the male and femaleSinipercachuatsi[J].FreshwaterFisheries, 2006,36(3):34-37. (in Chinese with English abstract)
[5] 安丽,朱永安,王玉新,等.大鳞副泥鳅雌雄个体的形态特征比较[J]. 安徽农业科学,2011,39(1):289-294.
AN L,ZHU Y A,WANG Y X,et al. Statistic morphology difference between sexual dimorphism ofParamisgurnusdabryanusSauvage[J].JournalofAnhuiAgriculturalSciences,2011,39(1):289-294. (in Chinese with English abstract)
[6] 朱媛媛.尼罗罗非鱼性别特异性AFLP标记的筛选及两个基因的多态性与生长性状的相关性分析[D]. 武汉:华中农业大学,2012.
ZHU Y Y. Screening of the AFLP markers linked to the sex locus ofOreochromisniloticusand association between polymorphisms of two genes and growth traits[D]. Wuhan: Huazhong Agricultural University, 2012. (in Chinese with English abstract)
[7] 王令玲,仇潜如,吴福煌.尼罗罗非鱼性腺发育的研究[J]. 淡水渔业,1986(2):40-46.
WANG L L,CHOU Q R,WU F H. Study of gonadogenesis in Nile tilapiaOreochromisniloticus[J].FreshwaterFisheries,1986(2):40-46. (in Chinese with English abstract)
[8] SUN L Y, DONG N J. Screening and characterization of sex-linked DNA markers and marker-assisted selection in the Nile tilapia (Oreochromisniloticus)[J].Aquaculture, 2014, 433:19-27.
[9] 杨运清,杨玉林. 动物生长模型参数的常规估计法[J]. 东北农业大学学报,1994,25(2):132-137.
YANG Y Q,YANG Y L. Routine parameter estimation methods for animal growth models[J].JournalofNortheastAgriculturalUniversity,1994,25(2):132-137. (in Chinese with English abstract)
[10] 陈毅峰,何德奎,曹文宣,等. 色林错裸鲤的生长[J]. 动物学报,2002,48(5):667-676.
CHEN Y F, HE D K,CAO W X,et al. Growth of selincuo schizothoracini (Gymnocyprisselincuoensis) in selincuo lake, tibeten platean[J].ActaZoologicaSinica,2002,48(5):667-676. (in Chinese with English abstract)
[11] 王新安,马爱军,黄智慧,等.大菱鲆选育家系雌、雄群体的生长发育差异[J]. 水产学报,2014,38(4):464-469.
WANG X A,MA A J,HUANG Z H,et al. Developmental differences between female and male groups in turbot(Scophthalmusmaximus) breeding families[J].JournalofFisheriesofChina,2014,38(4):464-469. (in Chinese with English abstract)
[12] 陈大庆,张信,熊飞,等.青海湖裸鲤生长特征的研究[J].水生生物学报,2006,30(2):173-179.
CHEN D Q,ZHANG X,XIONG F,et al. studies on growth characteristics ofGymnocyprisprzewalskiiprzewalskii[J].ActaHydrobiologicaSinica,2006,30(2):173-179. (in Chinese with English abstract)
[13] 刘筠,刘国安,陈淑群,等.尼罗罗非鱼性腺发育的研究[J]. 水生生物学报,1983,8(11):17-32.
LIU Y,LIU G A,CHEN S Q,et al. Studies on the gonadal development of tilapia nilotica[J].ActaHydrobiologicaSinica, 1983,8(11):17-32. (in Chinese with English abstract)
[14] 陈玉琳,胡秀敏,朱雅珠.莫桑比克罗非鱼幼鱼的性腺发育与分化[J]. 水产学报,1980,4(4):313-318.
CHEN Y L,HU X M,ZHU Y Z. Sex differentiation and development in a cichlid,tilapiamossambicapeters[J].JournalofFisheriesofChina, 1980,4(4):313-318. (in Chinese with English abstract)
[15] 朱云林. 尼罗罗非鱼(Oreochromisniloticus)性腺发育过程的研究[J]. 福建师范大学学报(自然科学版),1987,3(3):74-81.
ZHU Y L. A study of the development of the gonads ofTilapianilotica[J].TheJournalofFujianteachersUniversity(NaturalScience), 1987,3(3):74-81. (in Chinese with English abstract)
[16] HINES G A, BOOTS L R, WIBBEL T, et al. Steroid levels and steroid metabolism in relation to early gonadal development in the Tilapia,Oreochomisniloticus[J].General&ComparativeEndocrinology, 1999,114(2): 235-248.
[17] IJIRI S, KANEKO H, KOBAYASHI T, et al. Sexual dimorphic expression of genes in gonads during early differentiation of a teleost fish,the Nile tilapia (Oreochromisniloticus)[J].BiologyofReproduction, 2008,78(2):333-41.
[18] 陈汉兴.尼罗罗非鱼仔鱼生长发育和温度调控与雄激素诱导雄性化的研究[D].广州:中山大学,2005.
CHEN H X. Studies on growth and development making mono-male by controlling temperature and using androgen in larval Nile Tilapia,Oreochromisniloticus[D]. Guangzhou: Zhongshan University,2005. (in Chinese with English abstract)
[19] NAKAMARA M. Dosage-dependent changes in the effect of oral administration on gonadal sex differentiation inTilapiamossabica. Bull[J].BulletinoftheFacultyofFisheriesHokkaidoUniversity, 1975,26:99-108.
[20] ROTHBARD S, MOAV B, YARON Z. Changes in steroid concentration during sexual ontogenesis in tilapia[J].Aquaculture,1987, 83:153-166.
[21] TOGUYENI A, FAUCONNEAU B, BOUJARD T, et al. Feeding behaviour and food utilisation in Tilapia,Oreochromisniloticus: Effect of sex ratio and relationship with the endocrine status[J].Physiology&Behavior, 1997, 62(2):273-279.
[22] LONE K P, MATTY A J. The effect of feeding methyltestosterone on the growth and body composition of common carp (CyprinuscarpioL)[J].General&ComparativeEndocrinology, 1980, 40(4):409-424.
[23] NORBECK L A, SHERIDAN M A. An in vitro model for evaluating peripheral regulation of growth in fish: effect of 17beta-estraiol and testosterone on the expression of growth hormone receptor,insulin-like growth factors,and insulin-like growth factor type I receptors in rainbow trout(Oncorhynchusmykiss)[J].General&ComparativeEndocrinology,2012,173(2):270-280.
[24] CLEVELAND B M, WEBER G M. Effects of sex steroids on expression of genes regulating growth-related mechanisms in rainbow trout(Oncorhynchusmykiss)[J].General&ComparativeEndocrinology,2014,216:103-115.
[25] HANSON A M, KITTILSO J D, MARTIN L, et al. Environmental estrongens inhibit growth of rainbow trout(Oncorhynchusmykiss)by modulating the growth hormone-insulin-like growth factor system[J].General&ComparativeEndocrinology, 2014,196:130-138.
[26] RILEY L G, RICHMAN N H, HIRANO T, et al. Activation of the growth hormone/insulin-like growth factor axis by treatment with 17 α-methyltestosterone and seawater rearing in the tilapia, (Oreochromismossambicus)[J].General&ComparativeEndocrinology,2002,127:285-292.
[27] RILEY L G, HIRANO T, GRAU E G. Estradiol-17beta and dihydrotestosterone differently regulate vitellogenin and insulin-like growth factor-1 production in primary hepatocytes of the tilapia (Orechromismossambicus)[J].ComparativeBiochemistry&PhysiologyPartCToxicology&Pharmacology, 2004,138(2):177-186.
[28] 马细兰,张勇,黄卫人,等.尼罗罗非鱼生长激素及其受体的cDNA克隆与mRNA表达的雌雄差异[J]. 动物学报,2006,52(5):924-933.
MA X L,ZHANG Y,HUANG W R,et al. cDNA cloning of growth hormone, growth hormone receptor and the different expression between male and female Nile tilapia (Oreochromisniloticus)[J].ActaZoologicaSinica, 2006,52(5):924-933. (in Chinese with English abstract)
(责任编辑 张 韵)
Study on growth difference and steroid hormones between female and male Nile tilapiaOreochromisniloticusbefore sexual maturity
YUE Meng-meng, ZHAO Jin-liang*, TANG Shou-jie, WANG Yan, ZHAO Yong-hua
(LaboratoryofFreshwaterFisheriesGermplasmResources,MinistryofAgriculture,ShanghaiOceanUniversity,Shanghai201306,China)
Studies were conducted to reveal the growth differences between female and male Nile tilapia (Oreochromisniloticus) by identifying the gender with molecular marker, acid red dyeing method and histological section, meanwhile, the content of serum steroid hormones, testosterone (T) and estradiol (E2), were also investigated. Results showed that the total length, body weight in the female and male began to show significant differences (P<0.05) at 3.0 and 2.5 months age, respectively. Simultaneously, the Logistic growth equation can be expressed asLt(♀)=16.443/(1+e(2.821-1.363*t)),Lt(♂)=18.248/(1+e(2.72-1.295*t)),Wt(♀)=107.704/(1+e(5.157-1.464*t)),Wt(♂)=134.796/(1+e(5.080-1.417*t)). The inflection point for the body weight growth was 3.523 month in the female and 3.585 month in the male, and the corresponding weight was 52.352 and 67.398 g, respectively. The growth rate of total length and body weight in the male was throughout larger than that in the female. Furthermore, the male showed longer period and heavier increment than the female in the fast-growing period. After 3.0 months age, the content of E2and T between the male and female was significantly different(P<0.05), respectively. Results suggested that the relative content of E2and T may result in the growth difference between the male and female Nile tilapia.
Oreochromisniloticus; female and male; steroid hormones
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2016.10.08
2016-01-22
国家现代农业产业技术体系专项资金(CARS-49);水产动物遗传育种中心上海市协同创新中心(ZF1206)
岳蒙蒙(1990—),女,河南郑州人,博士研究生,从事水产动物遗传育种与繁殖研究。E-mail: 1534451302@qq.com
*通信作者,赵金良, E-mail: jlzhao@shou.edu.cn
S917.4
A
1004-1524(2016)10-1678-09
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(10): 1678-1686
岳蒙蒙,赵金良,唐首杰,等. 性成熟前期尼罗罗非鱼雌雄性别生长差异与性类固醇激素水平比较[J].浙江农业学报,2017,27(10): 1678-1686.
