烟台黑猪SLA-DQB基因外显子2多态性及其与仔猪腹泻的关联分析
2016-11-24王国梅杨启瑞张海龙田晓静刘丽霞
母 童,王国梅,杨启瑞,金 丽,张海龙,张 丽,田晓静,刘丽霞
(西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
烟台黑猪SLA-DQB基因外显子2多态性及其与仔猪腹泻的关联分析
母 童,王国梅,杨启瑞,金 丽,张海龙,张 丽,田晓静,刘丽霞*
(西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
采用PCR-RFLP方法对烟台黑猪DQB基因外显子2的多态性进行研究,并对该位点与仔猪腹泻的关联进行了分析。结果表明,在烟台黑猪DQB基因外显子2上共检测出4种等位基因(A、B、C、D),7种RFLP带型(AA、BB、CC、AB、AC、BC、AD),该位点具有较丰富的多态性。卡方适合性检验显示,烟台黑猪的DQB基因外显子2没有达到Hardy-Weinberg平衡(P<0.05)。最小二乘法分析结果表明,烟台黑猪的性别和DQB外显子2的基因型均对仔猪腹泻无显著影响(P>0.05),而性别与基因型的互作效应对仔猪腹泻具有极显著的影响(P<0.01),在公猪群体中,AD基因型仔猪腹泻评分高于AA基因型个体(P<0.05),在母猪群体中BB、AC、BC、CC基因型仔猪腹泻评分高于其他基因型仔猪(P<0.05)。
烟台黑猪;SLA-DQB;仔猪腹泻;PCR-RFLP;多态性
主要组织相容性复合物(major histocompatibility complex,MHC)是染色体上的一个多基因家族,由紧密连锁、高度多态的基因座组成,具有抗原递呈作用。MHC在猪中存在于7号染色体的短臂上[1],被称为猪白细胞抗原(swine leukocyte antigen, SLA)复合体,主要分为Ⅰ、Ⅱ和Ⅲ类基因。SLA在1970年首次被发现,其研究地位仅次于人类MHC,尤其是SLAⅡ类基因的研究[2-3]。SLAⅡ类基因约由18个基因序列所组成(DQB、DRB、DRA、DQA、DPB、DPA、DZA及DOB等),在控制机体的免疫应答与免疫调节中起着重要作用,与猪的抗病能力密切相关。研究发现,在较多的Ⅱ类基因中编码β1结构域的SLA-DQB基因外显子2存在高度多态性,在国内这一领域已经成为近些年研究的热点之一[4-9]。方美英等[10]对小梅山、大约克及中梅山猪采用PCR-RFLP法进行分析,结果在中梅山猪中检测到4种等位基因,小梅山猪中共检测到2种基因型。周波等[11]采用PCR-RFLP法对皮特兰、五指山及二花脸猪DQB基因外显子2进行研究,结果表明,经HaeⅢ和RsaⅠ酶切后共检测到9种基因型,存在较丰富的多态性。吴圣龙等[12]通过对3个江西地方猪种的研究发现,SLA-DQB基因均具有一定程度的多态性,他们的研究结果都说明DQB基因是一个很有研究价值的基因,目前尚无对烟台黑猪SLA-DQB基因外显子2的相关研究报道。
仔猪腹泻是一种肠道传染病,主要针对幼龄和新生动物,致使仔猪产生生理性紊乱,食欲消退,精神萎靡以及呕吐、便失禁等给养猪行业带来了极大的经济损失。肠毒素大肠杆菌F18是引起仔猪断奶后腹泻水肿的主要病原菌[13],F18的作用机制是通过产生类肠毒素从而引起血管壁损伤,使大量水分从血管壁渗出,最终导致水肿与腹泻病[14-17]。通常遗传与环境因素和疾病的发生密切相关,个体对环境致病因子的抗性在腹泻发生过程中也有着重要的作用。作为动物疾病抗性和易感性的候选标记基因,MHC在辅助抗病性选择上具有重要的作用[18],其多态性水平被认为是种群抗病能力和生存能力的重要指标,多态性降低可导致种群抗病能力单一,生存能力下降[19]。研究表明,猪的抗病能力与SLA等位基因和单倍型有一定的关系[20],但具体到SLA-DQB基因多态性与仔猪腹泻的相关性分析还未见报道。
本研究以烟台黑猪为研究对象,采用PCR-RFLP方法检测SLA-DQB基因第2外显子的多态性,并分析其与仔猪腹泻的相关性,旨在对地方猪种的资源进行检测和评价以及对腹泻抗性品系培育的标记辅助选择提供理论依据,并为地方猪种的抗病育种研究提供更完整的理论资料。
1 材料与方法
1.1 材料
1.1.1 试验材料
本研究以兰州市红古区烟台黑猪为试验材料,共计289头。每个个体采集耳组织1.5 g保存于装有75%乙醇的1.5 mL Eppendorf 管中,放入冰盒中带回实验室,在-20 ℃冻存备用。试验仔猪均同期分娩且饲养条件相同,仔猪在哺乳期间每天进行排粪观察,在早、中、晚特定时间分别检查仔猪的肛门有无红肿及粪便污染,并观察仔猪粪便形状以及按照仔猪腹泻判断标准进行评分[21]。仔猪腹泻评分标准分为:0分:正常,粪便呈条状或粒状;1分:轻微腹泻,粪便成形、软便;2分:中度腹泻,粪便稠状、粪水无分离现象、稀便;3分:严重腹泻,粪便为液体、不成形、粪水分离。
1.1.2 试剂
过硫酸铵,琼脂糖,基因组DNA提取试剂盒,N,N,N,N’-四甲基乙二胺(TEMED),十二烷基磺酸钠(SDS),三羟甲基氨基甲烷(Tris),丙烯酰胺(Acr),乙二胺四乙酸二钠(EDTA-Na2),N,N-亚甲基双丙烯酰胺(Bis),去离子甲酰胺,2 000 bp DNA Marker,溴化乙锭,无水乙醇,甲醛溶液,冰乙酸,氢氧化钠,硝酸银,HaeⅢ限制性核酸内切酶,CutSmart Buffer等。
1.1.3 仪器设备
自动平衡离心机Labofuge 200和高速冷冻离心机D-37520(德国 Eppendorf公司),低温冰箱MDF-U541(日本 SANYO 电子有限公司),移液器(德国Eppendorf公司),梯度PCR仪Tgradient、电泳系统P25+Agagel和普通PCR 仪T1(德国Biometra公司),凝胶数字成像系统Bio-BEST 140E(美国西蒙公司)等。
1.2 方法
1.2.1 基因组DNA的提取
采用苯酚/氯仿抽提法对烟台黑猪基因组DNA进行提取,TE溶解,0.8%琼脂糖凝胶电泳检测,-20 ℃保存备用。
1.2.2 PCR引物设计
根据Shia等[22]报道的引物序列合成SLA-DQB基因外显子2引物序列,上游引物:5′-CGGAATTCCCCGCAGAGGATTTCGTGTACC-3′;下游引物:5′-CCGTCGTGCCTTCCTCTAT-3′。引物由大连宝生物工程有限公司合成,扩增目的片段大小为273 bp。
1.2.3 PCR扩增
PCR扩增体系为20 μL:去离子水7.4 μL;上、下游引物各0.4 μL;DNA模板0.8 μL;2×PowerTaqPCR MasterMix 11 μL。扩增最佳条件为:94 ℃预变性90 s,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,从第二步开始共30个循环,72 ℃最后延伸5 min,4 ℃保存。取扩增产物3 μL用2 %的琼脂糖凝胶电泳检测,溴化乙锭染色,凝胶成像系统拍照。
1.2.4 PCR产物酶切及电泳检测
用HaeⅢ对PCR产物进行酶切,酶切总体系为10 μL:其中灭菌超纯水5.8 μL,CutSmart Buffer 1.0 μL,PCR产物3.0 μL,HaeⅢ 0.2 μL。加完样后用手指轻弹混匀,再简短离心,用封口膜封口(以免放入水中后被污染),放入37 ℃的恒温水浴锅中过夜消化12 h。之后通过8%聚丙烯酰胺凝胶电泳进行检测(29∶1)、银染、拍照、判型。
1.2.5 统计分析
多态信息含量(PIC)由PIC软件计算。基因型频率、等位基因频率、纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)和Hardy-Weinberg平衡检验均利用Popgene 32软件进行计算,通过SAS软件建立模型并进行腹泻相关性分析,统计模型如下:
Yijk=μ+Bi+Gj+Sk+eijk。
式中:Yijk为仔猪腹泻评分分值;μ为群体均值;Bi为第i个品种的固定效应;Gj为第j种基因型或单倍型的固定效应;Sk为第k种性别的固定效应;eijk为随机残差效应。
2 结果与分析
2.1 PCR扩增
将提取的条带清晰且无拖带的DNA经聚合酶链式反应(PCR)扩增后,用2%的琼脂糖凝胶电泳检测,均得到273 bp的特异性条带,与预期片段大小一致,且条带清晰、完整,没有引物二聚体、杂带以及其他非特异性条带。结果见图1,可用于PCR-RFLP分析。
2.2 PCR-RFLP
PCR产物经限制性内切酶HaeⅢ消化及非变性聚丙烯酰胺凝胶电泳分析检测后,表明烟台黑猪SLA-DQB基因外显子2在HaeⅢ酶切位点上具有较高的多态性。通过判型共分出7种RFLP带型,分别为AA、BB、CC、AB、AC、BC、AD,检测出4种等位基因,分别为A:84/83/23/29/54;B:167/4/102;C:167/23/11/18/54;D:167/23/29/54(图2)。
2.3 SLA-DQB基因外显子2的多态性
由表1可知,烟台黑猪SLA-DQB基因外显子2的4种等位基因中等位基因D频率最低,仅有0.02。等位基因B为优势基因,基因频率为0.45。烟台黑猪群体中占优势的基因型为AB型,基因型频率为0.36,AA和BC的基因型频率较低,分别为0.08和0.07,而CC和AD的基因型频率仅为0.03,在群体中占劣势。烟台黑猪SLA-DQB基因外显子2通过卡方适合性检验,结果表明,烟台黑猪SLA-DQB基因外显子2的HaeⅢ酶切位点突变偏离了Hardy-Weinberg 平衡(P<0.05)。

1-9,PCR产物;M, DL2000 DNA Maker图1 烟台黑猪SLA-DQB基因外显子2的PCR产物检测Fig.1 Detection of PCR products of SLA-DQB gene exon 2 of Yantai black pig
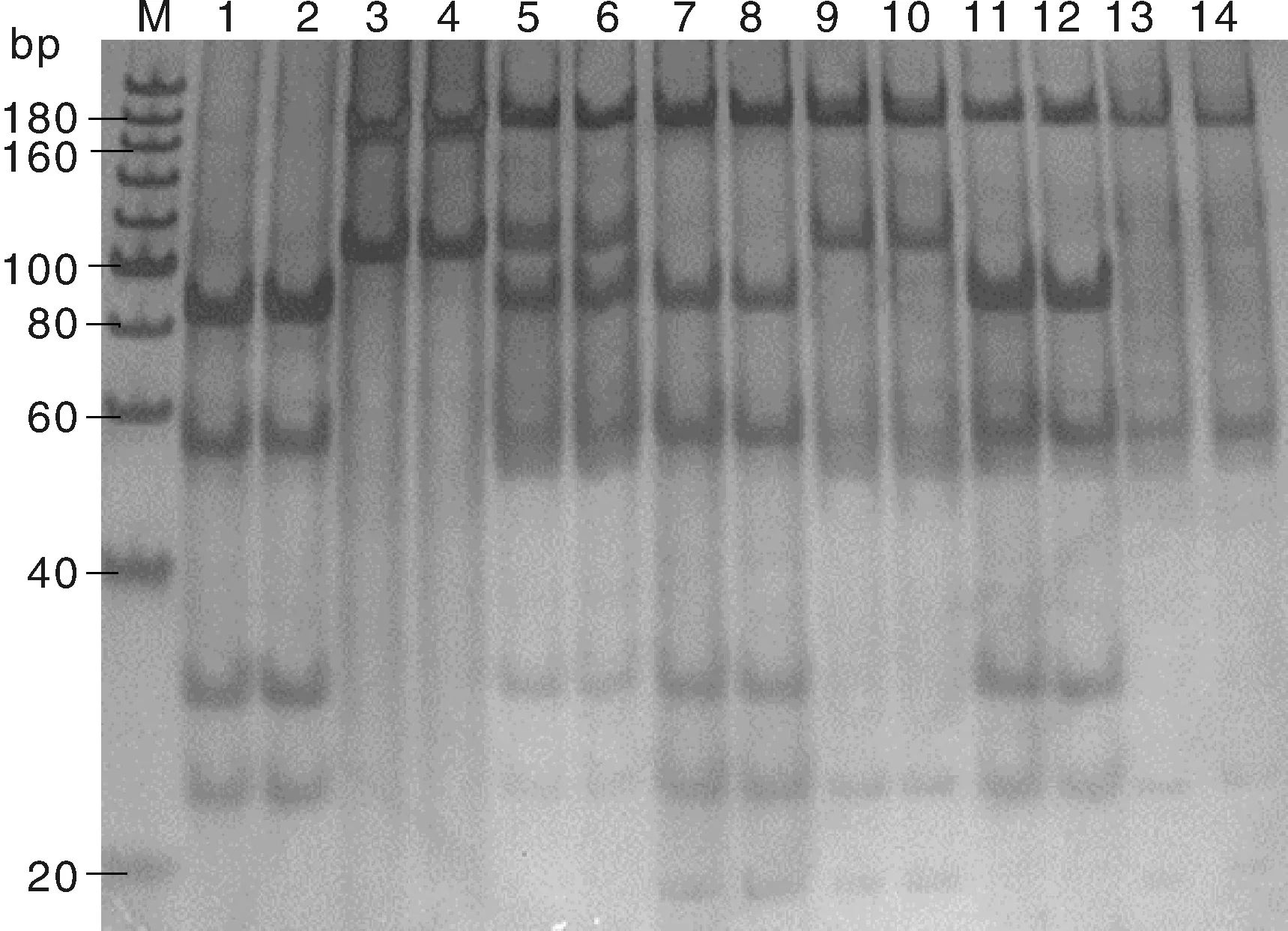
1,2. AA基因型;3,4. BB基因型;5,6. AB基因型;7,8. AC基因型;9,10. BC基因型;11,12. AD基因型;13,14. CC基因型;M. 20 bp DNA Ladder (Dye Plus)1,2. Genotype AA; 3,4. Genotype BB; 5,6. Genotype AB; 7,8. Genotype AC; 9,10. Genotype BC; 11,12. Genotype AD; 13,14. Genotype CC; M. 20 bp DNA Ladder (Dye Plus)图2 烟台黑猪SLA-DQB基因外显子2 PCR-RFLP检测Fig.2 Detection of SLA-DQB gene exon 2 by PCR-RFLP of Yantai black pig
通过对各遗传多态性参数的计算得知,烟台黑猪的杂合度(He)为0.63,表明其遗传变异程度较高,遗传多态性也较丰富。多态信息含量(PIC)是用来表示突变位点多态性的高低,在烟台黑猪中PIC为0.56,大于0.5,属于高度多态,具有丰富的多态性。有效等位基因数(Ne)是纯合度(Ho)的倒数,同样是评价群体遗传变异的重要指标,其值为2.71,小于实际等位基因数,说明该位点等位基因在烟台黑猪群体中分布不均匀。
表1SLA-DQB基因外显子2的等位基因频率和基因型频率
Table 1 Genotype frequency and allele frequency ofSLA-DQBgene exon 2

基因型Genotype数目Number频率Frequency等位基因Allele频率Frequencyχ2χ2valueAA240.08A0.3746.60*AB1030.36B0.45BB690.24C0.16AC560.19D0.02BC200.07CC90.03AD80.03Total2891.00
χ2值为不同基因型分布的Hardy-Weinberg 平衡检验值;*表示差异显著(P<0.05)。
χ2value is the test value of Hardy-Weinberg for the distribution of different genotypes; * means the significant difference atP<0.05.
2.4SLA-DQB基因外显子2多态性与仔猪腹泻的关联
最小二乘法分析结果显示,性别和基因型对仔猪腹泻的影响都不显著(P>0.05),而两者的互作对仔猪腹泻的影响极显著(P<0.01)。在公猪群体中,AD基因型个体仔猪腹泻评分的最小二乘均值明显高于其他基因型个体的仔猪(P<0.05),在母猪群体中BB、AC、BC、CC基因型个体仔猪腹泻评分显著高于AA、AB和AD基因型个体的仔猪(P<0.05)(表2)。
表2 性别与基因型互作分析
Table 2 Interaction analysis between gender and genotype

性别Gender基因型Genotype样本数Samplessize最小二乘均值及标准误Leastsquaremeans±standarderrors公猪AA120.67±0.34aMaleAB531.30±0.16aBB350.89±0.20aAC320.94±0.21aBC120.83±0.34aCC61.00±0.48aAD23.00±0.83b母猪AA120.50±0.34aFemaleAB500.88±0.17aBB341.53±0.20bAC241.67±0.24bBC81.75±0.42bCC32.33±0.68bAD60.00±0.48a
同性别群体同列不同字母表示均值间差异显著(P<0.05)。
The different letter in the same column of the same gender group indicate the significant difference among the average values(P<0.05).
3 讨论
3.1 SLA-DQB基因外显子2遗传多态性
生物在不断的演变和进化过程中,群体内某些基因发生了变异并导致MHC的变异,MHC的变异对群体遗传多样性水平可进行有效的评估[23]。在猪中MHC又称为猪白细胞抗原(SLA),杨涛等[24]对藏猪SLA-DQB1研究表明其有较丰富的遗传多态性,吴圣龙等[12]对3个江西省地方猪种的研究,方美英等[10]对小梅山、中梅山猪的研究均发现SLA-DQB基因具有不同程度的多态性。本研究通过PCR-RFLP法对烟台黑猪SLA-DQB基因外显子2进行研究, 结果共检测出4种等位基因,分别为A∶84/83/23/29/54;B∶167/4/102;C∶167/23/11/18/54;D∶167/23/29/54。7种RFLP带型(AA、BB、CC、AB、AC、BC、AD),表明烟台黑猪SLA-DQB基因外显子2存在丰富的多态性。由于18 bp以下的条带在电泳过程中发生了弥散,所以在图2中未看到条带,40 bp以下的片段也由于同样的原因导致条带较为模糊。其次,83 bp和84 bp只相差一个碱基,因此在图2中80 bp和100 bp之间有一条较粗的条带。另外在3、4 泳道跑出的大小为106 bp的条带也较粗,可能是因为DNA的浓度较大所致。本研究中检测到的A、B、D基因与杨文平等[25]对4个猪种(大白猪、长白猪、杜洛克猪和马身猪)SLA-DQB基因外显子2研究结果中B、C、A基因相一致,并且杨文平等[25]仅检测到5种基因型,而本研究在烟台黑猪中共检测到7种基因型,说明中国地方猪种的多态性比引进猪种更为丰富,可能与猪种所处的地理位置、环境以及气候条件等因素有关。
本研究中将烟台黑猪SLA-DQB基因外显子2通过HaeⅢ限制性内切酶消化后所得的基因型经卡方适合性检验,结果表明,烟台黑猪SLA-DQB基因外显子2的HaeⅢ酶切位点突变偏离了Hardy-Weinberg平衡(P<0.05)。可能有以下两方面原因:1) 由于在长期的人工选择过程中,所承受的压力太大,从而对SLA-DQB基因产生一定的影响;2) 连锁不平衡效应在SLA复合体中比较容易产生。其次,杂合度(He)、多态信息含量(PIC)等都可以用来度量群体内的遗传变异,烟台黑猪DQB外显子2杂合度较高(0.63),多态信息含量(PIC)大于0.5,表现为高度多态,说明烟台黑猪的遗传多态性较为丰富,在环境中的适应性较强,也表明长期的人工选择对烟台黑猪SLA-DQB基因会造成一定的影响。
3.2 烟台黑猪SLA-DQB基因多态性与仔猪腹泻的相关性
MHC是一种与疾病的抗性和易感性密切相关的高度多肽的基因家族,已有研究发现,MHC基因在鱼类、鸟类及哺乳动物中均有存在。而鼠类是最早开始研究MHC基因的动物,生物学家认为鼠类MHC基因与在组织移植过程中存在的免疫排斥反应有着必然的联系。而MHC最显著的特性是具有遗传多态性,其主要由基因突变、人工选择、自然选择等因素导致[26]。有研究表明,鸡MHC与抗原肽的识别有关[27],羊的MHC基因与包虫病和线虫病的抗性和易感性有关[28-29]。同样,仔猪腹泻也是一种与MHC基因有关的并以新生和幼龄动物为主的肠道传染病,可引起仔猪精神萎靡、食欲减退、生长发育缓慢、成活率下降等,使得养猪业经济利益明显下降。早在1989年就有研究就报道仔猪腹泻与SLA单倍型有关[30],2011年孔晶晶[31]和杨巧丽等[32]也分别分析了长白猪、大白猪和杜洛克猪的DQA和DRA基因多态性与仔猪腹泻之间的关系,最终表明仔猪腹泻的易感性和抗性与不同基因型有着必然的联系。本研究在对烟台黑猪SLA-DQB基因多态性与仔猪腹泻的相关性研究后发现,性别和基因型对仔猪腹泻的影响均不显著(P>0.05),而性别与基因型互作对仔猪腹泻的影响极显著(P<0.01)。在公猪群体中AD基因型的个体腹泻评分显著高于其他基因型个体(P<0.05),在母猪群体中BB、AC、BC、CC基因型个体仔猪腹泻评分显著高于其他基因型个体的仔猪(P<0.01),可能有以下2个原因:1) 长期的人工选择对性别不同的仔猪抗腹泻产生了一定的影响;2) 公猪与母猪自身存在的个体差异所致。因此,烟台黑猪仔猪腹泻与性别基因型互作存在显著相关性,这可为腹泻抗性品系培育的标记辅助选择提供理论依据,并为地方猪种的抗病育种研究提供更完整的理论资料。
[1] XU Y, ROTHSCHILD M F, WARNER C M. Mapping of theSLAcomplex of miniature swine: mapping of theSLAgene complex by pulsed field gel electrophoresis [J].MammalianGenome, 1992, 2(1):2-10.
[2] 周波,王林云,谈永松,等.猪白细胞Ⅱ类抗原基因多态性研究进展[J].遗传,2003,25(5):611-614.
ZHOU B,WANG L Y, TAN Y S,et al.Advances in allelic polymorphism at class Ⅱ of the pig MHC[J].Hereditas,2003,25(5):611-614. (in Chinese with English abstract)
[3] 姜范波,陈晨,邓亚军,等.猪的主要组织相容性复合体表达谱分析[J].科学通报,2005,50(7):659-668.
JIANG F B,CHEN C,DENG Y J,et al.The expression profile of major histocompatibility complex in pigs[J].ChineseScienceBulletin,2005,50(7):659-668. (in Chinese with English abstract)
[4] SACHS D H,GERMANA S, E1-GAMIL M,et al. ClassⅡgenes of miniature swine: 1. Class Ⅱgene characterization by RFLP and by isolation from a genomic library[J].Immunogenetics,1988,28∶22-29.
[5] 谈永松,王林云.猪MHCII类区域基因研究进展[J].国外畜牧学—猪与禽,2003,23(1):37-41.
TAN Y S,WANG L Y.Advances in the study of porcine MHCII gene[J].AnimalScienceAbroad-PigsandPoultry,2003,23(1):37-41. (in Chinese with English abstract)
[6] 包文斌,吴圣龙,陈国宏,等.苏太猪SLA-DQB基因外显子2多态性及其与繁殖性能的关联分析[J].畜牧兽医学报,2007,38(7):636-640.
BAO W B,WU S L,CHEN G H,et al. Polymorphism of the exon2 of SLA-DQB gene and its relationship with reproductive performance in Sutai pigs[J].ActaVeterinariaetZootechnicaSinica,2007,38(7):636-640. (in Chinese with English abstract)
[7] 包文斌,吴圣龙,曹晶晶,等.19个猪种SLA-DQB基因外显子2多态性分析[J].畜牧兽医学报,2009,40(10):1550-1554.
BAO W B,WU S L,CAO J J,et al. Polymorphism analysis on exon 2 of SLA-DQB gene in 19 pig populations[J].ActaVeterinariaetZootechnicaSinica,2009,40(10):1550-1554. (in Chinese with English abstract)
[8] 陈江伟,郭亚芬,兰干球,等.广西巴马小型猪SLA-DQB基因外显子多态性研究[J].广西农业科学,2010,41(8):824-826.
CHEN J W,GUO Y F,LAN G Q,et al.Polymorphism of exon 2 in swine leukocyte antigen (SLA) DQB gene in Guangxi Bama minipig[J].GuangxiAgriculturalSciences,2010,41(8):824-826. (in Chinese with English abstract)
[9] 孙瑞萍,魏立民,郑心力,等.海南3个地方猪种SLA-DQB基因外显子2的PCR-RFLP多态性分析[J].中国畜牧杂志,2010,46(11):9-12.
SUN R P,WEI L M,ZHENG X L, et al. Relationship between genetic characteristics of FSHβ gene at CDS regions and litter size of small-tail Han sheep[J].ChineseJournalofAnimalScience,2010,46(11):9-12. (in Chinese with English abstract)
[10] 方美英,胡晓湘,李宁,等.小梅山、中梅山及大约克猪的SLA-DQB基因外显子2 PCR-RFLP多态性分析[J].遗传学报,2002,29(8):685-687.
FANG M Y,HU X X,LI N, et al. Polymorphism analysis of the exon 2 ofSLA-DQBGene in Xiao Meishan, Zhong Meishan and Yorkshire pigs with PCR-RFLP[J].ActaGeneticaSinica,2002,29(8):685-687. (in Chinese with English abstract)
[11] 周波,谈永松,刘红林,等.五指山、二花脸和皮特兰猪的SLA-DQB基因外显子2的PCR-RFLP多态性分析[J].上海农业学报,2005,21(4):1-4.
ZHOU B,TAN Y S,LIU H L, et al. PCR-RFLP analysis of exon 2 of SLA-DQB gene in Wuzhishan, Erhualian and Pietrain pigs[J].ActaAgriculturaeShanghai,2005,21(4):1-4. (in Chinese with English abstract)
[12] 吴圣龙,鞠慧萍,包文斌,等.3个江西省地方猪种SLA-DQB基因外显子2多态性分析[J].中国畜牧杂志,2007,43(17):9-11.
WU S L, JU H P, BAO W B, et a1.Polymorphism analysis of exon 2 of SLA-DQB gene in 3 pig breeds in Jiangxi Province[J].ChineseJournalofAnimalScience,2007,43(17):9-11. (in Chinese with English abstract)
[13] IMBERECHTS H,DE G H, SCHLICKER C, et al. Characterization of F107 fimbriae ofEscherichiacoli107/86,which causes oedema disease in pigs, and nucleotide sequence of the F107 major fimbrial subunit gene, fedA.[J].Infectionandimmunity, 1992,60(5):1963-1971.
[14] BERTIN A M, DUCHER-SUCHAUX M F. Relationship between virulence and adherence of various enterotoxigenicEscherichiacoli: strains to isolated intestinal epithelial cells from Chinese Meishan and Europeanlarge white pigs[J].AmericanJournalofVeterinaryResearch,1991,52:45-49.
[15] FRANCIS D H. EnterotoxigenicEscherichiacoliinfection in pigs and its diagnosis[J].JournalofSwineHealthandProduction, 2002,10:171-175.
[16] NAGY B, FEKETE P Z. EnterotoxigenicEscherichiacoliin veterinary medicine[J].InternationalJournalofMedicalMicrobioligy,2005,295:443-454.
[17] VU-KHAC H,HOLODA E,PILIPCINEC E. Distribution of virulence genes inE.colistrains isolated from diarrhoeic piglets in the Slovak Republic[J].JournalofVeterinaryMedicineSeriesB-InfectiousDiseasesandVeterinaryPublicHealth,2004,51:343-347.
[18] 王兴平,昝林森,许尚忠.家畜MHC基因研究现状[J].黄牛杂志,2004,30(1):23-25.
WANG X P, ZAN L S, XU S Z. Research progress on major histocompatability complex genes in farm animals[J].JournalofYellowCattleScience,2004,30(1):23-25. (in Chinese with English abstract)
[19] VAIMAN M,RENARD C,BOURGEAUX N. Proceedings of international symposium on the molecular biology of the major histocompatibility complex of domestic animal species[M]. Iowa,USA: Iowa Sstate University Press,1970: 23-28.
[20] 赵桐茂.HLA分型原理和应用[M].上海:上海科学技术出版社,1984.
[21] TANAKA-MATSUDA M,ANDO A,ROGEL-GAILLARD C, et al. Difference in number of loci of swine leukocyte antigen classical class I genes among aplotypes [J].Genomics,2009,93(3):261-273.
[22] SHIA Y C,BRADSHAW M,RUTHERFORD M S, et al. Polymerase chain reaction based genotyping for characterization ofSLA-DQBandSLA-DRBalleles in domestic pigs[J].AnimalGenetics,1995,26(2):91-100.
[23] KIM M,SEO H,CHOI Y, et a1.Swine leukocyte antigen-DQ expression and its regulation by interferon-gamma at the maternal-fetal interface in pigs[J].BiologyofReproduction,2012,86(2):43,1-11.
[24] 杨涛,辜雪冬,商鹏,等.藏猪MHC-DQB1第四内含子遗传多态性研究[J].黑龙江畜牧兽医,2011(2):45-47.
YANG T, GU X D,SHANG P, et a1.Study on genetic polymorphism of MHC-DQB1 fourth intron in Tibetan Pig[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2011 (2):45-47. (in Chinese)
[25] 杨文平,张家琪,曹果清.4个猪种SLA-DQB基因外显子2多态性分析[J].生物技术,2014,24(1):2-3.
YANG W P, ZHANG J Q,CAO G Q. Polymorphism analysis of exon 2 of SLA-DQB gene in 4 pig populations[J].Biotechnology,2014,24(1):2-3. (in Chinese with English abstract)
[26] 林剑.免疫遗传学[M]. 北京:高等教育出版社,1997:22-57.
[27] HAERI M,READ L R,WILKIE B N, et al. Identification of peptides associated with chicken major histocompatibility complex class II molecules of B21 and B29 haplotypes[J].Immunogenetics,2005,56(11):854-859.
[28] SAYERS G, GOOD B, HANRAHAN J P, et al. Major histocompatibility complexDRB1 gene: its role in nematode resistance in Suffolk and Texel sheep breeds [J].Parasitology,2005,131(3):403-409.
[29] 贾斌,申红,余智勇,等.多浪羊和中国美利奴羊MHC-DRB1基因多态性与包虫病的遗传易感性[J].中国人兽共患病学报,2007,23(10):1004-1012.
JIA B, SHEN H,YU Z Y, et al. Polymorphism of the ovine major histocompatibility complex class Ⅱ DRB1 gene and the genetic susceptibility to hydatidosis[J].ChineseJournalofZoonoses,2007,23(10):1004-1012. (in Chinese with English abstract)
[30] RENARD C, VAIMAN M. Possible relationships betweenSLAand porcine reproduction [J].Reproduction,Nutrition,Development,1989,29(5):569-576.
[31] 孔晶晶.三个猪品种SLA-DQA基因多态性与仔猪腹泻的相关性分析[D].兰州:甘肃农业大学,2012.
KONG J J. Analysis on the relationship between SLA-DQA gene polymorphism and piglets diarrhea in three breeds[D]. Lanzhou: Gansu Agricultural University, 2012. (in Chinese with English abstract)
[32] 杨巧丽,孔晶晶,赵生国,等.猪SLA-DRA基因外显子2多态性及其与仔猪腹泻的关联分析[J].畜牧兽医学报,2012,43(7):1020-1027.
YANG Q L,KONG J J,ZHAO S G, et al. Polymorphism ofSLA-DRAgene exon2 and its correlation with piglet diarrhea[J].ActaVeterinariaetZootechnicaSinica,2012,43(7):1020-1027. (in Chinese with English abstract)
(责任编辑 张 韵)
Polymorphism ofSLA-DQBexon 2 and its association with diarrhea in Yantai black pigs
MU Tong, WANG Guo-mei, YANG Qi-rui, JIN Li, ZHANG Hai-long, ZHANG Li, TIAN Xiao-jing, LIU Li-xia*
(CollegeofLifeScienceandEngineering,NorthwestUniversityforNationalities,Lanzhou730030,China)
Polymorphism ofSLA-DQBexon 2 in Yantai black pigs was studied using PCR-RFLP, and its correlation with piglets diarrhea was analyzed. The results showed that there were four alleles (A, B, C, D) and seven RFLP genotypes (AA, BB, CC, AB, AC, BC, AD), polymorphism of theDQBexon 2 was abundant. The chi-square test displayedDQBexon 2 of Yantai black pigs deviated Hardy-Weinberg equilibrium(P<0.05). The results of least squares showed that the sex of Yantai black pig and genotype ofDQBexon 2 did not have significant influence on diarrhea piglets (P>0.05). However, polymorphism ofDQBexon 2 in different genders affected diarrhea piglets (P<0.01). In males, diarrhea score of genotype AD was higher than that of AA genotype (P<0.05), in female, scores of BB, AC, BC, CC were higher than others (P<0.05).
Yantai black pig;SLA-DQB; piglet diarrhea; PCR-RFLP; polymorphism
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2016.10.07
2016-03-05
中央高校基本科研业务费专项资金本科生项目(107422015033);西北民族大学中央高校基本科研业务费专项资金资助项目(31920130048);西北民族大学引进人才项目(xbmuyjrc201408)
母童(1995—),男,宁夏银川人,本科生,主要从事分子生物学方面的研究。E-mail: 1227415848@qq.com
*通信作者,刘丽霞,E-mail: skllx@xbmu.edu.cn
S858.28
A
1004-1524(2016)10-1671-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(10): 1671-1677
母童,王国梅,杨启瑞,等. 烟台黑猪SLA-DQB基因外显子2多态性及其与仔猪腹泻的关联分析[J]. 浙江农业学报,2016,28(10): 1671-1677.
