血管紧张素1-7与糖尿病及糖尿病肾脏内质网应激关系的研究
2016-11-24刘艳田秀标韩颖石节丽徐福娟高鹏飞张秋羽谢云
刘艳 田秀标 韩颖 石节丽 徐福娟 高鹏飞 张秋羽 谢云
·论著·
血管紧张素1-7与糖尿病及糖尿病肾脏内质网应激关系的研究
刘艳 田秀标 韩颖 石节丽 徐福娟 高鹏飞 张秋羽 谢云
目的调查糖尿病患者血管紧张素1-7(Ang1-7)水平和评价Ang1-7对糖尿病大鼠肾脏内质网应激的影响。方法选取2014年12月至2015年6月于天津市海滨人民医院未诊断为糖尿病的95名体检人员为研究对象,所有受试者均进行口服葡萄糖耐量试验,根据血糖水平分为健康组(n=31)、血糖异常组(n=32)和糖尿病组(n=32)。检测其体重、腰围、血压、肝功能、肾功能、Ang1-7、血管紧张素转换酶(ACE)2等指标。分析血糖与Ang1-7、ACE2的相关性。另外,选取10只150~200 g健康雄性Sprague-Dawley(SD)大鼠,通过腹腔注射链脲佐菌素制备糖尿病模型,全部成功,根据随机数字法,分为糖尿病组和Ang1-7组,每组5只,分别皮下泵入生理盐水和Ang1-7,另选取5只健康SD大鼠作为正常组。干预2周后处死所有大鼠,留取肾组织标本,Western印迹和实时荧光定量PCR检测葡萄糖调节蛋白78(GRP78)、转录活性因子4(ATF4)、增强子结合蛋白同源蛋白(CHOP)水平。结果与健康组相比,血糖异常组和糖尿病组甘油三酯、ACE2、Ang1-7水平均升高;糖尿病组较健康组升高更明显(F=5.57,6.12,5.44,P均<0.01)。Pearson相关分析显示,糖尿病组、血糖异常组的空腹血糖、餐后血糖均与Ang1-7呈正相关(r=0.69,0.45,P均<0.01;r=0.54,0.52,P均<0.01)。与正常组相比,糖尿病组大鼠肾脏GRP78、ATF4和CHOP水平明显升高;与糖尿病组相比,Ang1-7组GRP78、ATF4和CHOP水平明显下降 (t=20.3,25.7,19.6,P均<0.05)。与同期正常组比较,糖尿病组大鼠肾组织GRP78、ATF4和CHOP的mRNA均显著上调。与糖尿病组比较,Ang1-7组大鼠肾组织GRP78、ATF4和CHOP的mRNA的表达受到显著抑制(t=15.1,11.6,12.3,P均<0.05)。结论Ang1-7水平随着受试者血糖浓度的升高而升高,另外,Ang1-7可降低糖尿病大鼠肾脏内质网应激蛋白水平。
血管紧张素1-7;糖尿病;糖尿病肾病;内质网应激
肾素-血管紧张素-醛固酮系统(RAAS)在糖尿病及其并发症发生、发展中起重要作用。血管紧张素Ⅱ(AngⅡ)水平升高可增加胰岛素抵抗,促进胰岛纤维化和凋亡[1-3]。而血管紧张素转换酶(ACE)2可催化AngⅡ生成血管紧张素1-7(Ang1-7)。Ang1-7可通过与其特异性受体Mas结合,拮抗AngⅡ的缩血管效应[1-2]。因此,ACE2/Ang1-7/Mas轴在拮抗RAAS中发挥重要作用,本研究拟调查不同血糖浓度人群体内Ang1-7的水平。
糖尿病肾脏疾病是糖尿病的常见并发症,RAAS的靶器官主要是肾脏,糖尿病时,AngⅡ可过度激活肾组织内质网应激(ERS),促进肾小管上皮细胞凋亡,而Ang1-7对糖尿病肾小管上皮细胞具有保护作用,可抑制肾小管上皮细胞转分化、肾间质纤维化等[4-5]。故推测外源性Ang1-7干预可能通过拮抗AngⅡ改善ERS,减少糖尿病大鼠肾小管上皮细胞凋亡。因此,本研究拟观察外源性Ang1-7对糖尿病大鼠肾组织ERS的影响。
1 对象与方法
1.1 人群研究
1.1.1 研究对象 选取2014年12月至2015年6月于天津市海滨人民医院体检的未诊断糖尿病的人员为研究对象。根据2型糖尿病诊断标准(2010年版《中国2型糖尿病防治指南》),将研究对象分为健康组31名,年龄(43.4±8.1)岁,血糖异常组32名,年龄(45.2±8.4)岁, 糖尿病组32例,年龄(46.6±6.1)岁[6]。血糖异常组包括空腹血糖受损(空腹血糖介于6.1~7.0 mmol/L)和餐后血糖调节受损(餐后2 h血糖介于7.8~11.1 mmol/L)者。排除标准:肝、肾功能异常;呼吸系统疾病;严重心、脑血管系统疾病及肿瘤放射治疗、化学治疗者;精神异常;妊娠期或哺乳期;正在参加其他类似研究项目者。本研究经天津海滨人民医院伦理委员会批准,所有受试者均知情同意且自愿参加。
1.1.2 观察指标 问诊3组患者的一般情况,包括性别、年龄、吸烟史、家族史等;测量身高、体重、腰围、血压等指标。空腹8 h以上,早上抽取静脉血留取血样后,行口服葡萄糖耐量试验检测空腹血糖(葡萄糖氧化酶法)、空腹胰岛素(FINS,电化学发光法),同时检测总胆固醇和甘油三酯 (采用酶比色法)、低密度脂蛋白-胆固醇(LDL-C)和总胆固醇(化学沉淀法)、HbA1c(酶比色法)。采用ELISA检测Ang1-7和ACE2水平。稳态模型评估-胰岛素抵抗指数(HOMA-IR)=空腹血糖×FINS/22.5,当HOMA-IR>2.8时判定存在胰岛素抵抗。
1.2 动物实验
1.2.1 分组及干预 选择150~200 g健康雄性Sprague-Dawley(SD)大鼠15只,采用随机数字表法抽取10只给予腹腔注射链脲佐菌素(溶于0.1 mol/L柠檬酸缓冲液,pH值4.5,浓度为2%,剂量100 mg/kg)制备糖尿病大鼠模型,2 d后尾静脉采血测血糖,大于16.7 mmol/L确定为糖尿病大鼠模型,10只均成模,余下5只作为正常组注射相当体积的柠檬酸缓冲液。将糖尿病大鼠通过随机数字表法分为两组,每组5只,Ang1-7组给予Ang1-7(576 ng/d)药泵干预,糖尿病组泵入相当体积生理盐水,2周后处死所有大鼠,留取肾组织标本。
1.2.2 Western印迹及实时荧光定量PCR法检测葡萄糖调节蛋白78(GRP78)、转录活性因子4(ATF4)、增强子结合蛋白同源蛋白(CHOP) 肾组织蛋白提取、Western印迹等实验技术流程见文献[7]。实时荧光定量PCR法检测GRP78、ATF4和CHOP mRNA的表达:采用Trizol、氯仿和异丙醇抽提大鼠肾组织总RNA,RNA的浓度由A260/A280比值和1%琼脂糖凝胶电泳确定。按照日本TOYOBO公司反转录试剂盒说明进行cDNA的合成,反应体系20 μl,条件为42℃ 10 min,30℃ 20 min,99℃ 5 min,4℃ 5 min。GRP78、ATF4、CHOP和GAPDH引物由上海生物工程技术有限公司合成(表1)。
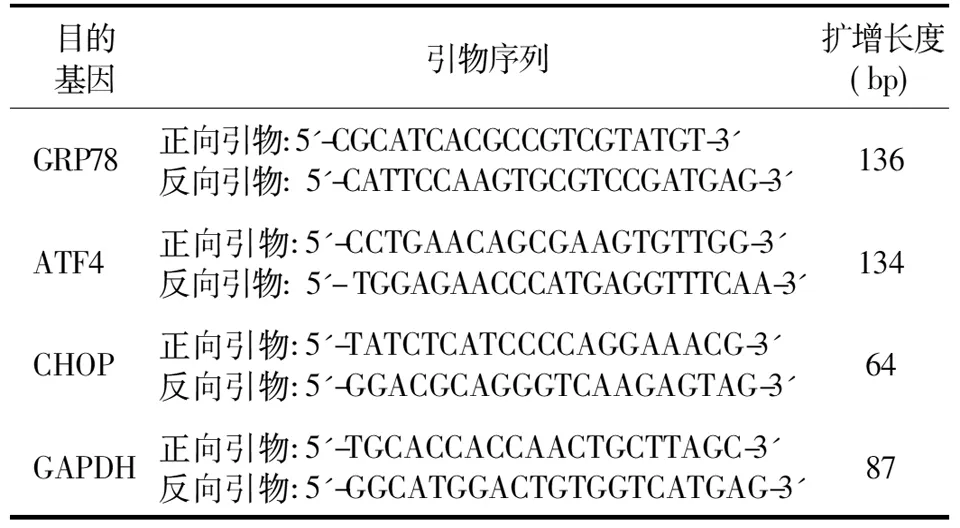
表1 各目的基因的引物序列及扩增长度
注:GRP78:葡萄糖调节蛋白78;ATF4:转录活性因子4;CHOP:增强子结合蛋白同源蛋白;GAPDH:甘油醛-3磷酸脱氢酶
采用美国Applied Biosystems公司PCR-System-9700进行实时荧光定量PCR,反应条件为 95℃预变性1 min,随后 95℃ 5 s,60℃ 30 s反应40个循环。按公式计算基因相对表达量2-△△Ct,再进行各组间比较。
1.2.3 试剂 Ang1-7 ELISA试剂盒LSBIO公司,货号LS-F25115,ACE2试剂盒(ORIGENE公司,货号59272);链脲佐菌素(Sigma公司,货号S0130);药物Ang1-7(Sigma公司,货号A9202);BCA蛋白定量试剂盒(碧云天生物技术有限公司,货号P0011);一抗GRP78、ATF4和CHOP(Cell Signaling Technology公司,货号分别为3177S,11815S,2895S);β-actin(ABclonal公司,货号AC004)。一抗用PBS按照1∶1 000稀释。
2 结果
2.1 不同血糖浓度人群临床资料和生化指标比较
3组基线时年龄、性别、糖尿病家族史、高血压病史、体重指数、体重、血压、谷丙转氨酶、谷草转氨酶和肾功能等的差异均无统计学意义。糖尿病组甘油三酯、ACE2、Ang1-7水平较健康组和血糖异常组明显升高(P均<0.017)。空腹血糖、餐后血糖与Ang1-7相关(r=0.69, 0.45,P均<0.01)。血糖异常组空腹血糖、餐后血糖与Ang1-7亦相关(r=0.54,0.52,P均<0.01),见表2。
2.2 Western印迹和实时荧光定量PCR分析大鼠肾组织GRP78、ATF4和CHOP的表达 Western印迹结果显示,与正常组相比,糖尿病组大鼠肾组织GRP78、ATF4和CHOP蛋白表达量均明显增加 (t=16.4,17.6,19.3,P均<0.05);Ang1-7组大鼠肾组织GRP78、ATF4和CHOP蛋白表达量均较糖尿病组明显降低 (t=20.3,25.7,19.6,P均<0.05),见图1。与正常组相比,糖尿病组大鼠肾组织GRP78、ATF4和CHOP的mRNA均显著上调(t=15.7,20.3,19.1,P均<0.05)。与糖尿病组相比,Ang1-7组大鼠肾组织GRP78、ATF4和CHOP mRNA的表达受到显著抑制(t=15.1,11.6,12.3,P均<0.05),见图2。
3 讨论
RAAS在糖尿病及其并发症的发生、发展中起重要作用。AngⅡ水平升高可促进胰岛细胞、肾组织、心肌等氧化应激、细胞凋亡,而ACE2能通过水解 AngⅡ生成 Ang1-7,Ang1-7可增强缓激肽作用以舒张血管,增加组织的血供,并促进骨骼肌及脂肪组织摄取葡糖糖,从而减轻胰岛素抵抗[7-8]。Ang1-7可通过与其特异性受体Mas结合,亦可通过抑制ACE活性减少AngⅡ生成,与AngⅡ受体竞争性结合,拮抗AngⅡ导致的缩血管效应、胰岛素抵抗、炎性反应、氧化应激、纤维化等不良作用[1-2]。

表2 3组受试者一般临床资料及Ang1-7、ACE2水平比较
注:1 mmHg=0.133 kPa;BMI:体重指数;AST:谷草转氨酶;ALT:谷丙转氨酶;Cr:肌酐;BUN:尿素氮;UA:尿酸;TC;总胆固醇;TG:甘油三酯;LDL-C:低密度脂蛋白-胆固醇;ACE2:血管紧张素转换酶2;Ang1-7:血管紧张素1-7;FBG:空腹血糖;PPG:餐后血糖;HOMA-IR:稳态模型评估-胰岛素抵抗指数;与健康组相比,aP<0.01; 与血糖异常组相比,bP<0.01
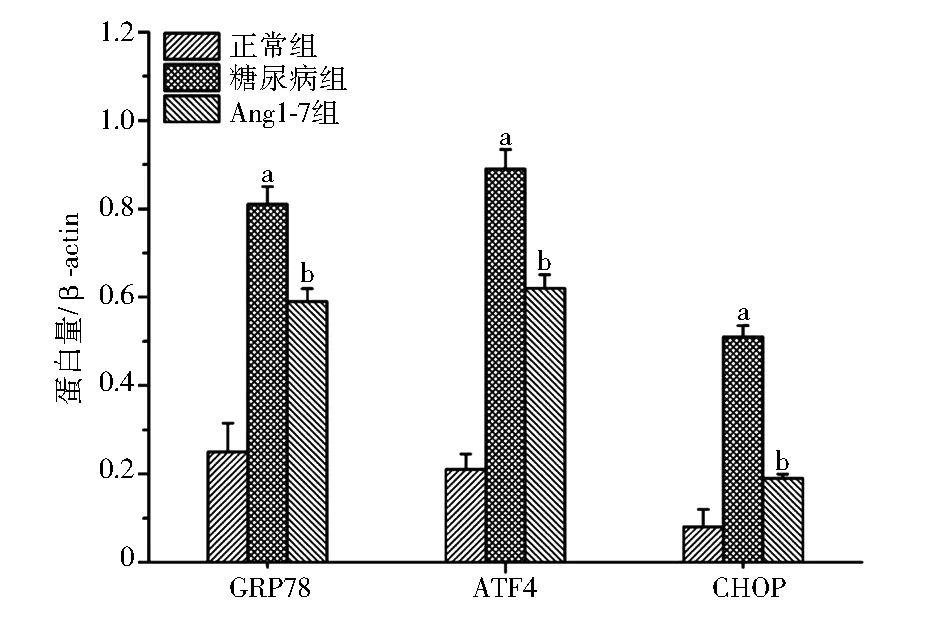
注:GRP78:葡萄糖调节蛋白78;ATF4:转录活性因子4;CHOP:增强子结合蛋白同源蛋白;β-actin:β-肌动蛋白;Ang1-7:血管紧张素1-7;与正常组相比,aP<0.05;与糖尿病组相比,bP<0.05图1 3组大鼠肾组织GRP78、ATF4和CHOP蛋白的表达
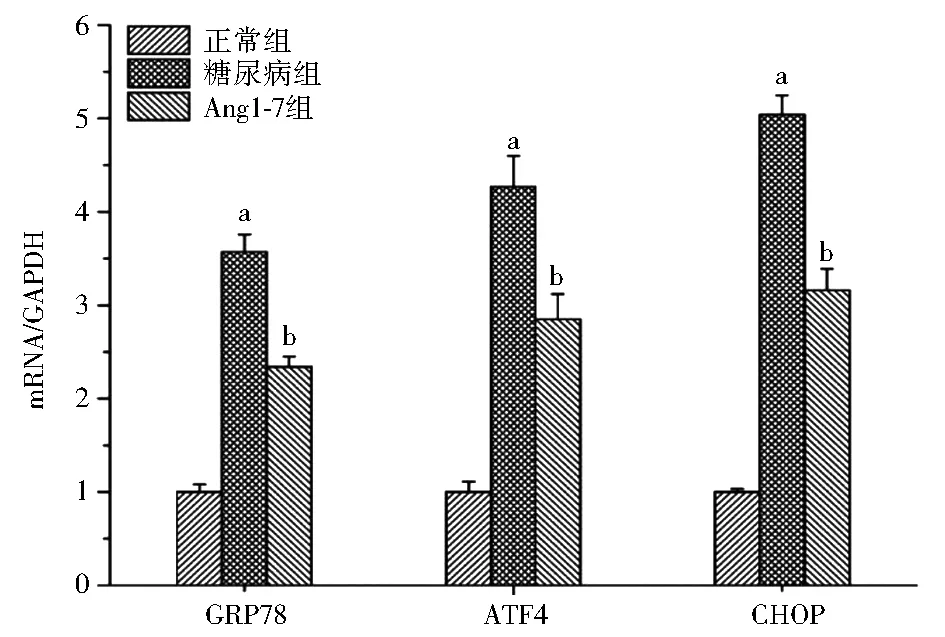
注:GRP78:葡萄糖调节蛋白78;ATF4:转录活性因子4;CHOP:增强子结合蛋白同源蛋白;GAPDH:甘油醛-3磷酸脱氢酶;Ang1-7:血管紧张素1-7;与正常组相比,aP<0.05;与糖尿病组相比,bP<0.05图2 3组大鼠肾组织GRP78、ATF4和CHOP mRNA的表达变化
本研究显示,2型糖尿病患者血ACE2和Ang1-7水平较正常人升高,且与血糖水平呈正相关。王晓玉[9]研究显示,糖尿病患者ACE2活性增强,可催化AngⅡ生成Ang1-7,从而降低AngⅡ和提高Ang1-7水平,进而改善胰岛血供。2型糖尿病大鼠模型胰岛中ACE2的mRNA和蛋白表达均升高,ACE2基因敲除动物模型空腹血糖升高、胰岛素第一时相分泌减少和糖耐量异常[10-11]。因此,Ang1-7在糖尿病患者中水平升高是机体的自我保护作用,可减轻AngⅡ引起胰岛损害和糖尿病并发症[3-5]。在糖尿病心肌病患者中使用血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)类药物后血清ACE2和Ang1-7水平均高于未使用ACEI和ARB的患者,其机制可能是ACEI和ARB类药物直接抑制ACE-Ang Ⅱ-AngⅡ 1型受体轴的负性生物效应,且通过增强ACE2-Ang(1-7)-Mas受体轴的功能发挥积极的器官保护功能[12]。
糖尿病肾病是糖尿病的严重并发症,RAAS在糖尿病肾病的发生、发展中扮演重要角色。大鼠及小鼠研究显示Ang1-7可通过结合Mas受体,拮抗AngⅡ,减弱胰岛素抵抗,促进脂联素的表达,增加外周组织脂肪细胞对胰岛素的敏感性,减轻胰岛β细胞功能紊乱和胰岛细胞凋亡[13-15]。糖尿病时,ERS度激活,高糖可促使GRP78通过活化蛋白激酶R样内质网激酶上调ATF4,从而诱导CHOP表达,CHOP蛋白可削弱抗凋亡蛋白Bcl2的功能并诱导细胞死亡介导因子Bax表达,GRP78、ATF4和CHOP水平升高与肾小管上皮细胞凋亡和肾组织损伤呈平行关系[4-5,16]。郝盼盼[12]使用外源性Ang1-7干预糖尿病大鼠,发现Ang1-7对糖尿病大鼠血脂和血糖水平无明显影响,但可抑制糖尿病大鼠左心室心肌细胞凋亡,从而减轻左室心肌肥厚和心功能障碍。徐春艳等[16]给予糖尿病大鼠AngⅡ1型受体阻滞剂可抑制肾组织ERS反应,并能通过调节ERS相关凋亡蛋白CHOP、caspase-12和磷酸化c-Jun氨基末端激酶的表达,减少肾小管上皮细胞的凋亡,减轻肾组织损害。Ang1-7可降低糖尿病大鼠胰腺组织内皮型一氧化氮合酶的表达,减弱胰岛局部的氧化应激水平,降低凋亡基因Bax mRNA表达及caspase-3的蛋白表达,增加抗凋亡基因Bcl2 mRNA的表达,减少胰岛细胞凋亡,进而改善胰岛的形态和胰岛素的分泌功能[7]。本研究表明,糖尿病大鼠肾脏ERS标志蛋白GRP78、CHOP等蛋白水平升高,给予Ang1-7干预后可从蛋白水平和基因水平降GRP78、ATF4、CHOP等表达,而CHOP可下调Bcl2和上调Bax的表达。因此,Ang1-7可增加肾组织在高糖时的抗凋亡能力。
综上所述,本研究发现初诊2型糖尿病患者血糖水平与Ang1-7水平呈正相关,且给予糖尿病大鼠Ang1-7可减轻肾脏内质网过度应激,有助于减轻高糖引起的肾脏病变,提示Ang1-7有望成为治疗糖尿病肾病的潜在药物。而本文不足之处在于,不能确定糖尿病患者经过合理控制血糖后,其Ang1-7水平是否随着血糖水平下降而降低;糖尿病肾脏疾病患者接受Ang1-7治疗后肾功能是否改善,仍需要深入研究。
[1] Tikellis C, Bialkowski K, Pete J,et al. ACE2 deficiency modifies renoprotection afforded by ACE inhibition in experimental diabetes[J].Diabetes,2008, 57(4):1018-1025.DOI: 10.2337/db07-1212.
[2] Zhang Y, Liu J, Luo JY, et al. Upregulation of angiotensin (1-7)-mediated signaling preserves endothelial function through reducing oxidative stress in diabetes[J]. Antioxid Redox Signal, 2015, 23(11):880-892. DOI: 10.1089/ars.2014.6070.
[3] He J, Yang Z, Yang H,et al. Regulation of insulin sensitivity, insulin production, and pancreatic β cell survival by angiotensin-(1-7) in a rat model of streptozotocin-induced diabetes mellitus[J]. Peptides, 2015, 64:49-54. DOI: 10.1016/j.peptides.2014.12.012.
[4] Zhou L, Xue H, Wang Z,et al. Angiotensin-(1-7) attenuates high glucose-induced proximal tubular epithelial-to-mesenchymal transition via inhibiting ERK1/2 and p38 phosphorylation[J]. Life Sci, 2012, 90(11-12):454-462. DOI: 10.1016/j.lfs.2011.12.015.
[5] Benter IF,Yousif MH,Dhaunsi GS,et al. Angiotensin-(1-7) prevents activation of NADPH oxidase and renal vascular dysfunction in diabetic hypertensive rats[J]. Am J Nephrol, 2008, 28(1):25-33. DOI:10.1159/000108758.
[6] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华内分泌代谢杂志, 2014, 30(10):447-498. DOI: 10.3760/cma.j.issn.1000-6699.2014.10.020.
[7] 王丽. 血管紧张素(1-7)对2型糖尿病大鼠胰岛功能及细胞凋亡的影响及其机制[D]. 山西医科大学, 2014.
[8] Santos SH, Andrade JM. Angiotensin 1-7: a peptide for preventing and treating metabolic syndrome[J]. Peptides, 2014, 59:34-41. DOI: 10.1016/j.peptides.2014.07.002.
[9] 王晓玉. 糖尿病心肌病患者血清ACE2和Ang-(1-7)变化及意义的临床研究. 山东大学, 2014.
[10] Tikellis C, Wookey PJ, Candido R,et al. Improved islet morphology after blockade of the renin-angiotensin system in the ZDF rat[J]. Diabetes, 2004, 53(4):989-997. DOI:10.2337/diabetes.53.4.989.
[11] Bindom SM, Lazartigues E. The sweeter side of ACE2: physiological evidence for a role in diabetes[J]. Mol Cell Endocrinol, 2009, 302(2):193-202. DOI: 10.1016/j.mce.2008.09.020.
[12] 郝盼盼. 血管紧张素(1-7)干预和评价糖尿病性心肌病的基础和临床研究[D]. 山东大学, 2013.
[13] Takeda M, Yamamoto K, Takemura Y,et al. Loss of ACE2 exaggerates high-calorie diet-induced insulin resistance by reduction of GLUT4 inmice[J]. Diabetes, 2013, 62(1):223-233. DOI: 10.2337/db12-0177.
[14] 刘畅, 曹曦, 杨芳远, 等. 血管紧张素1-7降低脂肪细胞氧化应激增加脂联素表达[J]. 首都医科大学学报, 2014, 35(1): 45-50. DOI:10.3969/j.issn.1006-7795.2014.01.011.
[15] Yuan L, Li Y, Li G,et al. Ang(1-7) treatment attenuates β-cell dysfunction by improving pancreatic microcirculation in a rat model of type 2 diabetes[J]. J Endocrinol Invest, 2013, 36(11):931-937. DOI: 10.3275/8951.
[16] 徐春艳, 赵林双, 李德忠. AT1受体自身抗体对厄贝沙坦抑制糖尿病肾病大鼠肾脏内质网应激相关信号的影响[J]. 中华内分泌代谢杂志, 2015, 31(5):400-405. DOI:10.3760/cma.j.issn.1000-6699.2015.05.005.
Relationshipbetweenangiotensin1-7,diabetesandendoplasmicreticulumstressofdiabetickidney
LiuYan*,TianXiubiao,HanYing,ShiJieli,XuFujuan,GaoPengfei,ZhangQiuyu,XieYun.
*DepartmentofDiabeticNeurology,KeyLaboratoryofHormonesandDevelopment(MinistryofHealth),TheMetabolicDiseasesHospitalofTianjinMedicalUniversity,Tianjin300070,China
XieYun,Email:tjxieyun0108@sina.com
ObjectiveTo investigate the level of angiotensin 1-7(Ang1-7) in patients with diabetes, and to study the effects of Ang1-7 on endoplasmic reticulum (ER) stress in the kidney of diabetic rats.MethodsNinety-five subjects without diagnosed diabetes were screened in Tianjin Seaside People′s Hospital from December 2014 to June 2015. Oral glucose tolerance test was implemented. According to the level of blood glucose, subjects were divided into three groups: healthy group (n=31), impaired glucose group (n=32), and diabetes group (n=32). Body weight, waist circumference, blood pressure, liver function, renal function, Ang1-7, angiotensin-converting enzyme(ACE)2 and other indicators were detected. Relationship between blood glucose and Ang1-7 and ACE2 were analyzed. In addition, ten healthy male Sprague-Dawley (SD) rats (150-200 g) were chosen to induce diabetes through intraperitoneal injection of streptozotocin, and all succeeded. Ten diabetic rats were randomly divided into Ang1-7 group and diabetes group according to the random number method, and pumped into Ang1-7 or saline solution, respectively, with five rats in each group. Other five healthy SD rats were chosen as normal group. All rats were sacrificed after intervention for two weeks. Kidney specimens were used to test the level of ER stress proteins, including glucose-regulated protein(GRP)78, activity of transcription factor (ATF)4, enhancer binding protein homologous protein (CHOP), by Western Blotting and Real-time Quantitative PCR.ResultsCompared with healthy group, levels of triglycerides, ACE2, Ang1-7 in impaired glucose group and diabetes group were increased,especially the diabetes group(F=5.57,6.12,5.44, allP<0.01).Pearsoncorrelation analysis showed that fasting blood glucose and postprandial blood glucose in diabetes group and impaired glucose group were positive correlated with Ang1-7(r=0.69,0.45,allP<0.01;r=0.54,0.52,allP<0.01). Compared with normal group, levels of GRP78, ATF4, and CHOP were increased significantly in diabetes group; compared with diabetes group, levels of GRP78, ATF4, and CHOP were significantly reduced in Ang1-7 group(t=20.3, 25.7, 19.6, allP<0.05). Compared with normal group, mRNA levels of GRP78, ATF4, and CHOP were increased significantly in diabetes group; compared with diabetes group, levels of GRP78, ATF4, and CHOP were significantly reduced in Ang1-7 group (t=15.1, 11.6, 12.3, allP<0.05).ConclusionsThe level of Ang1-7 evelates with the increase of blood glucose concentration in subjects. Ang1-7 reduces ER stress in the kidney of diabetic rats.
Angiotensin 1-7; Diabetes mellitus; Diabetic kidney disease; Endoplasmic reticulum stress
10.3760/cma.j.issn.1673-4157.2016.03.04
300070 天津医科大学代谢病医院糖尿病神经内科,卫生部激素与发育重点实验室(刘艳,谢云);
300280 天津海滨人民医院内分泌科(刘艳,田秀标,韩颖,石节丽,徐福娟,高鹏飞),消化科(张秋羽)
谢云,Email: tjxieyun0108@sina.com
2015-09-26)
