糖尿病结肠动力障碍大鼠结肠Cajal间质细胞凋亡和间隙连接蛋白43的表达
2016-11-24孙曼怡
孙曼怡
·论著·
糖尿病结肠动力障碍大鼠结肠Cajal间质细胞凋亡和间隙连接蛋白43的表达
孙曼怡
目的探讨糖尿病结肠动力障碍大鼠结肠Cajal间质细胞(ICC)的凋亡及ICC的间隙连接蛋白43(Cx43)表达的变化在结肠动力障碍发生中的意义。方法雄性Sprague-Dawley(SD)大鼠36只,根据体质量及血糖按随机数字表法分为正常6周组、正常10周组、糖尿病6周组、糖尿病10周组,每组9只。腹腔注射链脲佐菌素建立糖尿病模型,检测体质量、空腹血糖及胃肠推进率; HE染色观察ICC;TUNEL法检测ICC的凋亡指数;免疫组化检测ICC的c-Kit、Cx43蛋白表达。结果(1)糖尿病组较同时间点正常组体质量下降,空腹血糖升高,胃肠推进率降低, ICC的c-Kit、Cx43蛋白表达降低(F=76.68,1 397.24,18.87,137.65,87.73,P均<0.05)。(2)糖尿病10周组较糖尿病6周组空腹血糖升高,胃肠推进率降低, ICC的c-Kit、Cx43蛋白表达降低(F=76.68,1 397.24,18.87,137.65,87.73,P均<0.05)。(3)糖尿病组ICC的凋亡指数与同时间点正常组相比,差异无统计学意义;糖尿病10周组与糖尿病 6周组ICC的凋亡指数差异也无统计学意义(P均>0.05)。结论ICC数量减少、Cx43蛋白表达降低可能是糖尿病结肠动力障碍的发生机制之一,且上述改变随病程发展而加重;ICC数量减少可能与ICC凋亡无关。
Cajal间质细胞;细胞凋亡;间隙连接蛋白43;糖尿病
结肠动力障碍是糖尿病的常见并发症,其发病机制尚不清楚[1]。结肠Cajal间质细胞(ICC)是胃肠运动的起搏细胞,可调节胃肠道平滑肌运动[2]。本实验以糖尿病大鼠为研究对象,采用TUNEL法和免疫组化检测ICC的凋亡和间隙连接蛋白43(Cx43)的表达情况,以探讨其与糖尿病结肠动力障碍的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物分组和糖尿病模型建立 清洁级健康雄性成年Sprague-Dawley(SD)大鼠(许可证号:SCXK-军2007-004,批号:0024045) 45只,体质量230~270 g,购自中国人民解放军军事医学科学院,造模前按体质量根据随机数字表将大鼠随机分为正常组18只和造模组27只。造模组大鼠禁食12 h后,尾静脉注射链脲佐菌素40 mg/kg 1次,72 h后尾静脉采血,测得血糖≥16.7 mmol/L且能维持1周以上者为造模成功;正常组给予等量0.1 mol/L枸橼酸缓冲液注射。共25只大鼠造模成功,在造模成功大鼠中按照血糖值随机抽取18只,分为糖尿病6周组和糖尿病10周组。正常组进一步分为正常6周组和正常10周组,每组9只。所有进入实验的大鼠每周尾静脉采血,以拜安捷血糖仪测空腹血糖。正常组和糖尿病组分别于造模成功后第6周、第10周处死。
1.1.2 主要试剂 细胞凋亡测试盒购自美国Roche公司,兔抗大鼠c-Kit多克隆抗体购自美国Santa cruz公司,兔抗大鼠Cx43多克隆抗体购自北京博奥森生物技术有限公司。
1.2 方法
1.2.1 胃肠推进率测定 各组大鼠处死前予100 g/L活性炭(10 ml/kg)灌胃,30 min后处死,取出全胃肠道,计算无张力下胃肠推进率(胃肠推进率=活性炭前端至幽门括约肌的距离/幽门括约肌至肛门距离×100%)。
1.2.2 TUNEL检测ICC凋亡 石蜡切片于60℃烤60 min,充分融蜡;常规二甲苯脱蜡;梯度乙醇脱苯,0.01% PBS内浸泡2次;3% H2O2/甲醇中浸泡15 min;将细胞通透液0.1% TritonX-100滴加于样本上,孵育8 min,PBS浸洗2次;另取3 U/ml DNase孵育阳性对照片10 min;配制TUNEL反应混合物:50 μl酶溶液 +450 μl标记液=500 μl TUNEL反应混合物,离心混匀;切片在PBS中洗2次,擦干样品周围区域,样本切片和阳性对照片各加50 μl TUNEL反应混合物,阴性对照片加50 μl标记液(不加入酶溶液),放入暗湿化盒,37℃孵育60 min,PBS中洗3次;加1滴PBS在荧光显微镜下观察并拍照,激发光波长450~500 nm,检测波范围515~565 nm(绿色);擦干标本周围区域,加 50 μl Converter-POD,37℃下在无光湿化盒内孵育 30 min,PBS浸洗3次;DAB显色,光学显微镜下观察并适时放入纯水中涮洗终止反应;苏木素复染;1%盐酸乙醇液分化 20 s,自来水充分冲洗10 min;1%碳酸锂 20 s,自来水洗5 min;梯度乙醇浸泡各3 min;二甲苯Ⅰ、Ⅱ浸泡各5 min;中性树胶封片,显微镜下观察并拍照。
1.2.3 免疫组化检测ICC的c-Kit、Cx43表达 对切片进行常规脱蜡,PBS浸泡;将切片浸入0.01 mol/L枸橼酸盐缓冲液,微波炉中火加热5 min,冷却至室温,PBS冲洗;3 %H2O2室温孵育10 min,消除内源性过氧化物酶的活性,PBS冲洗;滴加1∶25兔抗大鼠c-Kit、Cx43多克隆抗体,湿盒孵育,4℃过夜,PBS冲洗;滴加HRP标记山羊抗兔二抗,37℃恒温箱孵育30 min,PBS冲洗;滴加DAB,室温显色,镜下控制显色时间,蒸馏水洗涤终止反应;苏木素复染,盐酸乙醇分化,常规脱水、透明、中性树脂封片,显微镜观察。采用Image Pro-Plus 6.0图像分析软件分析处理所有标本免疫组织化学图像。每张切片在200×镜下观察,以积分吸光度(IA)为指标进行图像分析。
1.2.4 HE染色观察ICC 对切片进行常规二甲苯脱蜡,梯度乙醇脱苯;移入苏木素中染色,自来水冲洗后移入伊红液中染色;梯度乙醇脱水,二甲苯浸泡;中性树胶封片。
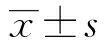
2 结果
2.1 一般情况比较 糖尿病组较同时间点正常组

表1 各组体质量、空腹血糖和胃肠推进率比较
注:与正常6周组相比,aP<0.01; 与同时间点正常组相比,bP<0.01;与糖尿病 6周组相比,cP<0.05
体质量下降、空腹血糖升高、胃肠推进率降低(P均<0.01);糖尿病10周组较糖尿病 6周组空腹血糖升高、胃肠推进率降低(P均<0.05),见表1。
2.2 ICC的HE染色 ICC分布于环行肌细胞之间、环行肌层的内表面及环行肌层与纵行肌层之间,往往与神经纤维末梢及神经束伴随存在,并由许多缝隙连接紧密连接在一起(图1,封3)。
2.3 ICC的TUNEL染色 测定的凋亡指数,正常6周组为2.64±0.48,正常10周组为2.60±0.50,糖尿病6周组为2.74±0.38,糖尿病10周组为2.62±0.41(F=0.18,P=0.91)。糖尿病组与同时间点正常组ICC的凋亡指数比较差异无统计学意义(P>0.05)。糖尿病10周组与糖尿病6周组ICC的凋亡指数比较差异无统计学意义(P>0.05)。正常6周组与正常10周组ICC的凋亡指数比较差异无统计学意义(P>0.05),见表2,图2(封3)。
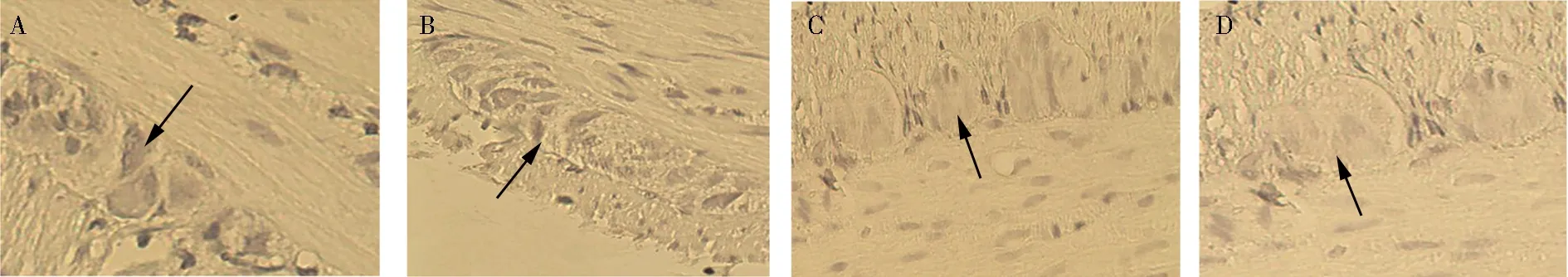
注:A.正常6周组;B.正常10周组;C.糖尿病 6周组;D.糖尿病10周组;箭头所指系DAB显色后凋亡的ICC;ICC:Cajal间质细胞图2 各组ICC 的TUNEL染色 (200×)
2.4 ICC的c-Kit和Cx43表达 c-Kit受体是ICC的特异性标记物,细胞质染色呈棕色者判定为c-Kit阳性细胞,检测c-Kit的表达可用来衡量ICC的数量。Cx43在ICC胞体和细胞突起上表达,其免疫组化阳性染色呈棕黄色。
糖尿病组较同时间点正常组ICC的c-Kit和Cx43免疫组化IOD值降低,差异有统计学意义(P均<0.01)。糖尿病10周组较糖尿病6周组ICC的c-Kit和Cx43免疫组化IOD值降低,差异有统计学意义(P均<0.01)。正常6周组与正常10周组ICC的c-Kit和Cx43免疫组化IOD值比较,差异无统计学意义(P均>0.05),见表2,图3(封3)。
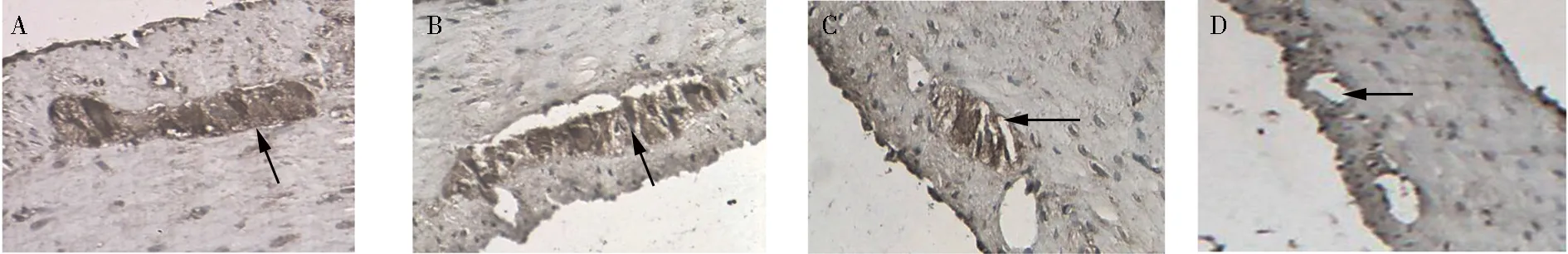
注:A.正常6周组;B.正常10周组;C.糖尿病 6周组;D.糖尿病10周组;ICC:Cajal间质细胞;Cx43:间隙连接蛋白43图3 各组ICC的Cx43免疫组化染色(400×)

表2 各组ICC的c-Kit和Cx43免疫组化染色IOD值比较
注:与同时间点正常组相比,aP<0.01;与糖尿病6周组相比,bP<0.01;Cx43:间隙连接蛋白43
3 讨论
糖尿病结肠动力障碍以腹胀和便秘为特征,其病理生理特点为结肠张力和收缩力降低,蠕动减慢,排空延迟[3]。既往对糖尿病胃肠功能障碍发病机制的研究多集中于自主神经病变、高血糖、激素分泌异常等[4-5]。但这些因素不能完全解释其发病机制,近年来ICC、胰岛素样生长因子、干细胞因子等在糖尿病胃肠功能紊乱发病机制中的作用逐渐得到重视[6-8]。ICC以网络状结构分布于消化道肠神经末梢和平滑肌之间,具有两大主要功能即作为胃肠道运动的起搏点和作为肠神经系统控制胃肠平滑肌细胞运动的中介,该细胞产生慢波并在时间、空间上控制胃肠道的收缩活动。本实验结果显示糖尿病结肠动力障碍大鼠的ICC数量明显减少,说明其作为结肠运动的起搏细胞和作为神经细胞控制肌细胞运动的中介功能显著减弱,导致肠道运动和吸收功能下降从而引起相应的症状,这一点和既往相关研究结果一致。细胞凋亡是指细胞在分化和发育过程中由基因调控而发生的主动的、自发性的死亡方式,可以被多种生理、病理性刺激诱发,是细胞对所处环境中某些特定信息的一种应答反应。大量研究证实细胞凋亡参与了糖尿病多种并发症的发生[9]。但本实验发现模型大鼠ICC的凋亡与正常大鼠相比无显著差异,提示模型大鼠ICC数量的减少可能与细胞凋亡无关。既往文献报导c-Kit信号是ICC表型发育的必要因素,缺乏此信号ICC会转化为平滑肌表型细胞。本实验结果显示模型大鼠ICC的c-Kit表达降低,由此推测减少的ICC可能转化为平滑肌细胞。
间隙连接是细胞间主要通讯方式之一,其蛋白成分称为连接蛋白,与神经细胞及平滑肌细胞之间具有丰富的间隙连接是ICC的显著结构特点[10]。Cx43是最重要的间隙连接蛋白[11]。以Cx43为基础构成的间隙连接是ICC的重要功能型间隙连接通道,是胃肠运动功能活动整合协调的主要结构之一,扩布的动作电位在间隙连接通道进行整合,从而刺激或抑制平滑肌细胞收缩。吴汉妮等[12]研究发现糖尿病胃轻瘫大鼠胃ICC的Cx43表达减少,提示其可能促使胃肠运动障碍的发生及发展。本实验结果显示糖尿病结肠动力障碍大鼠ICC的Cx43表达降低,由此推测可能存在ICC之间信息及信号转导失控,进而影响ICC介导的慢波传播和神经肌肉信号转导引起结肠动力障碍。
另外,本实验结果还显示ICC数量减少和Cx43蛋白表达下降与糖尿病的病程相关,有随病程进展而改变愈加明显的趋势,同时糖尿病10周组大鼠比糖尿病6周组的胃肠推进率进一步下降,由此推测,ICC异常改变可能是糖尿病结肠动力障碍的发病机制之一,同时也为该病的预防和治疗提供理论依据。
[1] Sun M, Wang F, Feng P. Insulin-like growth factor-1 inhibits colonic smooth muscle cell apoptosis in diabetic rats with colonic dysmotility[J].Regul Pept,2014,194-195:41-48. DOI: 10.1016/j.regpep.2014.11.005.
[2] Kondo J, Powell AE, Wang Y, et al. LRIG1 regulates ontogeny of smooth muscle-derived subsets of interstitial cells of Cajal in mice[J].Gastroenterology,2015,149(2):407-419.e8. DOI: 10.1053/j.gastro.2015.04.018.
[3] Xie DP, Li S, Li L,et al. Beta-arrestin2 is involved in the increase of distal colonic contraction in diabetic rats[J].Regul Pept,2013,185:29-33. DOI: 10.1016/j.regpep.2013.06.006.
[4] 卢静,魏良洲,田字彬,等.血糖变化对糖尿病大鼠胃排空功能与Leptin表达的影响[J].世界华人消化杂志,2007,15(32):3435-3438.
[5] 柯美云,蓝宇.糖尿病胃肠并发症的动力障碍及其机制[J].中华内分泌代谢杂志, 2003,19(3) :164-165.
[6] Domènech A, Pasquinelli G, De Giorgio R, et al. Morphofunctional changes underlying intestinal dysmotility in diabetic RIP-Ⅰ/hIFNβ transgenic mice[J].Int J Exp Pathol,2011,92(6):400-412. DOI: 10.1111/j.1365-2613.2011.00789.x.
[7] Zhang GQ, Yang S, Li XS,et al. Expression and possible role of IGF-IR in the mouse gastric myenteric plexus and smooth muscles[J].Acta Histochem,2014,116(5):788-794. DOI: 10.1016/j.acthis.2014.01.011.
[8] Wang Y, Xu XY, Tang YR,et al. Effect of endogenous insulin-like growth factor and stem cell factor on diabetic colonic dysmotility[J].World J Gastroenterol,2013,19(21):3324-31.DOI: 10.3748/wjg.v19.i21.3324.
[9] Jiang N, Chen XL, Yang HW, et al. Effects of nuclear factor κB expression on retinal neovascularization and apoptosis in a diabetic retinopathy rat model[J].Int J Ophthalmol,2015,8(3):448-452. DOI: 10.3980/j.issn.2222-3959.2015.03.03.
[10] 李冉, 齐清会, 谢明征,等. 香砂六君子汤对脾气虚证大鼠胃Cajal间质细胞、缝隙连接损伤的修复作用[J].中国中西医结合杂志, 2014,34(10):1216-1219.
[11] Qiu X, Cheng JC, Zhao J,et al. Transforming growth factor-β stimulates human ovarian cancer cell migration by up-regulating connexin43 expression via Smad2/3 signaling[J].Cell Signal,2015,27(10):1956-1962. DOI: 10.1016/j.cellsig.2015.07.010.
[12] 吴汉妮,田晗,张喜婷,等.Cajal间质细胞和间隙连接蛋白43参与糖尿病胃轻瘫机制的实验研究[J].中华内分泌代谢杂志, 2007, 23(6):555-556.
Apoptosisandconnexin43expressionincolonicinterstitialcellsofCajalindiabeticratswithcolonicdysmotility
SunManyi.
DepartmentofGastroenterology,TianjinUnionMedicineCentre,Tianjin300121,China
SunManyi,Email:cdj68000@sina.com
ObjectiveTo investigate the apoptosis and expression of connexin 43 (Cx43) of colonic interstitial cells of Cajal (ICC) in diabetic rats with colonic dysmotility, and explore their value in the development of colonic dysmotility.MethodsThirty-six male Sprague-Dawley(SD) rats were divided into 4 groups which included normal 6 weeks group, normal 10 weeks group, diabetes mellitus (DM) 6 weeks group and DM 10 weeks group (n=9) by random digital table method according to weight and fasting blood glucose (FBG). DM was induced by streptozotocin. Weight, FBG and gastrointestinal transit rate were detected. HE staining was used to examined ICC. TUNEL was used to detect apoptosis index (AI) of ICC. Immunohistochemistry was used to detect the protein expressions of c-Kit and Cx43 of ICC.Results(1)Compared with normal group, level of FBG was higher, while weight, gastrointestinal transit rate,protein expressions of c-Kit and Cx43 of ICC were lower in DM group(F=76.68,1 397.24,18.87,137.65,87.73, allP<0.05).(2)Compared with DM 6 weeks group, level of FBG was higher, while weight, gastrointestinal transit rate, protein expressions of c-Kit and Cx43 of ICC were lower in DM 10 weeks group(F=76.68,1 397.24,18.87,137.65,87.73, allP<0.05).(3)There was no difference between AI of ICC in DM group and normal group, and so was between DM 10 weeks group and DM 6 weeks group(allP>0.05).ConclusionsDecrease of ICC and less expression of Cx43 maybe one of the mechanisms of diabetic colonic dysmotility, and the changes above become more significant with the development of disease. Decrease of ICC may be not associated with the apoptosis of ICC.
Interstitial cells of Cajal; Apoptosis; Connexin 43; Diabetes mellitus
10.3760/cma.j.issn.1673-4157.2016.03.05
300121 天津市人民医院消化科
孙曼怡,Email:cdj68000@sina.com
2015-09-10)
