雷公藤多苷对糖尿病肾病大鼠核因子-κB信号通路的影响
2016-11-24杨薇李春君孙蓓厉莉王珊珊郭欣张晓娜马泽军陈莉明
杨薇 李春君 孙蓓 厉莉 王珊珊 郭欣 张晓娜 马泽军 陈莉明
·论著·
雷公藤多苷对糖尿病肾病大鼠核因子-κB信号通路的影响
杨薇 李春君 孙蓓 厉莉 王珊珊 郭欣 张晓娜 马泽军 陈莉明
目的探讨不同剂量雷公藤多苷(TWP)对糖尿病肾病(DN)大鼠肾组织核因子-κB信号通路的影响。方法选取60只Sprague-Dawley(SD)大鼠,给予高糖、高脂饮食联合尾静脉注射链脲佐菌素(30 mg/kg)建立DN大鼠模型。将成模大鼠按照随机数字表法分为DN对照组(DNC组,n=8)、低剂量TWP治疗组(3 mg·kg-1·d-1,n=8)、中剂量TWP治疗组(6 mg·kg-1·d-1,n=8)、高剂量TWP治疗组(9 mg·kg-1·d-1,n=10)。选取10只大鼠作为正常对照组(NC组),喂养常规饲料,灌胃8周后检测大鼠的体重、肾重体重比、尿微量白蛋白、血糖、肝功能、肾功能,并采用HE染色观察肾脏形态改变,分别采用免疫组化法、q-PCR法、Western印迹方法对大鼠肾脏核因子-κB、细胞间黏附分子-1(ICAM-1)以及白细胞介素-6(IL-6)进行定位定量分析(以观察不同剂量TWP对大鼠肾脏核因子-κB、ICAM-1、IL-6表达的影响)。结果TWP治疗可减少尿白蛋白,但对体重、血糖、肝功能、肾功能无影响,可降低DN大鼠肾脏核因子-κB、ICAM-1、IL-6 mRNA(t核因子-κB=8.89~16.88,tICAM-1=9.56~15.92,tIL-6=10.16~25.78,P均<0.05及蛋白(t核因子-κB=9.87~17.38,tICAM-1=8.54~16.95,tIL-6=9.76~20.18,P均<0.05)表达,且呈剂量依赖性,中高剂量TWP抑制更明显(P均<0.05)。结论TWP呈剂量依懒性抑制DN大鼠肾组织核因子-κB炎性反应信号通路。
雷公藤多苷;糖尿病肾病;核因子-κB;细胞间黏附分子-1;白细胞介素-6
糖尿肾病(DN)是糖尿病患者的微血管并发症之一,是由多种因素相互作用所引起的一种低度炎性疾病[1]。大量研究证实,炎性反应因子对DN的发生、发展发挥重要作用[2]。其中核因子-κB信号通路是介导慢性炎性反应的经典通路,核因子-κB是细胞间黏附分子-1(ICAM-1)和白细胞介素-6(IL-6)的上游因子[3]。同时ICAM-1、IL-6可加速DN进展,因此抑制核因子-κB信号通路可以延缓DN的进展,提示核因子-κB有可能成为DN的治疗位点[4]。雷公藤多苷(TWP)是一种植物免疫抑制剂,能够抑制多种炎性反应信号通路,具有独特的抗炎、抗免疫作用[5]。本研究以DN大鼠为研究对象,旨在观察不同剂量TWP对肾组织核因子-κB、ICAM-1、IL-6 mRNA和蛋白表达的影响。
1 材料与方法
1.1 材料 主要试剂与仪器:(1)链脲佐菌素(STZ,美国Sigma公司)。(2)TWP片(浙江得恩德制药公司)。(3)抗核因子-κB、ICAM-1、IL-6单克隆抗体(美国Abcam公司),抗GAPDH抗体(天津三箭生物技术有限公司)。(4)SYBR q-PCR试剂盒(大连宝生物工程有限公司),cDNA逆转录试剂盒(Thermo公司)。(5)凝胶成像仪(美国BIO-RAD公司)。(6)实时荧光定量PCR仪(日本Roche公司)。
1.2 方法
1.2.1 动物造模及分组 6周龄清洁级雄性Spraugue-Dawley(SD)大鼠70只,体质量(161±9)g,予常规饲料适应性喂养1周后,按随机数字表法进行分组,随机选取10只大鼠作为正常对照组(NC组),继续喂养常规饲料,其余60只作为DN模型组给予高糖、高脂饲料(具体配方为:蔗糖10%,猪油10%,胆固醇1%,胆酸钠0.3%)。喂养8周后,高糖、高脂饲料组大鼠尾静脉注射STZ 30 mg/kg,NC组予以尾静脉注射等体积柠檬酸缓冲液[6]。共成模56只,将成模大鼠按随机数字表法分为DN对照组(DNC组)、低剂量TWP治疗组(3 mg·kg-1·d-1)、中剂量TWP治疗组(6 mg·kg-1·d-1)、高剂量TWP治疗组(9 mg·kg-1·d-1)。不同剂量TWP治疗组灌胃给药,而NC组和DNC组分别灌胃等量柠檬酸-柠檬酸钠缓冲液灌胃8周后,成模大鼠共死亡22只。最终每组只数分别为:NC组10只,DNC组8只,低剂量TWP治疗组8只,中剂量TWP治疗组8只,高剂量TWP治疗组10只。
1.2.2 标本收集与处理 在灌胃8周后测定各组大鼠的体重、随机血糖,股动脉取血用于检测肝、肾功能,收集每只大鼠24 h尿液(将大鼠置于代谢笼内,每笼6~8只),用于检测尿微量白蛋白。
1.2.3 肾脏组织病理学 灌胃第8周末处死大鼠后,分别取出两肾,以冰PBS灌注冲洗干净,滤纸吸除多余水分。右肾于称重后置于4%多聚甲醛固定,取少量肾组织,常规制片,进行HE染色。
1.2.4 免疫组化检测核因子-κB表达 将肾组织切片置于60℃恒温箱中烘烤20~30 min,取出后静置5 min,然后依次将载玻片放入二甲苯Ⅰ及不同浓度酒精中脱蜡,脱蜡后进行抗原修复,然后滴加核因子-κB抗体(1∶100),滴加二氨基联苯胺反应底物显色,苏木素复染,浸泡、脱水、封片。
1.2.5 q-PCR法检测核因子-κB、ICAM-1、IL-6的mRNA表达 Trizol法提取大鼠肾组织总RNA,取2 μg RNA进行反转录合成cDNA,反应体系包括:4.0 μl RT Buffer(5×),1.0 μl RiboLock RNase Inhibitor,2.0 μl 10 mmol/L dNTP Mix,1.0 μl RevertAid Reverse Transcriptase,1.0 μl Oligo(dT)18 Primer,RNA sample 和 ddH2O。 PCR扩增目的基因,扩增时反应体系包括:5 μl 2×SYBR®Premix Ex TaqTM,0.5 μl 上游引物(10 μmol/L)及0.5 μl下游引物(10 μmol/L),1 μl DNA模板,3 μl H2O。反应条件:95℃ 5 min预变性;95℃ 15 s变性,60℃ 40 s退火并延伸;循环40次。目的片段引物用Oligo 6.0软件设计(表1),由北京奥科生物技术公司合成。用凝胶图像系统成像及进行扫描定量分析,以所测得净光密度与内参照净光密度的比值代表半定量值,进行统计分析。
1.2.6 Western印迹法检测核因子-κB、ICAM-1、IL-6的蛋白表达 RIPA裂解液裂解大鼠肾组织,离心提取上清液,40 μg蛋白上样于12%聚丙烯酰胺凝胶,电泳后转膜于0.45 μm PVDF膜。封闭2 h,加入特异性一抗(GAPDH 1∶10 000、核因子-κB 1∶1 000、ICAM-1 1∶500、IL-6 1∶1 000)4℃孵育过夜,洗膜后加入辣根过氧化物酶标记的抗兔或抗小鼠IgG(1∶10 000)室温孵育1 h。最后用ECL化学发光剂染色、显影。以凝胶成像系统记录观察结果,采用2Del凝胶分析软件对电泳结果进行扫描,将核因子-κB、ICAM-1、IL-6条带与GAPDH条带灰度值比值表示各指标的蛋白相对表达量。
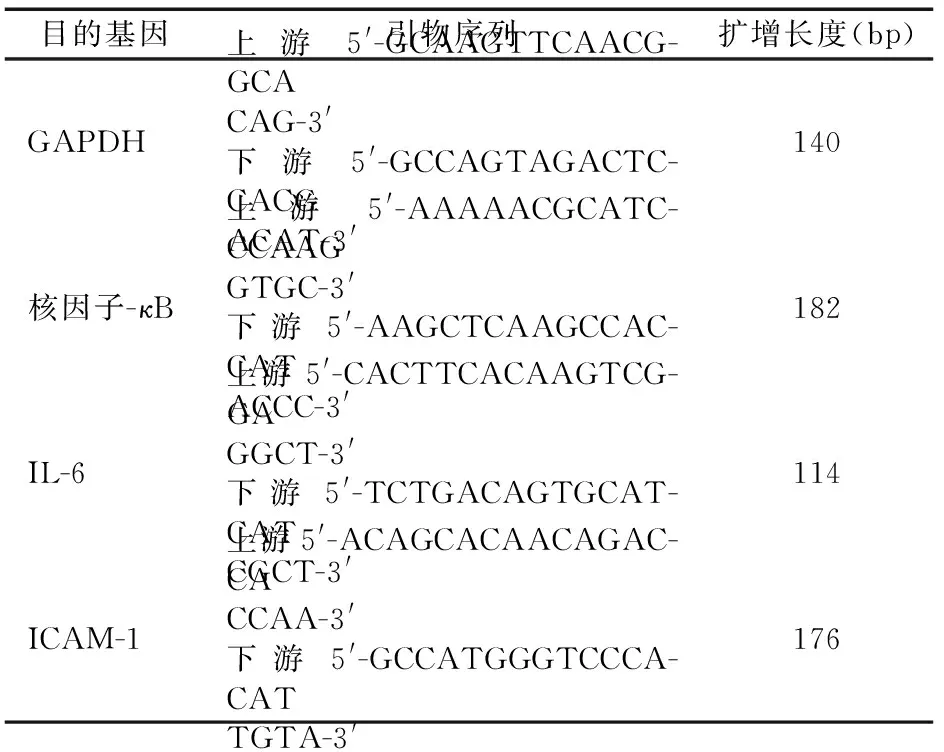
表1 各目的基因的引物序列及扩增长度
注:IL-6:白细胞介素-6;ICAM-1:细胞间黏附分子-1

2 结果
2.1 一般指标变化 与NC组相比,DNC组血糖及尿微量白蛋白水平升高,体重降低(P均<0.05);与DNC组相比,各剂量TWP治疗组血糖、体重差异均无统计学意义(P均>0.05),而尿微量白蛋白明显减少(P<0.05),且中、高剂量TWP治疗组较低剂量TWP治疗组减少更明显,呈剂量依赖性。各组肝、肾功能比较,差异无统计学意义(P>0.05),见表2。
2.2 肾组织HE染色结果 光镜下观察,NC组肾小球形态规则,无明显肾小球基底膜增厚及其他明显病变(图1A,封3);DNC组可见肾小球体积略增大,肾小球基底膜明显增厚、系膜基质增生,部分肾小球内皮细胞呈空泡变性(图1B,封3)。而经TWP治疗后的肾小球上述病理改变有不同程度改善,而且中、高剂量TWP治疗组改善更加明显,图1C~E(封3)。
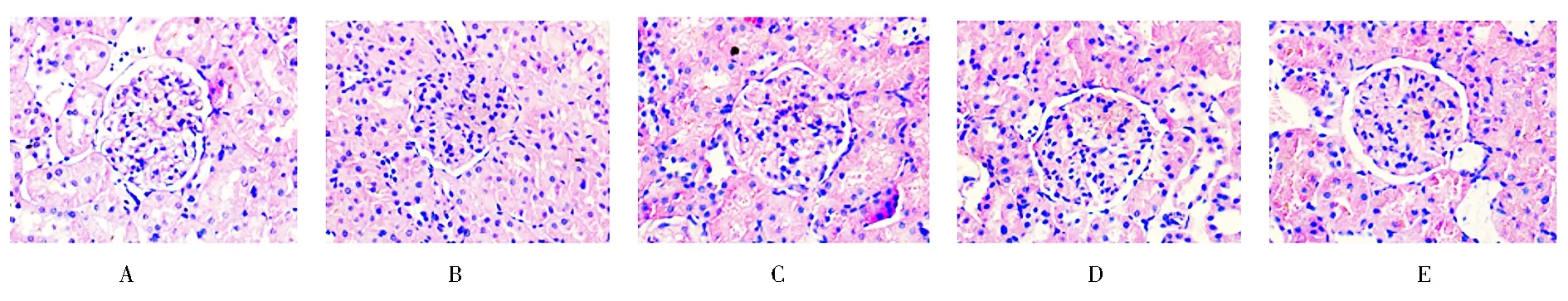
注:A为正常对照组:肾小球形态规则,无明显肾小球基底膜增厚;B为糖尿病肾病对照组:肾小球体积略增大,炎性细胞浸润明显,肾小球基底膜明显增厚、系膜基质增生,部分肾小球内皮细胞呈空泡变性;C为低剂量雷公藤多苷治疗组:肾小球基底膜增厚减轻,炎细胞浸润减少;D为中剂量雷公藤多苷治疗组:肾小球形态基本规则,炎细胞浸润减少,系膜基质增生缓解;E为高剂量雷公藤多苷治疗组:肾小球形态接近正常对照组,基底膜增厚不明显,炎细胞浸润明显减少图1 肾组织HE染色实验结果(400×)
2.3 肾组织免疫组化结果 免疫组化检测结果显示,NC组肾组织各部位少量核因子-κB表达(图2A,封3);DNC组肾小球大量表达核因子-κB(图2B,封3);而在不同剂量TWP治疗组肾小球表达核因子-κB逐渐减少(图2C~E,封3)。图像分析结果显示,DNC组核因子-κB表达增加,与NC组比较差异具有统计学意义(P<0.05);不同剂量TWP治疗组核因子-κB表达明显减少,与DNC组相比差异具有统计学意义(P<0.05),中高剂量TWP治疗组表达明显减少,与低剂量TWP治疗组相比差异有统计学意义(P<0.05),图2F(封3),图3。
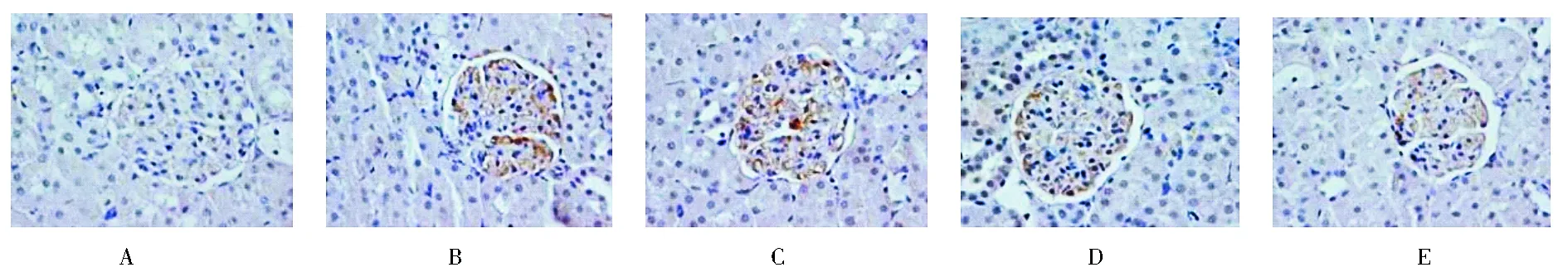
注:A为正常对照组:肾组织各部位无或少量核因子-κB表达,特异性染色颜色最浅;B为糖尿病肾病对照组:核因子-κB在肾小球大量表达,特异性染色颜色最深;C、D、E为低、中、高剂量雷公藤多苷治疗组:肾组织核因子-κB表达逐渐减少,特异性染色颜色逐渐变浅图2 肾组织核因子-κB免疫组化结果(400×)
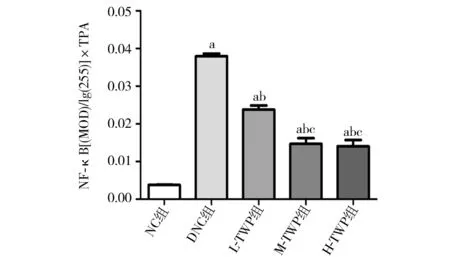
注:NC组:正常对照组;DNC组:糖尿病肾病对照组;L-TWP组:低剂量雷公藤多苷治疗组;M-TWP组:中剂量雷公藤多苷治疗组;H-TWP组:高剂量雷公藤多苷治疗组;NF-κB:核因子-κB;TPA:平均面积密度;与NC组相比,aP<0.05;与DNC组相比,bP<0.05;与L-TWP组相比,cP<0.05图3 免疫组化法对各组肾组织核因子-κB半定量分析
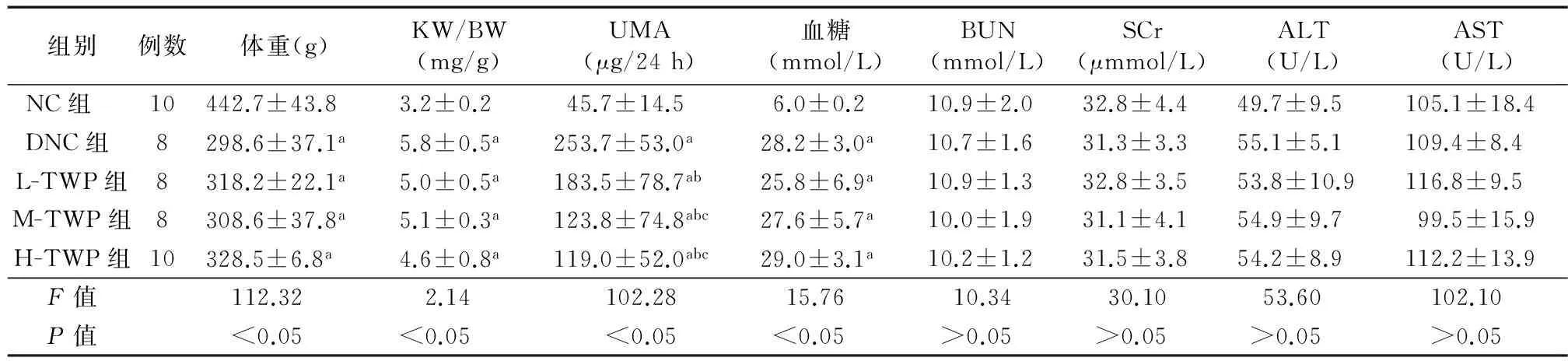
组别例数体重(g)KW/BW(mg/g)UMA(μg/24h)血糖(mmol/L)BUN(mmol/L)SCr(μmmol/L)ALT(U/L)AST(U/L)NC组10442.7±43.83.2±0.245.7±14.56.0±0.210.9±2.032.8±4.449.7±9.5105.1±18.4DNC组8298.6±37.1a5.8±0.5a253.7±53.0a28.2±3.0a10.7±1.631.3±3.355.1±5.1109.4±8.4L-TWP组8318.2±22.1a5.0±0.5a183.5±78.7ab25.8±6.9a10.9±1.332.8±3.553.8±10.9116.8±9.5M-TWP组8308.6±37.8a5.1±0.3a123.8±74.8abc27.6±5.7a10.0±1.931.1±4.154.9±9.799.5±15.9H-TWP组10328.5±6.8a4.6±0.8a119.0±52.0abc29.0±3.1a10.2±1.231.5±3.854.2±8.9112.2±13.9F值112.322.14102.2815.7610.3430.1053.60102.10P值<0.05<0.05<0.05<0.05>0.05>0.05>0.05>0.05
注:NC组:正常对照组;DNC组:糖尿病肾病对照组;L-TWP组:低剂量雷公藤多苷治疗组;M-TWP组:中剂量雷公藤多苷治疗组;H-TWP组:高剂量雷公藤多苷治疗组;KW/BW:肾重体重比;UMA:尿微量白蛋白;BUN:血尿素氮;SCr:血肌酐;ALT:谷丙转氨酶;AST:谷草转氨酶;与NC组对比,aP<0.05;与DNC组对比,bP<0.05;与L-TWP组相比,cP<0.05
2.4 肾脏核因子-κB、ICAM-1、IL-6 mRNA的表达 DNC组核因子-κB、ICAM-1、IL-6 mRNA表达量明显升高,与NC组相比差异具有统计学意义(P<0.05),TWP治疗组较DNC组有较大幅度降低(P<0.05),各治疗组间,中、高剂量TWP治疗组较低剂量TWP治疗组有较大幅度降低(P<0.05),见图4。
2.5 肾脏核因子-κB、ICAM-1、IL-6的蛋白表达 Western印迹结果显示,DNC组核因子-κB、ICAM-1、IL-6的蛋白表达量明显升高,与NC组相比差异具有统计学意义(P<0.05),TWP治疗组较DNC组有较大幅度降低(P<0.05),中、高剂量TWP治疗组较低剂量TWP治疗组有较大幅度降低(P<0.05),见图5。
3 讨论
炎性反应及炎性因子对促进DN的发生、发展发挥不可或缺的作用。有研究表明通过抑制核因子-κB炎性反应信号通路可延缓DN进展,提示核因子-κB是治疗DN的重要靶点[7]。研究已证实,在STZ诱导的糖尿病大鼠肾组织中,核因子-κB表达量明显增加,且与尿白蛋白水平呈正相关。人体研究亦发现,DN患者核因子-κB信号通路的活性高于无肾病的糖尿病患者,而且与尿白蛋白程度密切相关[8]。核因子-κB信号通路被激活后可调节促炎因子、黏附分子和趋化因子的基因表达[9]。ICAM-1和IL-6是核因子-κB的下游因子。
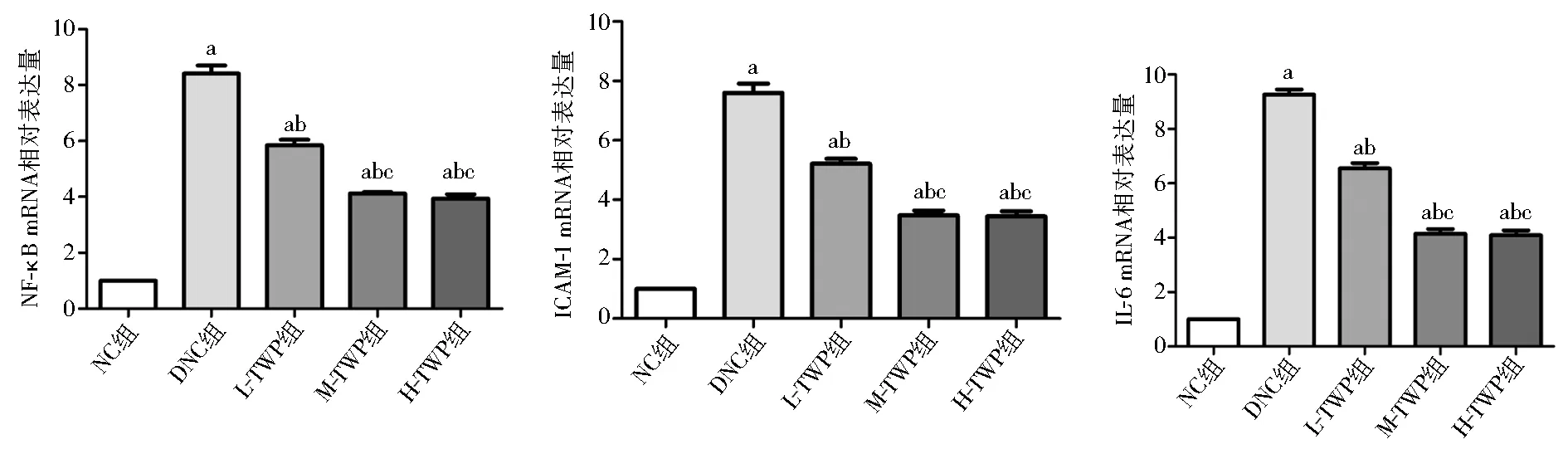
注:NC组:正常对照组;DNC组:糖尿病肾病对照组;L-TWP组:低剂量雷公藤多苷治疗组;M-TWP组:中剂量雷公藤多苷治疗组;H-TWP组:高剂量雷公藤多苷治疗组;NF-κB:核因子-κB;ICAM-1:细胞间黏附分子-1;IL-6:白细胞介素-6;与NC组相比,aP<0.05;与DNC组相比,bP<0.05;与L-TWP组相比,cP<0.05图4 PCR法检测各组肾组织中核因子-κB、ICAM-1、IL-6mRNA相对表达量
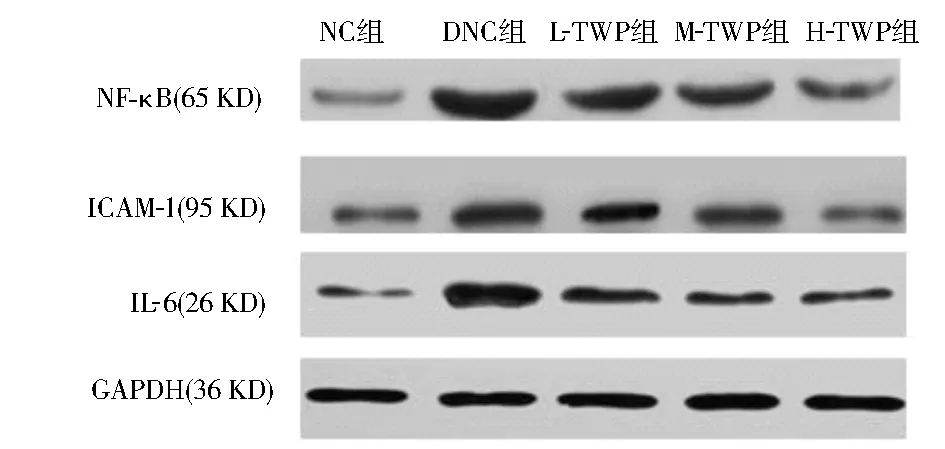
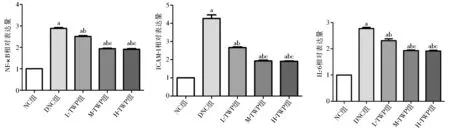
注:NC组:正常对照组;DNC组:糖尿病肾病对照组;L-TWP组:低剂量雷公藤多苷治疗组;M-TWP组:中剂量雷公藤多苷治疗组;H-TWP组:高剂量雷公藤多苷治疗组;NF-κB:核因子-κB;ICAM-1:细胞间黏附分子-1;IL-6:白细胞介素-6;与NC组相比,aP<0.05;与DNC组相比,bP<0.05;与L-TWP组相比,cP<0.05图5 Western印迹检测各组肾组织中核因子-κB、ICAM-1、IL-6蛋白的相对表达量
ICAM-1是细胞黏附分子免疫球蛋白家族中的重要成员,通过受体与配体结合,介导细胞之间,细胞和基质之间的黏附作用,是细胞浸润、细胞增殖、细胞外基质扩张及肾小球硬化的分子生物学基础[10]。而IL-6可促进糖尿病时肾小球纤维化的发生、发展。与既往的研究结果一致,本研究实验结果表明核因子-κB在NC组无或少量表达,而DNC组核因子-κB、ICAM-1、IL-6 mRNA及蛋白表达量明显增加,提示核因子-κB、ICAM-1、IL-6参与了DN的发生及发展过程。
TWP是卫矛科雷公藤植物的根,含少量二萜类及生物碱成分,具有抗炎、缓解肾脏系膜细胞及基质增生,改善电荷屏障等作用[11]。本研究发现DNC组尿白蛋白增多的同时伴随炎性因子核因子-κB、ICAM-1、IL-6升高,而经TWP治疗后,各治疗组白蛋白尿减少的同时伴随核因子-κB、ICAM-1、IL-6降低,首次证实TWP通过抑制核因子-κB信号通路来延缓DN进展。
TWP抑制免疫作用表现为抑制细胞免疫和体液免疫[5]。本研究同样发现不同剂量TWP治疗组能够呈剂量依赖性降低核因子-κB、ICAM-1、IL-6水平,尤其在中、高剂量组作用更明显。然而,由于TWP剂量过大所致的肝、肾毒性,使其临床应用一直存在争议,孔岩等[12]已证实,当TWP剂量达到24 mg·kg-1·d-1时,可导致肾毒性。而本研究最高剂量为9 mg·kg-1·d-1,所以大鼠肝、肾功能未出现异常,本实验最后造模成功率为93.3%,大多数是在STZ注射1周内死亡,笔者将死亡大鼠进行尸检并抽取大鼠血液,并未发现肝、肾结构及功能的异常,考虑可能由于饲养时正值夏季酷暑,饲养室潮湿闷热,加之大鼠饮食不规律,免疫力低下,STZ注射后的二次创伤导致死亡。
本实验表明TWP能抑制DN大鼠肾组织核因子-κB信号通路,从而下调ICAM-1和IL-6表达,减少白蛋白尿,表明TWP通过抑制核因子-κB信号通路发挥对DN大鼠肾脏的保护作用。然而,本课题只进行了动物研究,还需体外实验,进一步探究核因子-κB信号通路在DN进展中的作用机制。
[1] Navarro-González JF, Mora-Fernández C, Muros de Fuentes M,et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol, 2011,7(6):327-340.DOI: 10.1038/nrneph.2011.51.
[2] Fornoni A, Ijaz A, Tejada T, et al. Role of inflammation in diabetic nephropathy[J].Curr Diabetes Rev,2008,4(1):10-17.
[3] Chen Y, Sun T, Wu J, et al. Icariin intervenes in cardiac inflammaging through upregulation of SIRT6 enzyme activity and inhibition of the NF-kappa B pathway[J]. Biomed Res Int,2015,2015:895976.DOI: 10.1155/2015/895976.
[4] Fang Q, Zhao L, Wang Y, et al. A novel chalcone derivative attenuates the diabetes-induced renal injury via inhibition of high glucose-mediated inflammatory response and macrophage infiltration[J].Toxicol Appl Pharmacol,2015, 282(2):129-138.DOI: 10.1016/j.taap.2014.10.021.
[5] 刘国玲,沈永杰,尤丽菊等. 雷公藤多苷降低糖尿病肾病大鼠炎性细胞因子的表达[J].细胞与分子免疫学杂志,2014,30(7):721-724.
[6] Li D, Lu Z, Jia J,et al. MiR-124 is related to podocytic adhesive capacity damage in STZ-induced uninephrectomized diabetic rats[J].Kidney Blood Press Res, 2013,37(4-5):422-431.DOI: 10.1159/000355721.
[7] Wada J, Makino H. Inflammation and the pathogenesis of diabetic nephropathy[J].Clin Sci (Lond),2013,124(3):139-152. DOI: 10.1042/CS20120198.
[8] Hofmann MA, Schiekofer S, Isermann B, et al. Peripheral blood mononuclear cells isolated from patients with diabetic nephropathy show increased activation of the oxidative-stress sensitive transcription factor NF-kappaB[J].Diabetologia,1999, 42(2):222-232.
[9] Soetikno V, Sari FR, Veeraveedu PT,et al. Curcumin ameliorates macrophage infiltration by inhibiting NF-κB activation and proinflammatory cytokines in streptozotocin induced-diabetic nephropathy[J].Nutr Metab (Lond),2011,8(1):35. DOI: 10.1186/1743-7075-8-35.
[10] Chang CZ, Wu SC, Lin CL,et al. Valproic acid attenuates intercellular adhesion molecule-1 and E-selectin through a chemokine ligand 5 dependent mechanism and subarachnoid hemorrhage induced vasospasm in a rat model[J].J Inflamm (Lond),2015,12:27.DOI: 10.1186/s12950-015-0074-3. eCollection 2015.
[11] 赵晨光,于为民,任小军,等. 雷公藤多苷对糖尿病肾病大鼠肾小管间质激活素A表达及转分化的影响[J]. 中华医学杂志,2014,18(94):1427-1432.DOI:10.37601/cma.j.issn.0376-2491.2014.18.019.
[12] 孔岩,单春艳,常宝成,等. 雷公藤多甙对糖尿病肾病大鼠肾脏肿瘤坏死因子-α、白细胞介素-4表达和尿微量白蛋白的影响[J]. 中华糖尿病杂志,2013,5(9):541-546.DOI:10.3760/cma.j.issn.1674-5809.2013.09.006.
Effectsoftriperygiumwilfordiipolyglucosideonnuclearfactor-κBsignalingpathwayinratswithdiabeticnephropathy
YangWei*,LiChunjun,SunBei,LiLi,WangShanshan,GuoXin,ZhangXiaona,MaZejun,ChenLiming.
*TianjinMedicalUniversity,Tianjin300070,China
Correspondingauthor:ChenLiming,Email:xfx22081@vip.163.com
ObjectiveTo investigate the effects of different doses of triperygium wilfordii polyglucoside (TWP) on the nuclear factor-κB signaling pathway in rats with diabetic nephropathy (DN).MethodsA total of 60 Sprague-Dawley (SD) rats were seleted. DN rats model were established by high-glucose and high fat diet, in combination with streptozotocin injection from tail vein. DN rats were divided into diabetic normal control group (DNC group,n=8), low dose of TWP group(L-TWP group,3 mg·kg-1·d-1,n=8) group, median dose of TWP group(M-TWP group,6 mg·kg-1·d-1,n=8), and high dose of TWP group (H-TWP group,9 mg·kg-1·d-1,n=10) according to the random number table method. Ten healthy rats were used as control group. After 8 weeks of intervention, body weight(BW), kidney weight/body weight(KW/BW), urine microalbumin(UMA), blood glucose, liver function and renal function were examined. HE staining was used to observe the changes of kidney morphology. Immunohistochemical method, q-PCR and Western blotting were used to analyze the location and expression level of nuclear factor-κB, intercellular adhesion molecule-1(ICAM-1) and interleukin-6(IL-6). The effects of different doses of TWP on the expression of nuclear factor-κB, ICAM-1 and IL-6 in rats with DN.ResultsTWP therapy decreased UMA but did not affect BW, KW/BW, liver function and renal function. TWP also down-regulated the expression of nuclear factor-κB,ICAM-1,IL-6 mRNA (tNuclear factor-κB=8.89-16.88,tICAM-1=9.56-11.67,tIL-6=10.16-25.78, allP<0.05) as well as the protein level (tNuclear factor-κB=9.87-17.38,tICAM-1=8.54-16.95,tIL-6=9.76-20.18, allP<0.05) in dose-dependent manner; the effects were robust in L-TWP and H-TWP group (allP<0.05).ConclusionTWP suppresses inflammatory signaling pathways of nuclear factor-κB in a dose-dependent manner.
Triperygium wilfordii polyglucoside;Diabetic nephropathy; Nuclear factor-κB;Intercellular adhesion molecule-1;Interleukin-6
国家自然科学基金资助项目(81273915);天津市自然科学基金资助项目(14JCYBJC26200)
10.3760/cma.j.issn.1673-4157.2016.02.008
300070 天津医科大学(杨薇);300070 天津医科大学代谢病医院糖尿病肾病科,卫生部激素与发
育重点实验室(李春君,孙蓓,厉莉,王珊珊,郭欣,张晓娜,马泽军,陈莉明)
陈莉明,Email:xfx22081@vip.163.com
FundprogramNational Natural Science Foundation(81273915); Natural Science Foundation of Tianjin(14JCYBJC26200)
2016-07-09)
