间歇低氧对大鼠胰岛素抵抗及骨骼肌细胞GLUT4、Akt2的影响
2016-11-24汤玮娜任寿安
汤玮娜 任寿安
·论著·
间歇低氧对大鼠胰岛素抵抗及骨骼肌细胞GLUT4、Akt2的影响
汤玮娜 任寿安
目的检测不同间歇低氧暴露时间对骨骼肌葡萄糖转运蛋白(GLUT)4与蛋白激酶B(PKB/Akt)2表达的影响,探讨二者在间歇低氧导致胰岛素抵抗中的作用。方法选取健康雄性Sprague-Dawley大鼠40只,按照随机数字表法分为5组:常氧对照组(NC组),间歇低氧2周组(IH2组),间歇低氧4周组(IH4组),间歇低氧6周组(IH6组),间歇低氧8周组(IH8组),每组8只。IH2组、IH4组、IH6组、IH8组每天给予8 h间歇低氧暴露(9:00~17:00),NC组室内环境正常饲养。检测各组空腹血糖和空腹胰岛素水平,计算稳态模型评估-胰岛素抵抗指数(HOMA-IR)。采用免疫组织化学法检测大鼠骨骼肌GLUT4及Akt2蛋白的表达,蛋白表达量用平均灰度值表示,并分析GLUT4与Akt2的相关性。结果与NC组相比,IH2组、IH4组、IH6组、IH8组空腹血糖、HOMA-IR升高,骨骼肌GLUT4与Akt2灰度值升高,并且随间歇低氧暴露时间的延长而升高明显(F=87.67~288.63,P均<0.05);与NC组相比,IH2组、IH4组、IH6组、IH8组空腹胰岛素升高,其中IH2组、IH4组、IH6组,随间歇低氧暴露时间的延长而升高明显,IH8组较IH6组下降(F=86.04,P<0.01)。Pearson相关分析显示GLUT4与Akt2的表达呈正相关(r=0.895,P<0.05)。结论随着间歇低氧暴露时间的延长胰岛素抵抗程度增加,GLUT4与Akt2蛋白表达水平下降,二者在间歇低氧导致胰岛素抵抗的过程中起协同作用。
间歇低氧;葡萄糖转运蛋白4;蛋白激酶B2;胰岛素抵抗
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种常见疾病,在中年男性人群中发病率为4%,女性为2%,且有逐渐升高的趋势[1]。OSAHS是2型糖尿病(T2DM)的独立危险因素,中重度OSAHS患者具有更高的T2DM发病风险[2]。间歇低氧是OSAHS重要的病理生理基础,可诱发机体产生胰岛素抵抗,从而发展为T2DM[3-4]。胰岛素抵抗的特点之一是胰岛素敏感组织对葡萄糖摄取、利用障碍,其中骨骼肌是胰岛素作用的主要靶器官之一,对于维持血糖平衡起重要作用。而葡萄糖转运蛋白4(GLUT4)介导的葡萄糖跨膜转运又是葡萄糖利用和存储的主要限速步骤,蛋白激酶B(Akt)2是促进GLUT4囊泡易位到胞膜的重要信号分子[5-6]。本实验通过构建不同暴露时间的间歇低氧大鼠模型,评估各实验组的胰岛素抵抗水平,并检测骨骼肌胰岛素信号通路蛋白GLUT4与Akt2的变化,探讨间歇低氧导致胰岛素抵抗的可能作用机制。
1 材料与方法
1.1 实验动物及分组 健康成年雄性清洁级Sprague-Dawley(SD)大鼠40只[许可证号:SCXK(晋)2009-0001],体重180~200 g,由山西医科大学实验动物中心提供,实验期间实验动物饲养于山西医科大学呼吸实验室,标准饲养,自由饮食,室温25℃。按照随机数字表法分为5组,每组8只:常氧对照组(NC组),间歇低氧2周组(IH2组),间歇低氧4周组(IH4组),间歇低氧6周组(IH6组),间歇低氧8周组(IH8组)。
1.2 方法
1.2.1 间歇低氧模型建立 将间歇低氧组大鼠置于有机玻璃舱(65×50×45 cm3)内,由单片机控制系统(山西医科大学第一医院与太原理工大学联合研制)控制气体输入时间,先输入氮气60 s,使低氧舱内氧浓度由21%逐渐降至最低氧浓度8%,持续10 s后再通入氧气40 s,使低氧舱内浓度逐渐恢复至21%,整个循环共持续110 s,每天在间歇低氧舱内饲养8 h(9:00~17:00),分别于第2,4,6,8周后结束间歇低氧暴露。舱内氧浓度由便携式测氧仪(建德市新安江分析仪器二厂)实时监控,舱内CO2及水分由生石灰吸收。常氧对照组大鼠在室内空气环境中饲养。
1.2.2 标本采集 间歇低氧组大鼠分别于暴露第2,4,6,8周后禁饮食8 h,腹腔注射20%乌拉坦(5 ml/kg)麻醉,将其在动物实验台上仰卧位固定,鼠尾常规消毒,手术剪剪去 0.5 cm尾尖,医用血糖试纸收集尾静脉血用于检测血糖值。然后沿腹中线剪开腹壁,暴露腹主动脉,收集血液,离心机离心 5 min(3 000 r/min,r=190 mm),取上清液-80℃保存,用于检测胰岛素含量。剥离大鼠腓肠肌浸于中性甲醛固定48 h后常规石蜡包埋、切片。
1.2.3 空腹血糖、空腹胰岛素(FINS)测定及胰岛素抵抗评估 空腹血糖由便携式血糖仪(美国强生医疗器械公司)直接测量;FINS用大鼠胰岛素ELISA检测试剂盒(武汉博士德试剂公司)采用双抗酶联免疫法检测。计算稳态模型评估-胰岛素抵抗指数(HOMA-IR)=空腹血糖×FINS/22,空腹血糖单位为mmol/L,FINS单位为μIU/L。
1.2.4 免疫组织化学法检测GLUT4与Akt2 骨骼肌组织切片常规脱蜡至水化,枸橼酸盐缓冲液高压修复2 min,在3%过氧化氢甲醇液作用5 min,以清除内源性过氧化酶;牛血清白蛋白(BSA)室温下封闭15 min,滴加兔抗大鼠GLUT4、Akt2一抗(抗体浓度均为1∶100),PBS缓冲液代替一抗作为阴性对照,4℃冰箱过夜,PBS漂洗,按SABC试剂盒说明操作。DAB室温显色,PBS洗剂,苏木素复染,脱水、透明,中性树胶封片。切片在显微镜下观察、拍照,利用Image-Pro Plus图像软件进行灰度定量分析。
2 结果
2.1 间歇低氧对血清胰岛素、血糖及胰岛素抵抗的影响 与NC组相比,IH2组、IH4组、IH6组、IH8组在相应的间歇低氧暴露终点时空腹血糖水平、HOMA-IR均升高,并且均随着暴露时间的延长而升高(P均<0.05);同时,FINS水平亦升高,其中在IH2组、IH4组、IH6组随着暴露时间的延长而升高明显(P<0.05),但IH8组较IH6组有所下降(P<0.05),见表1。
2.2 GLUT4与Akt2免疫组化结果 两种蛋白均在骨骼肌细胞质中表达,显微镜下观察为棕黄色颗粒,各组切片显色见图1(封3)。经图像扫描分析以灰度值代表蛋白表达含量,灰度值越大蛋白表达越少,反之亦然。结果显示,与NC组相比各间歇低氧组GLUT4与Akt2平均灰度值升高具有统计学意义(P<0.05),并且随着间歇低氧暴露时间的增加GLUT4与Akt2平均灰度值升高更显著(P<0.05),见表2。Pearson相关分析显示GLUT4与Akt2平均灰度值呈正相关(r=0.895,P<0.05)。
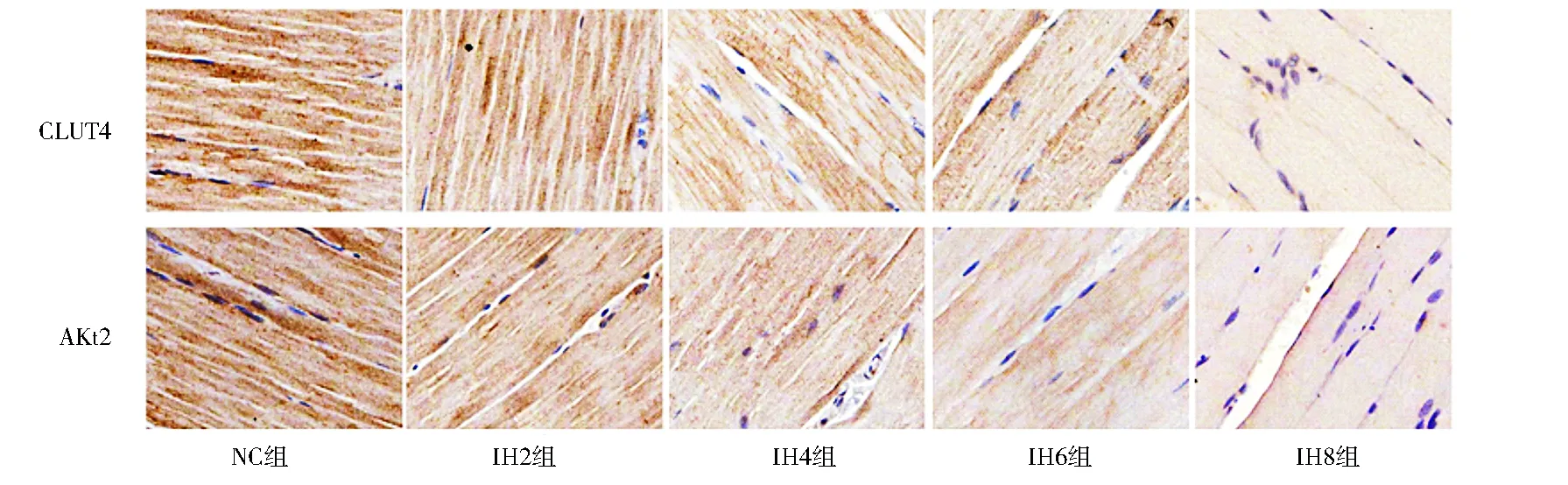
注:NC:常氧对照组;IH2:间歇低氧2周组;IH4:间歇低氧4周组;IH6:间歇低氧6周组;IH8:间歇低氧8周组;GLUT4:葡萄糖转运蛋白4;Akt2:蛋白激酶B2图1 大鼠骨骼肌细胞GLUT4、Akt2的表达(免疫组化染色,400×)
表1 各组血糖、胰岛素及HOMA-IR的比较
注:NC组:常氧对照组;IH2组:间歇低氧2周组;IH4组:间歇低氧4周组;IH6组:间歇低氧6周组;IH8组:间歇低氧8周组;HOMA-IR:稳态模型评估-胰岛素抵抗指数;与NC组相比,aP<0.01;与IH2组相比,bP<0.01;与IH4组相比,cP<0.01;与IH6组相比,dP<0.01;与IH4组相比,mP<0.05;与IH6组相比,nP<0.05
表2 各组大鼠骨骼肌GLUT4、Akt2
注:NC组:常氧对照组;IH2组:间歇低氧2周组;IH4组:间歇低氧4周组;IH6组:间歇低氧6周组;IH8组:间歇低氧8周组;GLUT4:葡萄糖转运蛋白4;Akt2:蛋白激酶B2;与NC组相比,aP<0.01;与IH2组相比,bP<0.01;与IH4组相比,cP<0.01;与IH6组相比,dP<0.01;与IH4组相比,mP<0.05;与IH6组相比,nP<0.05
3 讨论
近年来OSAHS对T2DM的影响越来越受到重视,研究发现T2DM发病率随着OSAHS的严重程度升高而升高,呼吸暂停低通气指数(AHI)>30次/h组与AHI<5次/h组相比,发生T2DM的OR值可达 3.48,而AHI>15次/h组与AHI<5次/h组相比,OR值仅为2.30[7]。目前建立间歇低氧动物模型是研究OSAHS与T2DM的主要研究模式,模型中间歇低氧循环周期多低于120 s/次以模拟重度OSAHS(AHI>30次/h),大量研究证实在此重度间歇低氧动物模型中可存在胰岛素抵抗、糖代谢紊乱[8]。但鲜有文献探讨间歇低氧暴露时间对胰岛素抵抗的累积作用。
在本研究中以两周间歇低氧暴露为一个时间节点,结果发现间歇低氧能够引起空腹血糖升高及胰岛素抵抗增强,并且随着暴露时间的延长血糖升高明显,胰岛素抵抗增强明显,可以推测间歇低氧的暴露时间是胰岛素抵抗的一个重要危险因素。亦有文献报道2周的间歇低氧就足以引起产生胰岛素抵抗[9]。提示临床工作中应对OSAHS患者进行早期干预,及早阻断间歇低氧的时间累积效应。但是IH8组与IH6组相比,FINS水平并没有相应升高。这可能由于长期的间歇低氧对胰岛β细胞已产生了功能性甚至器质性损害。根据血糖水平反馈的胰岛素的分泌依赖于组织正常供氧,持续的低氧会引起胰岛素分泌水平严重下降,在慢性间歇低氧小鼠中可以看到胰岛β细胞的死亡及胰岛素分泌水平的下降[10-11]。间歇低氧过程中产生的氧化应激产物活性氧簇也参与了胰腺的损伤[12]。由此推测长时间的间歇低氧暴露可能造成不可逆的胰岛素分泌紊乱,这也提示在临床工作中应重视OSAHS合并糖尿病患者的间歇低氧的纠正,否则后期可能会加大血糖控制的难度。
那么间歇低氧是如何导致胰岛素抵抗的呢?作为主要的胰岛素敏感器官之一,骨骼肌负责80%~90%胰岛素介导的葡萄糖摄取,破坏小鼠的GLUT4基因可导致严重的胰岛素抵抗和糖耐量减低[13]。Carreras等[14]发现间歇低氧可以影响GLUT4由胞质到胞膜的易位过程,使胞膜GLUT4含量下降,从而影响骨骼肌摄取葡萄糖,导致胰岛素抵抗。另外有研究发现慢性间歇低氧暴露(10%~21%,8 h/d,4周)严重阻碍了Akt的磷酸化[15]。Akt包括3种亚型,其中Akt2在胰岛素介导的葡萄糖摄取过程中起作用。胰岛素与细胞膜上的胰岛素受体结合促使Akt2磷酸化,然后经磷脂酰肌醇3激酶途径激活GLUT4进行葡萄糖跨膜转运,因此猜测GLUT4与Akt2在间歇低氧导致胰岛素抵抗的过程中可能具有相关性。本研究结果显示,与NC组相比,GLUT4与Akt2蛋白表达水平在间歇低氧组均明显下降(P<0.05),并且随着间歇低氧暴露时间的延长GLUT4、Akt2蛋白表达水平下降更为明显,相关性分析显示GLUT4的表达水平与Akt2的水平呈正相关(r=0.895,P<0.05),提示间歇低氧可能通过下调GLUT4、Akt2的表达水平导致胰岛素抵抗。但间歇低氧是分别直接作用于两个受体,还是通过减少Akt2继而引起GLUT4表达下调,或是通过降低GLUT4的表达进一步引起Akt2的表达减少,还有待于进一步研究证实。
综上所述,间歇低氧可以导致胰岛素抵抗,并且间歇暴露时间越长胰岛素抵抗越严重,这可能与间歇低氧降低了骨骼肌细胞GLUT4与Akt2的表达水平有关,二者在间歇低氧导致胰岛素抵抗过程中具有相关性。通过干预GLUT4与Akt2的表达可能为OSAHS合并糖尿患者的治疗的一个新思路。本研究以间歇低氧暴露时间为切点,研究间歇低氧对胰岛素抵抗的影响,但是间歇低氧的其他特征如低氧严重程度(最低氧饱和度)、每个间歇低氧循环的时间、每天的间歇低氧循环次数及相关的二氧化碳水平等与胰岛素抵抗的关系还有待于进一步研究。
[1] Jordan AS, McSharry DG, Malhotra A. Adult obstructive sleep apnoea[J].Lancet,2014,383(9918):736-747.DOI: 10.1016/S0140-6736(13)60734-5.
[2] Wang X, Bi Y, Zhang Q,et al. Obstructive sleep apnoea and the risk of type 2 diabetes: a meta-analysis of prospective cohort studies[J].Respirology,2013,18(1):140-146.DOI: 10.1111/j.1440-1843.2012.02267.x.
[3] Iiyori N, Alonso LC, Li J,et al. Intermittent hypoxia causes insulin resistance in lean mice independent of autonomic activity[J].Am J Respir Crit Care Med,2007,175(8):851-857.
[4] 陆甘, 娄青林, 张玉林, 等. 阻塞性睡眠呼吸暂停低通气综合征与胰岛素抵抗的临床研究[J]. 中华结核和呼吸杂志, 2006(04):273-274.DOI:10.3760/j.issn.1001-0939.2006.04.018.
[5] Pessin JE, Saltiel AR. Signaling pathways in insulin action: molecular targets of insulin resistance[J].J Clin Invest,2000,106(2):165-169.
[6] Takenaka N, Izawa R, Wu J,et al. A critical role of the small GTPase Rac1 in Akt2-mediated GLUT4 translocation in mouse skeletal muscle[J].FEBS J,2014,281(5):1493-1504.DOI:10.1111/febs.12719.
[7] Reichmuth KJ, Austin D, Skatrud JB,et al. Association of sleep apnea and type Ⅱ diabetes: a population-based study[J].Am J Respir Crit Care Med,2005,172(12):1590-1595.
[8] Chen L, Cao ZL, Han F,et al. Chronic intermittent hypoxia from pedo-stage decreases glucose transporter 4 expression in adipose tissue and causes insulin resistance[J].Chin Med J (Engl),2010,123(4):463-470.
[9] Polak J, Shimoda LA, Drager LF,et al. Intermittent hypoxia impairs glucose homeostasis in C57BL6/J mice: partial improvement with cessation of the exposure[J].Sleep,2013,36(10):1483-1490; 1490A-1490B.DOI: 10.5665/sleep.3040.
[10] Yokoe T, Alonso LC, Romano LC, et al. Intermittent hypoxia reverses the diurnal glucose rhythm and causes pancreatic beta-cell replication in mice[J].J Physiol,2008,586(3):899-911.
[11] Xu J, Long YS, Gozal D,et al. Beta-cell death and proliferation after intermittent hypoxia: role of oxidative stress[J].Free Radic Biol Med,2009,46(6):783-790.DOI:10.1016/j.freeradbiomed.2008.11.026.
[12] Wang N, Khan SA, Prabhakar NR,et al. Impairment of pancreatic β-cell function by chronic intermittent hypoxia[J].Exp Physiol,2013,98(9):1376-1385.DOI:10.1113/expphysiol.2013.072454.
[13] Zisman A, Peroni OD, Abel ED,et al. Targeted disruption of the glucose transporter 4 selectively in muscle causes insulin resistance and glucose intolerance[J].Nat Med,2000,6(8):924-928.
[14] Carreras A, Kayali F, Zhang J,et al. Metabolic effects of intermittent hypoxia in mice: steady versus high-frequency applied hypoxia daily during the rest period[J].Am J Physiol Regul Integr Comp Physiol,2012,303(7):R700-R709.DOI:10.1152/ajpregu.00258.2012.
[15] Wang Q, Sun X, Li X,et al. Resveratrol attenuates intermittent hypoxia-induced insulin resistance in rats: involvement of Sirtuin 1 and the phosphatidylinositol-4,5-bisphosphate 3-kinase/AKT pathway[J].Mol Med Rep,2015,11(1):151-158. DOI: 10.3892/mmr.2014.2762.
EffectsofintermittenthypoxiaoninsulinresistanceandexpressionofGLUT4andAkt2inskeletalmusclecellsofrats
TangWeina*,RenShou′an.
*ShanxiMedicalUniversity,Taiyuan030001,China
Correspondingauthor:RenShou′an,Email:renshouan@163.com
ObjectiveTo investigate the effects of different time of exposure to intermittent hypoxia on the expression of glucose transporter (GLUT) 4 and protein kinase B(PKB/Akt)2, and their roles in insulin resistance induced by intermittent hypoxia.MethodsForty male Sprauge-Dawley rats were divided into 5 groups by random number table method:normal control group(NC group),group of intermittent hypoxia for 2 weeks (IH2 group),group of intermittent hypoxia for 4 weeks (IH4 group),group of intermittent hypoxia for 6 weeks (IH6 group) and group of intermittent hypoxia for 8 weeks(IH8 group), with 8 rats in each group. Rats in IH2 group, IH4 group, IH6 group and IH8 group were exposed to intermittent hypoxia each day, from 9 a.m. to 5 p.m.,while rats in NC group were exposed to room air. Fasting blood glucose and fasting blood insulin were measured,and homeostatic model assessment of insulin resistance index(HOMA-IR)was calculated. The expression of GLUT4 and Akt2 protein in muscles of rat were analyzed by immunohistochemistry and quantified by the average gray value. The correlation between GLUT4 and Akt2 was analyzed.ResultsCompared with NC group, fasting blood glucose,HOMA-IR, GLUT4 and Akt2 in IH2, IH4, IH6, IH8 group were higher, and were increased with the exposure time of intermittent hypoxia (F=87.67-288.63, allP<0.05). Compared with NC group, fasting insulin was elevated in IH2, IH4, IH6 and IH8 group, and was increased along with the duration of intermittent hypoxia and then decreased in IH8 group(F=86.04,P<0.01).Pearsoncorrelation analysis showed that the expression of GLUT4 was positively correlated with Akt2(r=0.895,P<0.05) .ConclusionThe degree of insulin resistance increases and the expression of GLUT4 and Akt2 decrease with duration of intermittent hypoxia.GLUT4 and Akt2 play synergistic effects in insulin resistance induced by intermittent hypoxia.
Intermittent hypoxia; Glucose transporter 4; Protein kinase B2; Insulin resistance
山西省自然科学基金资助项目(2013011048-4)
10.3760/cma.j.issn.1673-4157.2016.02.009
030001 太原,山西医科大学(汤玮娜);030001 太原,山西医科大学第一医院呼吸科(任寿安)
任寿安,Email:renshouan@163.com
FundprogramNatural Science Foundation of Shanxi Province of China (2013011048-4)
2016-07-31)
