维生素D缺乏与糖尿病周围神经病变的相关性研究
2016-11-24范乐平宋轶萱邱慧娜朱杰林静娜
范乐平 宋轶萱 邱慧娜 朱杰 林静娜
·论著·
维生素D缺乏与糖尿病周围神经病变的相关性研究
范乐平 宋轶萱 邱慧娜 朱杰 林静娜
目的研究2型糖尿病患者维生素D缺乏与糖尿病周围神经病变(DPN)的相关性。方法选取2型糖尿病患者200例和正常对照者100名,其中2型糖尿病患者分为DPN组(109例)和无糖尿病周围神经病变(NDPN)组(91例)。通过ELISA法测定25(OH)D3水平,常规测定肝、肾功能,HbA1c,血脂,血钙、磷,β2微球蛋白,尿微量白蛋白等指标。25(OH)D3与各指标之间进行相关性分析。结果与正常对照组相比,NDPN组和DPN组25(OH)D3水平降低,DPN组降低更加明显(F=202.265,P<0.01),且DPN组维生素D缺乏患者比例(76.1%)明显高于NDPN组(47.3%)(χ2=17.763,P<0.01)。维生素D水平与DPN、病程、年龄、性别、空腹血糖、HbA1c、总胆固醇、低密度脂蛋白-胆固醇、24 h尿微量白蛋白、β2微球蛋白均呈显著负相关(r=-0.315~-0.144,P均<0.05),而与血钙呈正相关(r=0.193,P=0.006)。二元Logistic回归分析显示,维生素D缺乏是DPN的独立危险因素(OR=3.564,95%CI:1.950~6.511,P<0.001)。结论维生素D缺乏是DPN的独立危险因子,并可能在2型糖尿病及DPN的发生、发展中发挥作用。
2型糖尿病;维生素D缺乏;周围神经病变
糖尿病周围神经病变(DPN)是糖尿病主要的慢性并发症之一,可严重降低糖尿病患者的生存质量,也是糖尿病晚期致残、致死的主要原因之一,在2型糖尿病(T2DM)患者中的患病率高达50%以上[1]。DPN的发病机制尚未完全明了,近年来有研究显示DPN与维生素D缺乏有关[2]。本研究旨在调查T2DM伴/不伴DPN患者中维生素D缺乏情况,研究维生素D缺乏与DPN的关系。
1 对象与方法
1.1 研究对象
1.1.1 分组 所采集病例均来自于2014年12月至2015年2月在天津市人民医院内分泌科住院的T2DM患者,共200例,其中男性109例,女性91例,平均年龄(59.71±10.72)岁,平均病程(79.61±86.50)个月。根据其是否存在DPN分为两组: T2DM伴DPN组(DPN组),共109例,其中男性56例,女性53例,平均年龄(62.60±10.65)岁;T2DM不伴DPN组(NDPN组),共91例,其中男性53名,女性38名,平均年龄(56.24±9.79)岁。选择同期本院查体中心健康体检者100名作为正常对照组,其中男性56名,女性44名,平均年龄(57.54±5.73)岁。
1.1.2 纳入及排除标准 所有T2DM患者均符合1999年世界卫生组织糖尿病专家委员会提出的糖尿病诊断标准,DPN患者均符合2013年中国T2DM防治指南提出的DPN诊断标准,即有明确的糖尿病病史,在诊断糖尿病时或之后出现与DPN表现相符的临床症状和体征,有临床症状(疼痛、麻木、感觉异常等)者,5项检查(踝反射、针刺痛觉、震动觉、压力觉、温度觉)中任1项异常;无临床症状者任2项异常则临床诊断为DPN。排除颈、腰椎疾病,脑梗死,格林-巴利综合征,严重动、静脉血管性病变(静脉栓塞、淋巴管炎),药物尤其是化学治疗药物引起的神经毒性作用,严重的肝、肾功能不全,炎性反应,自身免疫性疾病或骨质疏松症,甲状旁腺功能异常,恶性肿瘤,近两个月每日补充维生素D治疗者。本研究经医院伦理委员会批准,所有患者均签署知情同意书。
1.2 研究方法
1.2.1 临床资料收集 对所有研究对象进行详细的病史采集、体格检查,收集性别、年龄、病程、身高、体重、体重指数、10 g尼龙丝压力觉和128 Hz音叉震动觉等资料(正常对照组省去)。
1.2.2 检测指标 采用ARCHITECT c16000全自动生化分析仪测定空腹血糖、总胆固醇、甘油三酯、低密度脂蛋白-胆固醇(LDL-C)、谷丙转氨酶、谷草转氨酶、血尿素氮、血尿酸、血肌酐、血钙、血磷、24 h尿微量白蛋白(24 hUMA)及β2微球蛋白(β2MG)。采用高压液相法测定HbA1c(HA-8180型全自动糖化血红蛋白分析仪)。
1.2.3 维生素D测定 清晨空腹取肘正中静脉血5 ml,EDTA抗凝至冰壶中,于4 h内分离血浆,3 000 r/min(r=13 cm)离心8 min,取上层血清置于-80℃医用冰箱内保存,用于维生素D测定。采用ELISA法测定25(OH)D3(奥地利TECAN SUNRISE酶标仪)。所用25(OH)D3试剂盒(英国艾狄斯,产品标准编号:YZB/UK4271-2011)的生物参考利用区间为47.7~144.0 nmol/L(19.08~57.60 μg/L)。目前多推荐血清25(OH)D3的正常水平是30~60 μg/L (75~150 nmol/L);<20 μg/L (50 nmol/L)定义为维生素D缺乏;20~30 μg/L (50~75 nmol/L)定义为维生素D相对不足[3]。
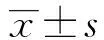
2 结果
2.1 3组患者临床资料比较 各组性别、尿素氮、肌酐、尿酸、谷丙转氨酶、谷草转氨酶间比较无统计学意义(P均>0.05)。NDPN组与正常对照组相比,体重指数、空腹血糖、HbA1c、总胆固醇、甘油三酯、LDL-C、β2MG水平均明显升高, 钙、磷水平明显降低(P均<0.05)。DPN组年龄、病程、β2MG、24 hUMA水平均高于NDPN组(P均<0.01),而在体重指数、空腹血糖、HbA1c、总胆固醇、甘油三酯、LDL-C、钙、磷水平等差异均无统计学意义(P均>0.05),见表1。正常对照组25(OH)D3水平[(72.48±10.35)nmol/L]正常,NDPN组25(OH)D3水平[(50.08±12.46) nmol/L]显著降低,而DPN组25(OH)D3水平[(42.53±10.39)nmol/L]进一步降低(F=202.265,P<0.01),见图1。DPN组维生素D缺乏患者比例明显高于NDPN组(χ2=17.763,P<0.001),见表2。
2.2 维生素D与各指标的相关性分析Pearson相关分析结果表明25(OH)D3与DPN、病程、年龄、总胆固醇、LDL-C、24 hUMA、β2MG及HbA1c 均显著相关(P均<0.05),而与体重指数、尿素氮、肌酐、尿酸、谷丙转氨酶、谷草转氨酶、甘油三酯无明显相关性(P均>0.05),见表3。
2.3 维生素D缺乏与DPN的关系 二元Logistic回归分析结果表明,维生素D缺乏与糖尿病病程、年龄、24 hUMA、β2MG均是DPN的危险因素且可作为DPN的独立危险因子。而性别、HbA1c、总胆固醇、LDL-C、钙、空腹血糖和维生素D相关,可以作为DPN的危险因素,但和DPN之间没有明显的线性关系,见表4。
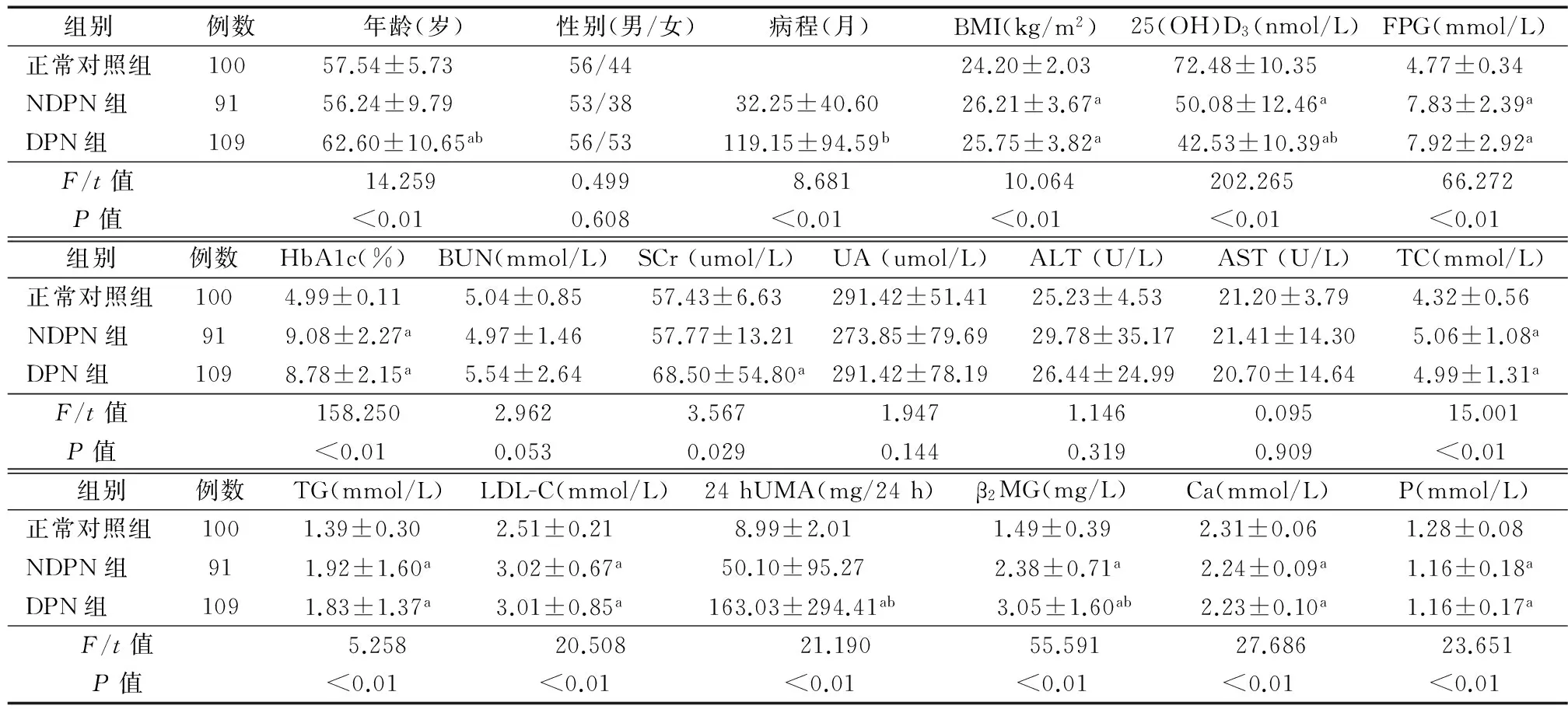
表1 3组患者临床资料比较
注:NDPN组:2型糖尿病不伴周围神经病变组;DPN组:2型糖尿病伴周围神经病变组;BMI:体重指数;FPG:空腹血糖;BUN:尿素氮;SCr:血肌酐;UA:尿酸;ALT:谷丙转氨酶;AST:谷草转氨酶;TC:总胆固醇;TG:甘油三酯;LDL-C:低密度脂蛋白-胆固醇;24 hUMA:24 h尿微量白蛋白;β2MG:β2微球蛋白;Ca:钙;P:磷;与正常对照组相比,aP<0.05;与NDPN组相比,bP<0.05
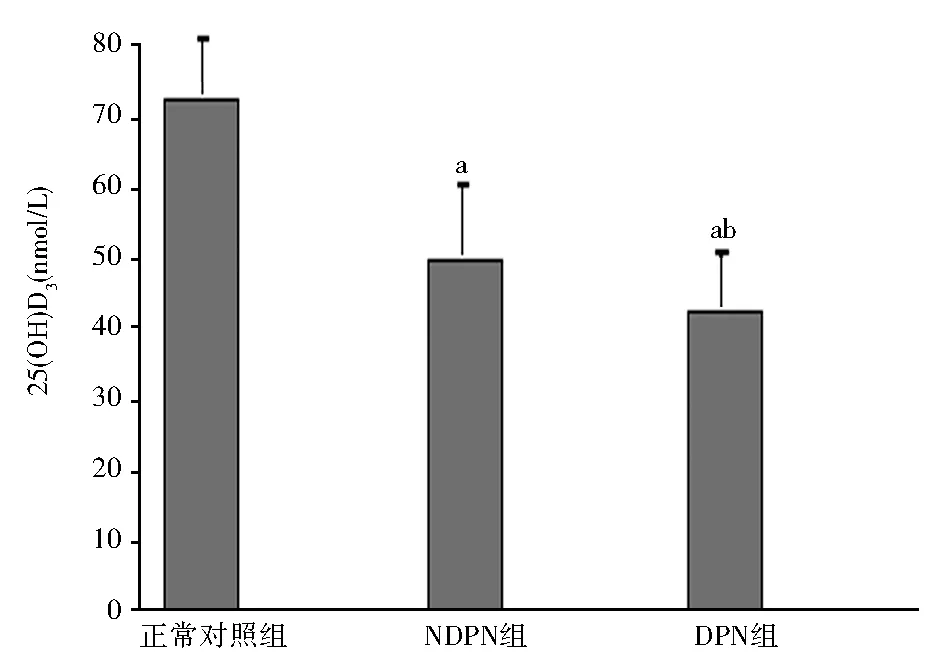
注:NDPN组:2型糖尿病不伴周围神经病变组;DPN组:2型糖尿病伴周围神经病变组;与正常对照组相比,aP<0.01;与NDPN组相比,bP<0.01图1 3组患者 25(OH)D3水平比较
注:NDPN组:2型糖尿病不伴周围神经病变组;DPN组:2型糖尿病伴周围神经病变组
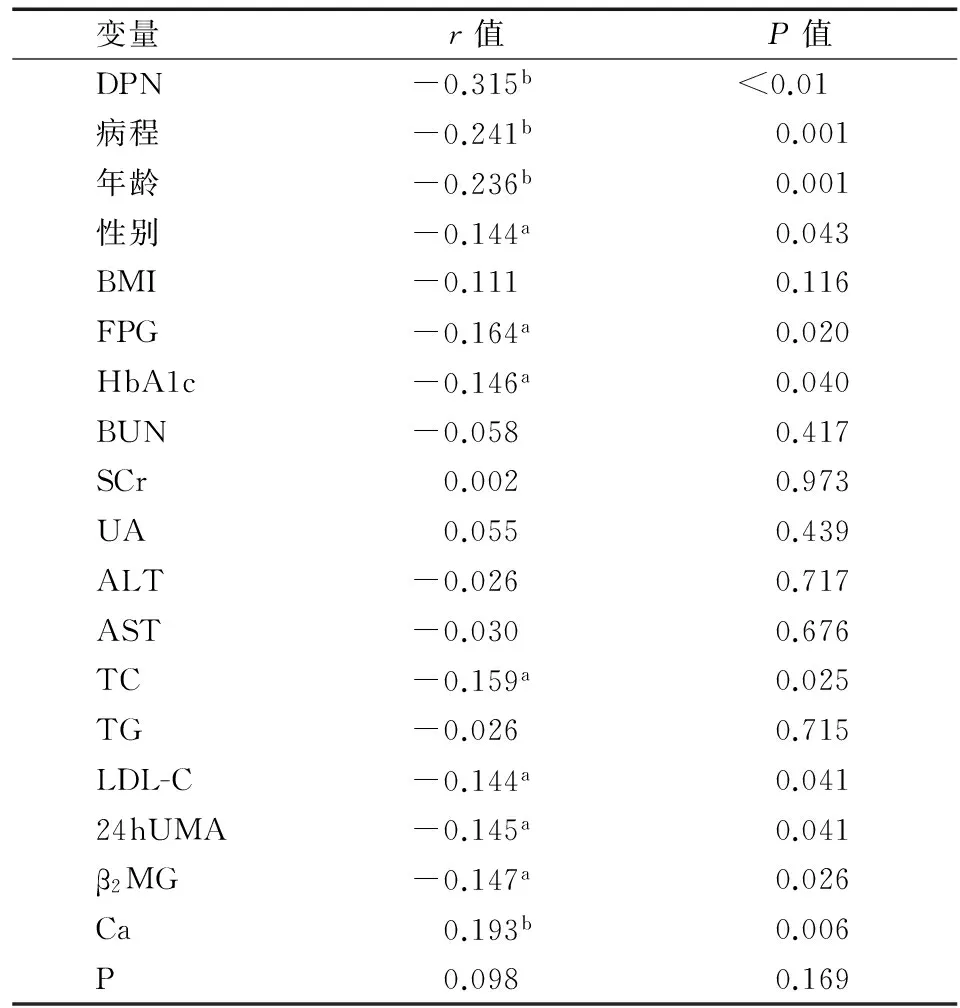
表3 25(OH)D3与各指标相关性分析
注:DPN:糖尿病周围神经病变;BMI:体重指数;FPG:空腹血糖;BUN:尿素氮;SCr:血肌酐;UA:尿酸;ALT:谷丙转氨酶;AST:谷草转氨酶;TC:总胆固醇;TG:甘油三酯;LDL-C:低密度脂蛋白-胆固醇;24 hUMA:24 h尿微量白蛋白;β2MG:β2微球蛋白;Ca:钙;P:磷;a表示25(OH)D3与比较因素在0.05水平(双侧)上显著相关;b表示25(OH)D3与比较因素在0.01水平(双侧)上显著相关

表4 二元Logistic回归分析DPN相关危险因素
注:FPG:空腹血糖;TC:总胆固醇;LDL-C:低密度脂蛋白-胆固醇;24 hUMA:24 h尿微量白蛋白;β2MG:β2微球蛋白;DPN:糖尿病周围神经病变
3 讨论
维生素D除了作为经典的钙、磷代谢调节剂参与骨代谢相关疾病外,其缺乏还与许多其他疾病如肿瘤、感染性疾病、多发性硬化、高血压、糖尿病及其并发症有关[4-5]。Skalli等[2]研究纳入111例T2DM患者,其中DPN组25(OH)D3水平明显低于NDPN组(P<0.001)。DPN组维生素D缺乏者为95%,而NDPN组为79.5%(P<0.05)。Shehab等[6]研究210例T2DM患者,其中 DPN患者中维生素D缺乏比例为81.5%,而NDPN患者中维生素D缺乏比例为60.4%(P=0.005),且DPN组维生素D水平明显低于NDPN组(P=0.001),二元Logistic回归分析表明T2DM中维生素D缺乏与DPN显著相关,且维生素D缺乏可作为DPN发病的独立危险因子。Ahmadieh等[7]研究显示,T2DM患者中DPN组平均25(OH)D3水平低于NDPN组,25(OH)D3水平<20 μg/L组DPN发病率明显高于25(OH)D3水平≥20 μg/L组人群,且25(OH)D3与DPN具有显著相关性,可作为DPN的预测因子。
Palomer 等[8]研究表明,维生素D是刺激胰岛β细胞分泌胰岛素及维持糖耐量正常的必需物质。活化的维生素D可激活胰岛β细胞上的L型钙离子通道,促进胰岛素的释放和胰岛素受体底物的酪氨酸磷酸化,启动胰岛素信号转导。维生素D缺乏使钙离子通道关闭,或使其胰岛素受体底物磷酸化受阻,从而影响胰岛素信号转导,直接减少胰岛素的合成和分泌,损害胰岛β细胞功能,导致糖尿病的发生、发展[9]。肌肉及胰岛β细胞上可以表达维生素D受体,胰岛细胞本身具有一定分泌1α-羟化酶的能力,可激活1,25(OH)2D3,与维生素D受体结合,直接促进胰岛素分泌[10]。本研究结果显示,与正常对照组相比,T2DM组(包括DPN组及NDPN组)25(OH)D3水平明显降低,且25(OH)D3与糖尿病病程、空腹血糖、HbA1c、体重指数、总胆固醇、LDL-C等指标显著相关,提示维生素D缺乏可能与T2DM及其易感因素肥胖、高脂血症等均有关。
本研究结果显示维生素D缺乏与总胆固醇及LDL-C呈显著负相关。而总胆固醇及LDL-C是动脉粥样硬化发生、发展的重要因素。已有研究发现,维生素D与其受体结合,通过免疫调节作用可抑制血管形成和血管平滑肌细胞增殖,减少动脉钙化和动脉粥样硬化的发生[11-12]。维生素D缺乏可使体内急性反应蛋白增加,而这种急性反应蛋白可促进血管内慢性炎性反应的发展[13]。血管内炎性反应的增加和氧化应激可促进晚期糖基化终末产物生成,加速动脉粥样硬化发展,而动脉粥样硬化可进一步造成神经营养血管管壁僵硬、管腔狭窄,从而造成神经缺血、缺氧,促进DPN发展[14]。
本研究结果还显示24 hUMA、β2MG与维生素D水平呈显著负相关,且可作为DPN的独立危险因子。24 hUMA、β2MG可作为早期糖尿病肾病(DN)的诊断指标之一,已有研究表明DN患者维生素D缺乏和不足的发生率明显高于非DN者,维生素D缺乏和不足与DN的发生相关[15]。而DN与DPN同属糖尿病微血管并发症且常合并出现。活性维生素D是肾素-血管紧张素-醛固酮系统(RAAS)的负性调节剂。维生素D缺乏时可激活RAAS,而血管紧张素Ⅱ的增加是引起DN的关键环节,同时RAAS激活引起的血压升高也促进了动脉粥样硬化的发展。
25(OH)D3能够作用于神经系统的各种细胞,调节神经营养因子的合成,并通过调节神经元细胞内钙稳态,发挥神经保护作用,避免神经退行性变。维生素D可通过对钙结合蛋白及钙缓冲蛋白的调节,实现对神经系统发育及损伤的调控。动物实验表明,维生素D可调节神经营养因子和钙离子的平衡,而二者均是维持神经功能正常的重要因素。神经营养因子,尤其是神经生长因子和钙离子的降低可使神经细胞在高血糖等毒素的刺激下加速神经病变发展[16]。因此维生素D缺乏可导致神经系统发育障碍、神经损伤及神经退行性病变。本研究结果显示,DPN组与NDPN组及正常对照组组相比,25(OH)D3水平明显降低(P<0.01)。维生素D缺乏与DPN显著相关,是DPN的独立危险因子。
综上所述,维生素D缺乏参与了T2DM及DPN的发生、发展,可作为DPN的独立危险因素。目前已有证据表明,维生素D制剂可减轻DPN患者肢端麻木及疼痛症状,改善患者生活质量且耐受性良好,从而为DPN的治疗提供新的方法及理论依据[17]。但DPN发病机制复杂,维生素D治疗的利弊仍需深入探讨。
[1] Deshpande AD, Harris-Hayes M, Schootman M. Epidemiology of diabetes and diabetes-related complications[J].Phys Ther,2008,88(11):1254-1264.DOI:10.2522/ptj.20080020.
[2] Skalli S, Muller M, Pradines S,et al. Vitamin D deficiency and peripheral diabetic neuropathy[J].Eur J Intern Med, 2012,23(2):e67-e68. DOI: 10.1016/j.ejim.2011.11.008.
[3] Adams JS, Hewison M. Update in vitamin D[J]. J Clin Endocr Metab, 2010, 95(2): 471-478. DOI:10.1210/jc.2009-1773.
[4] Hewison M. Vitamin D and the intracrinology of innate immunity[J]. Mol Cell Endocrinol, 2010, 321(2): 103-111. DOI: 10.1016/j.mce.2010.02.013.
[5] Makariou S, Liberopoulos EN, Elisaf M, et al. Novel roles of vitamin D in disease: what is new in 2011[J]. Eur J Intern Med, 2011, 22(4): 355-362.DOI:10.1016/j.ejim.2011.04.012.
[6] Shehab D, Al-Jarallah K, Mojiminiyi O, et al. Does vitamin D deficiency play a role in peripheral neuropathy in type 2 diabetes? [J].Diabetic Med,2012,29(1):43-49.DOI:10.1111/j.1464-5491.2011.03510.x.
[7] Ahmadieh H, Azar ST, Lakkis N, et al. Hypovitaminosis D in patients with type 2 diabetes mellitus: a relation to disease control and complications[J].ISRN Endocrinol,2013,2013. DOI: 10.1155/2013/641098.
[8] Palomer X, González-Clemente J, Blanco-Vaca F, et al. Role of vitamin D in the pathogenesis of type 2 diabetes mellitus[J]. Diabetes Obes Metab, 2008, 10(3): 185-197.DOI:10.1111/j.1463-1326.2007.00710.x.
[9] Moreira TS, Hamadeh MJ. The role of vitamin D deficiency in the pathogenesis of type 2 diabetes mellitus[J]. e-SPEN, Euro e-J Clin Nutr Metab, 2010, 5(4): e155-e165. DOI:10.1016/j.eclnm.2010.05.001.
[10] Choi M, Ozeki J, Hashizume M, et al. Vitamin D receptor activation induces peptide YY transcription in pancreatic islets[J]. Endocrinology, 2012, 153(11): 5188-5199. DOI:10.1210/en.2012-1396.
[11] Mathieu C, Adorini L.The coming of age of 1,25-dihydroxyvitamin D3analogs as immunomodulalory agents[J].Trends Mol Med,2002,8(4):174-179.DOI:10.1016/S1471-4914(02)02294-3.
[12] Li AC,Glass CK. The macrophage foam cell as a large for therapeutic intervention[J].Nal Med, 2002, 8(11):1235-1242. DOI:10.1038/nm1102-1235.
[13] McCarty MF. Secondary hyperparathyroidism promotes the acute phase response-a rationale for supplemental vitamin D in prevention of vascular events in the elderly[J]. Med Hypotheses, 2005, 64(5): 1022-1026.DOI:10.1016/j.mehy.2004.03.041.
[14] Boulton AJ, Malik RA.Diabetic neuropathy[J]. Med Clin North Am, 1998,82(4):909-929.DOI:10.1016/S0025-7125(05)70029-8.
[15] Riaz S, Malcangio M, Miller M, et al. A vitamin D3derivative (CB1093) induces nerve growth factor and prevents neurotrophic deficits in streptozotocin-diabetic rats[J]. Diabetologia, 1999, 42: 1308-1313.DOI:10.1007/s001250051443.
[16] Gursoy G, Cimbek A, Kirnap NG, et al. Relation of serum 25 hydroxy vitamin D3levels with nephropathy in type 2 diabetic patients[J].Türkiye Klinikleri Endokrinoloji Dergisi, 2013, 8(2): 47-51. DOI:10.2337/dc14-0180.
[17] Trivedi JR, Silvestri NJ, Wolfe GI. Treatment of painful peripheral neuropathy[J].Neurol Clin,2013,31(2): 377-403.DOI:10.1016/j.ncl.2013.01.003.
TherelationshipbetweenvitaminDdeficiencyanddiabeticperipheralneuropathy
FanLeping,SongYixuan,QiuHuina,ZhuJie,LinJingna.
DepartmentofEndocrinology,TianjinPeople′sHospital,Tianjin300121,China
Correspondingauthor:LinJingna,Email:13207628978@163.com
ObjectiveTo study the association of vitamin D deficiency with diabetic peripheral neuropathy (DPN) in type 2 diabetic patients.MethodsA total of 200 type 2 diabetic patients and 100 healthy normal people were included in this study. Patients with type 2 diabetes were divided into DPN group(n=109)and non-DPN group(NDPN group,n=91). ELISA was used to measure the level of 25(OH) D3, and conventional methods were used to determine the functions of liver and renal, glycosylated hemoglobin, blood lipid, serum calcium, phosphorus, beta 2 microglobulin, urinary microalbumin and other indicators. Correlation analysis between 25(OH)3and other indicators were performed.ResultsCompared with normal control group, levels of 25(OH)D3in NDPN group and DPN group were lower, especially in DPN group (F=202.265,P<0.01). Moreover, the percentage of vitamin D deficiency in DPN group(76.1%) was much higher than that of NDPN group (47.3%,χ2=17.763,P<0.001). Level of vuitamin D was negatively related to DPN, diabetic duration, age, gender, fasting blood glucose, HbA1c, total cholesterol, low density lipoprotein cholesterol, 24 h urinary microalbumin, beta 2 microglobulin(r=-0.315 to-0.144, allP<0.05), and positively related to blood calcium (r=0.193,P=0.006). BinaryLogisticregression analysis showed that vitamin D deficiency was an independent risk factor for DPN (OR=3.564, 95%CI: 1.950-6.511,P<0.001).ConclusionVitamin D deficiency is an independent risk factor for DPN, and may play a role in the occurrence and development of type 2 diabetes and DPN.
Type 2 diabetes mellitus;Vitamin D deficiency; Peripheral neuropathy
天津市卫生局科技基金项目(2015KZ058)
10.3760/cma.j.issn.1673-4157.2016.02.006
300121 天津市人民医院内分泌科
林静娜,Email:13207628978@163.com
FundprogramScience and Technology Fund Project of Tianjin Municipal Health Bureau(2015KZ058)
2016-07-06)
