Sestrin1、Sestrin2在子宫内膜异位症组织中的表达及意义
2016-11-23王文芳邱晓红常州市第四人民医院妇产科江苏常州3000哈尔滨医科大学附属第二医院黑龙江哈尔滨5008
王文芳,邱晓红(.常州市第四人民医院妇产科,江苏 常州 3000;.哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 5008)
Sestrin1、Sestrin2在子宫内膜异位症组织中的表达及意义
王文芳1,邱晓红2
(1.常州市第四人民医院妇产科,江苏 常州 213000;
2.哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 150081)
目的 探索应激诱导蛋白家族中Sestrin1、Sestrin2在子宫内膜异位症(EMS)发生、发展过程中的作用,从“类肿瘤”的特点出发研究EMS的发病机制,为EMS的治疗提供新的思路及方向。方法 选取2013年4月至2014年4月就诊于哈尔滨医科大学附属第二医院妇科经术后病理证实为EMS患者的在位内膜、异位内膜35例(实验组)及同期非EMS并经病理证实无内膜疾病患者的子宫内膜30例(对照组),应用免疫组化SP法检测实验组在位内膜、异位内膜及对照组子宫内膜Sestrin1、Sestrin2表达情况。使用SPSS13.0 统计软件进行统计学分析。结果 通过免疫组化SP法证实Sestrin1、Sestrin2在实验组在位内膜、异位内膜及对照组子宫内膜中有表达,阳性表达率为25.7%、62.9%、96.7%,表明Sestrin1在EMS异位内膜的表达低于另外两组内膜,且两两比较差异有统计学意义(P<0.05);Sestrin2在实验组异位内膜、在位内膜及对照组子宫内膜阳性表达率为20%、68.6%、96.7%,表明表达在EMS异位内膜的Sestrin2低于另外两组内膜,且两两比较差异有统计学意义(P<0.05)。结论 Sestrin1、Sestrin2通过对细胞生长的影响实现了EMS形成的基础,可能为EMS的早期诊断、靶向治疗、治疗效果及复发风险的评估提供新的理论依据。
Sestrin1;Sestrin2;子宫内膜异位症;免疫组化SP法
【CLC】R711.71 【documentcode】A 【Article number】ISSN.2095-8803.2016.09.003.02
子宫内膜异位症(简称内异症,endometriosis,EMs)是目前较为常见的妇科疾病,随着其发病率的逐年升高及年轻化[1],对于其发病机制的研究仍然是当今医学界要解决的热点问题。众所周知内异症虽为良性疾病,但却具有恶性肿瘤细胞异常增殖、侵蚀及转移等生物学特性,从肿瘤发病机制的角度来探索内异症,可能会对其更深入的研究带来新的突破。
Sestrin1、Sestrin2是1994年Buckbinder[2]及2002年Budanov[3]等先后发现,受P53调控的基因,随后和另一种被叉头盒0转录因子激活的sesn3[4]共同组成了sesns应激诱导蛋白家族。研究资料[5]发现sesns普遍存在于哺乳动物的多种成熟组织中,与氧化应激、衰老、代谢性疾病及肿瘤疾病的发生有关,目前国内外已有很多研究报道了其与恶性肿瘤性疾病关系[6],但在内异症方面的研究报道少见。通过本实验探索Sestrin1、Sestrin2通过对细胞生长的影响可能实现了EMs形成的基础。
1 资料与方法
1.1 一般资料
收集2013年4月至2014年4月就诊于哈尔滨医科大学附属第二医院妇科术前诊断为EMs,且经术后病理证实确诊的患者,在位内膜、异位内膜35例(实验组),同期收集因妇科良性肿瘤行全子宫或次全子宫切除术的子宫内膜且经术后病理证实无内膜疾病的30例(对照组)。在选择研究对象过程中实验组及对照组年龄差距无统计学意义(P>0.05),在接受治疗前6个月内未服用过激素类药物、无妊娠史及哺乳史,未放置宫内节育器,都属于绝经前妇女,都有生育史。
1.2 方法
1.2.1 标本的采集 术中取EMs患者异位病灶组织(大小约1cm×1cm)为实验组异位内膜,并同时刮取子宫内膜组织为实验组在位内膜;术中刮取因妇科良性肿瘤行全子宫或次全子宫切除术的子宫内膜为对照组子宫内膜。所有标本取材均在手术切除后立即进行并放入冻存管中置入液氮保存并转运到实验室-80℃冰箱保存备用。
1.2.2 免疫组化方法(SP法) 将标本组织自-80℃冰箱取出后放入-20℃冰箱内3-4h后,再将其置入已经准备好的4℃的4%的多聚甲醛磷酸盐缓冲液中固定并过夜。将固定好的标本进行脱水、透明、包埋、切片、贴片及拷片后,进行H&E染色,标本满意后,进行SP法免疫组化,抗体分别选用的是北京博奥森生物技术有限公司提供的兔抗人Sestrin1多克隆抗体(bs-8325R)及兔抗人Sestrin2多克隆抗体(bs-8326R),使用浓度分别为:1:100、1:300。结果的判定:Sestrin1、Sestrin2主要位于腺细胞的细胞核中,阳性主要表现为细胞核出现棕黄色颗粒,判定标准:(1)染色强度评分:0分:不着色,1分:黄色,2分:棕黄色,3分:黄褐色;(2)染色面积评分标准:0分:无细胞染色,1分:<25%,2分:26%-50%,3分:>50%。免疫组化染色评分=染色面积评分×染色强度评分:0~1分为阴性(-);2~3分为弱阳性(+);4~5分为中度阳性(++);大于5分为强阳性(+++)。
1.3 统计学方法
所有实验结果经Excel,应用SPSS 13.0统计学软件对数据进行分析,以百分数(%)表示,采用x2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 Sestrin1在实验组及对照组组织表达情况
Sestrin1主要表达于腺体及间质细胞的细胞核中,根据免疫组化结果判定标准,Sestrin1在内异症异位内膜表达明显低于对照组子宫内膜,结果如图 1(SP×100),表 1所示。
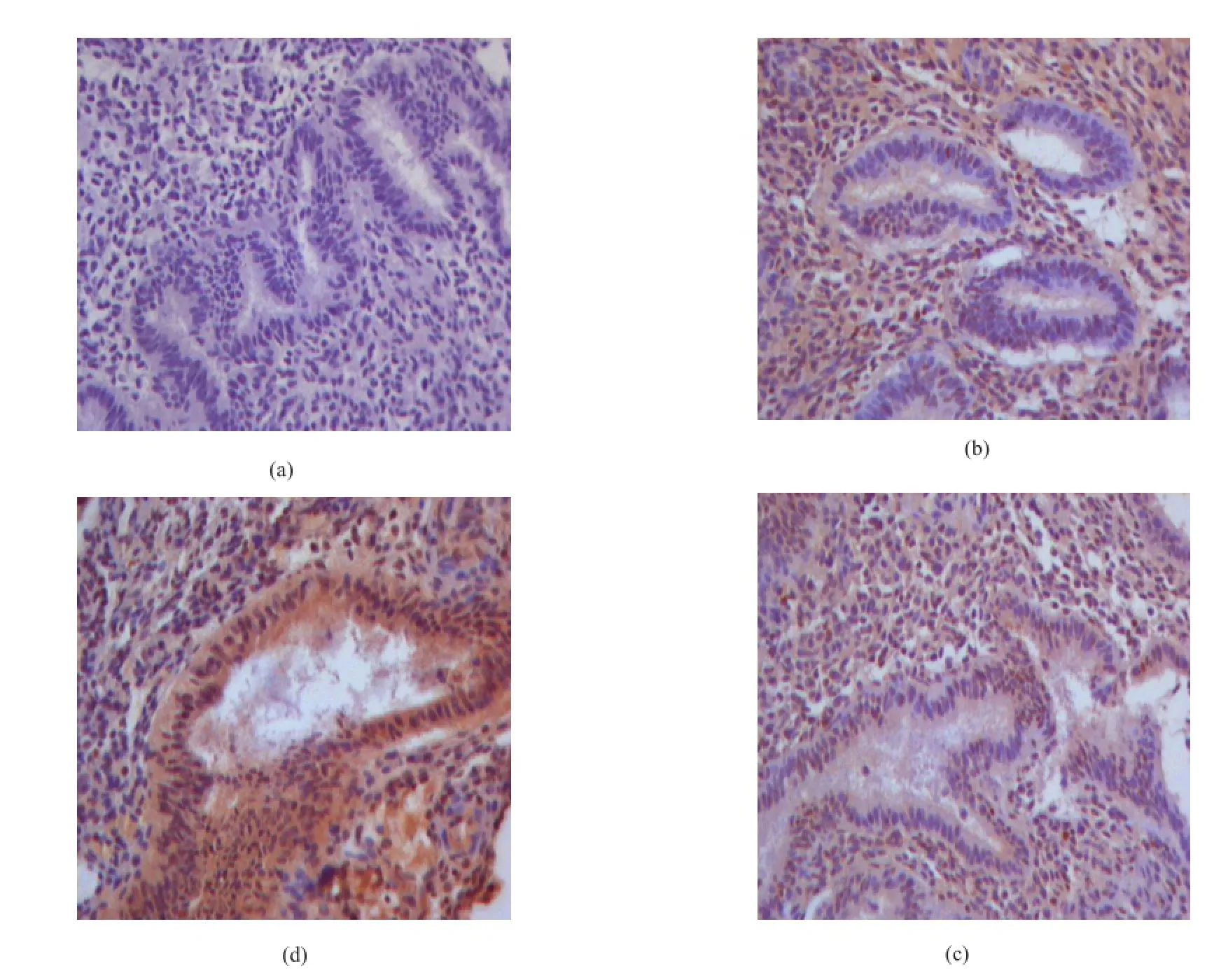
图1 Sestrin1在实验组异位内膜、在位内膜及对照组子宫内膜表达情况

表1 Sestrin1在各组织中表达情况
2.2 Sestrin2在实验组及对照组组织表达情况
Sestrin2主要也同样表达于腺体及间质细胞的细胞核中,根据免疫组化结果判定标准,Sestrin2在内异症异位内膜表达明显低于对照组子宫内膜,结果如图2(SP×100),表2所示。
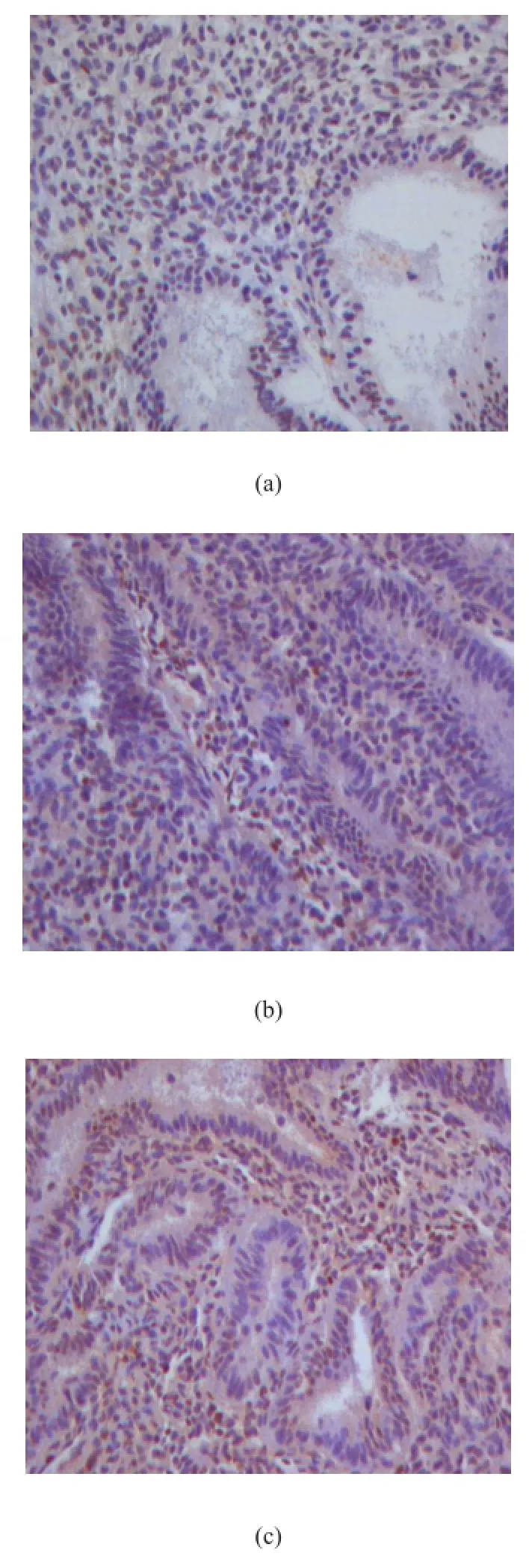

图2 Sestrin2在实验组异位内膜、在位内膜及对照组子宫内膜表达情况.

表2 Sestrin2在各组织中表达情况
3 讨 论
众所周知,内异症虽为良性疾病,但却具有与恶性肿瘤细胞异常增殖、种植及转移的生物学行为,可以推断其同肿瘤形成有相似的基础,即细胞的异常生长、增殖。P53、mTOR及细胞自噬在调节细胞的生长、增殖方面扮演重要角色,实验资料证实三者在内异症的发生、发展过程中起着重要作用[7-9],但具体的作用机制目前仍在不断研究,Sestrin1、Sestrin2是最近发现的受P53调控的应激诱导蛋白家族成员,Sestrin1作为mTOR的抑制剂、Sestrin2作为细胞自噬的正调节蛋白在维持细胞的生长及死亡的平衡中起着一定的作用,本实验探索Sestrin1、Sestrin2的表达下调参与内异症形成。
3.1 Sestrin 1的表达与内异症
Sestrin 1/PA26表达于细胞核内,P53应激诱导蛋白,定位于染色体的6q21,广泛存在于哺乳动物的成熟组织中,研究发现[10]Sestrin 1在调节细胞生长方面的作用是通过作为mTOR的抑制剂来实现的。有研究资料证实大部分恶性肿瘤组织中存在mTOR的高表达[11],而其抑制剂在治疗恶性肿瘤的研究中也取得了明显的效果[12]。2011年Leconte[3]等使用mTOR抑制剂抑制了一个深部浸润的内异症小鼠模型的子宫内膜异位细胞的增殖。
在本实验中,Sestrin1在实验组异位内膜、在位内膜及对照组在位内膜都有表达,但在三者中的阳性表达率为26.7%、70%、96.7%存在差别,Sestrin1在异位内膜与对照组子宫内膜比较表达明显下调(P<0.05)差异有统计学意义,此种结论与Beliad A[13]发现的内异症病损部位P53表达下调,Sestrin1作为其靶向诱导蛋白,降低了对其诱导激活相一致。在经典的PI3K / Akt / mTOR信号通路中,mTOR高表达已被证实在内异症的细胞异常增殖及新生血管形成方面着重要作用[14],Sestrin1表达水平下调,通过另一条信号减弱甚至失去了对mTOR抑制作用,从而出现了mTOR高表达,在异位内膜细胞异常增殖的基础上有了新生血管的营养,促使内异症发展。目前在许多癌症疾病中经试验证实了P53与mTOR之间的相互作用引发肿瘤的发生,但在内异症的研究中没有得到证实,Sestrin1的发现,将二者联系起来,可能使内异症发病机制及治疗的研究更进一步。
3.2 Sestrin 2的表达与内异症
2002年Budanov[3]等发现了P53的低氧诱导基因95(Hi95),既Sestrin 2,定居于细胞核内1p35.3染色体,其编码的蛋白主要在细胞的生长及存活方面起重要作用。现有资料研究结果表明[15],诱导或抑制Sestrin 2的表达可通过调节JNK、AMPK及AKT等信号通路发挥其在人类恶性肿瘤形成过程中的作用,如肝细胞癌,鳞状细胞癌、黑色素瘤等。另有研究表明Sestrin 2对于细胞生长及存活的调节,通过各种信号通路最终主要是影响了细胞自噬来实现的[16],诱导Sestrin 2表达可促进细胞自噬。细胞自噬作为一种最基本的生命现象,参与了心血管系统疾病、微生物感染、肿瘤性疾病等过程。Beclin-1及LC-3为调节细胞自噬重要的基因,先后有学者利用免疫组化、RT-PCR等实验方法发现了当发生子宫腺肌症及内异症时,它们的表达水平明显降低[17],从而引起细胞自噬活性降低,成为了内异症形成的原因之一,同时在位内膜细胞的细胞自噬活性也有所降低,这个结论也作为“在位内膜决定”的重要补充。
在本研究中,Sestrin2在实验组异位内膜、在位内膜及对照组在位内膜都有表达,但表达水平不同,阳性率分别为20%、66.7%、96.7%,Sestrin2在内异症异位内膜表达明显低于在位内膜,差异有统计学意义(P<0.05),从而证明当发生内异症时Sestrin2低表达甚至不表达,使在位及异位内膜细胞的自噬活性降低,导致细胞增殖与死亡不能达到平衡,而发生了内异症,这与Borahay MA[18]等人提出的诱导细胞自噬可以使异位内膜细胞死亡相一致。
3.3 展望
Sestrin1、Sestrin2是肿瘤抑癌基因P53的调控基因,目前关于其与恶性肿瘤关系的研究已有报道,但在内异症方面少见,通过本次实验及现有的大量研究的结果发现当发生内异症时,Sestrin1、Sestrin2的低表达甚至不表达,最终参与了内异症发生的基础。Sestrin1、Sestrin2的发现可能对于内异症发病机制的研究及靶向生物治疗具有指导意义,诱导Sestrin1的表达或其编码的蛋白产物可以使内异症的高mTOR水平得到抑制,从而使降低细胞的增殖;靶向诱导Sestrin2的表达,提高细胞自噬的活性,从而使异常增殖的细胞发生死亡,达到细胞自身的平衡。因此对于Sestrin1、Sestrin2在内异症更深入的研究,可能对我们更进一步的了解内异症具有重要意义。
[1] Roman H,Darwish B.TO excise or ablate endometriosis? The temptation of the overstatement [J].J Minim invasive Gynecol, 2015,22(3):510-511.
[2] Buckbinder L, Talbott R, Seizinger BR, et al. Gene regulation bytemperature-sensitive P53 mutants: Identification of P53 response genes[J]. Proc NatlAcad Sci USA ,1994,91(22):10640-10644.
[3] Budanov AV, Shoshani T, Fearman A,et al.Identification of a new novelstress-responsive gene Hi95 involved inregulation cell viability[J]. Oncogene. 2002,21(39):6017-6031.
[4] Nogueira VA, Park Y, Chen ML, et al. Akt determines replicative senescence and oxidative or oncogenic premature senescence and sensitizes cell to oxidative apoptosis[J] .Cancer Cell,2008,14(6):458-470.
[5] Lee JH, Budanov AV, Park EJ, et al. Sestrins as a feedback inhibitor of TOR that prevent age-related pathologies[J].Scien ce,2010,327(5970):1223-1228.
[6] Budanov AV, Karin M. p53 target genes sestrin1 and sestrin2 connect genotoxic stress and mTOR signaling[J]. Cell,2008,134(3):451-460.
[7] 桑琳,赵卫东,杜世华.P53 P21 MDM2蛋白在卵巢子宫内膜异位症和子宫腺肌症中的表达及意义[J].安徽医学,2012,33(10):1346-1350.
[8] Leconte M, Nicco C, Ngo c, et al. The mTOR/AKT inhibitor temsirolimus prevent deep infiltrating endometriosis in mice[J].Am J Pathol.,2011,179(2):880-889.
[9] Ren Y, Mu L,Ding X, et al. Decreased expression of Beclin 1 in eutopicendometrium of women with adenomyosis. Arch Gynecol Obstet[J], 2010,282(4):401-406.
[10] Loayzap-puch F,Drost J,Rooijers K, et al.P53 induces transcriptional and translationalprograms to suppress cell proliferation andgrowth.Genome biol[J], 2013,14(4):32.
[11] LyraJ, winagreJ, BitistaR.mTOR activation in medu llary thyroid carcinoma with RASmutation[J]. Eur JEndocrinol,2014,171(5):633-640.
[12] Zaytseva YY, Valentino JD, Gulhati P, et al. mTOR inhibitors in cancertherapy[J]. Cancer Lett,2012,319(1):1-7.
[13] Beliad A,Noel A,Foidart JM.Reduction of apoptosis and proliferation in endometriosis[J].Fertil Steril,2004,82(1):80-85.
[14] Zhang H, Zhao X, Liu S, et al.17betaE2 promotes cellproliferation in endometriosis by decreasing PTEN via NFkappaBdependentpathway[J]. Mol CellEndocrinol,2010,317:31-43.
[15] Zhao B,Shah P,Budanov AV, et al.Sestrin2 Protein Positively Regulates AKT Enzyme Signaling and survival in humanSquamous Cell Carcinoma and Melanoma Cells[J].J BiolCh em,2014,289(52):35806-35814.
[16] Solhaug A,Torgersen ML,Holme JA, et al.Autophagy and senescence, stress responses induced by the DNA-damaging mycotoxin alternariol[J]. Toxicology,2014,326(4):119-129.
[17] Ren Y, Mu L,Ding X, Zheng W. Decreased expression of Beclin 1 in eutopicendometrium of women with adenomyosis[J]. Arch Gynecol Obstet, 2010,282(4):401-406.
[18] Mostafa A.Borahay , FangXian Lu , Bulent Ozpolat, et al.Mullerian inhibiting substance suppresses proliferation and induces apoptosisand autophagy in endometriosis cells in vitro[J]. ISRN Obstet and Gynecol,2013,2013(2013):361489.
Sestrin1,Sestrin2 Expressed in Endometriosis Group and Significance
WANG Wenfang,QIU Xiaohong
(Obstetrics and Gynecology Department of Changzhou Fourth People's Hospital, Jiangsu Changzhou 213000;The Second Affiliated Hospital of Harbin Medical University, Heilongjiang Harbin 150081,China)
Objective Testing stress induced protein family Sestrin1,Sestrin2 in the expression of endometriosis(EMS), to explore Sestrin1,Sestrin2 respectively form cell proliferation, cell autophagy , to research from the aspects of “cancers” behavior in the pathogenesis of EMS preliminary for targeted therapy provides new train of though and direction of the EMS.Methods Choosing the eutopic , ectopic endometrium of 35 patients , between April 2013 and April 2014 in the second affiliate hospital of Harbin Medical University department of gynaecology , confirmed by postoperative pathological diagnosis of EMS (experimental group) , at the same time 30 cases of endometrium with no EMS confirmed by postoperative pathological diagnosis of no endometrial disease (control group) . Detecting the expression of Sestrin1,Sestrin2 in eutopic ,ectopic endometrium and endometrium by using immunohistochemical SP method and reverse transcription PCR(RT-PCR) method. The data was analyzed by SPSS13.0 statistical soft ware.Results By using the immunohistochemical SP method , the positive rate of Sestrin1 inectopic ,eutopic endometriumand normal endometriumwere as follows:25.7%、62.9%、96.7%, indicating that the expression of Sestrin1 in ectopic endometrium with EMS is lower than the other two group, among which significant differences observed(P<0.05) ; the positive rate of Sestrin2 inectopic ,eutopic endometriumand normal endometriumwere as follows:20%、68.6%、96.7% indicating that the expression of Sestrin1 in ectopic endometrium with EMs is lower than the other two group, among which significant differences observed(P<0.05). Conclusion Sestrin1,Sestrin2 realize the form of EMs by cell growth ,effecting for early diagnosis, targeted therapy, treatment effect of EMs and the evaluation of the risk of recurrence of proving new theoretical basis.
Endometriosis; Sestrin1;Sestrin2; Immunohistochemical SP
R711.71
A
ISSN.2095-8803.2016.09.003.02
