纳米羟基磷灰石对人脂肪干细胞共混物三维生物打印影响的初步研究
2016-11-23王晓飞王宇光吕培军
宋 杨,王晓飞,王宇光,董 凡,吕培军
(北京大学口腔医学院·口腔医院,口腔医学数字化研究中心,口腔修复教研室 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室,卫生部口腔医学计算机应用工程技术研究中心, 北京 100081)
·论著·
纳米羟基磷灰石对人脂肪干细胞共混物三维生物打印影响的初步研究
宋 杨,王晓飞,王宇光,董 凡,吕培军△
(北京大学口腔医学院·口腔医院,口腔医学数字化研究中心,口腔修复教研室 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室,卫生部口腔医学计算机应用工程技术研究中心, 北京 100081)
目的:初步研究纳米羟基磷灰石对人脂肪间充质干细胞(human adipose-derived mesenchymal stem cells,hASCs)共混物三维生物打印体细胞增殖和成骨分化的影响。方法:以P5代hASCs作为种子细胞,将10 g/L纳米羟基磷灰石加入细胞-海藻酸钠-明胶共混物(20 g/L海藻酸钠,80 g/L明胶,细胞密度约为1×106个/mL)混合后进行三维生物打印,作为实验组;另将细胞-海藻酸钠-明胶共混物直接进行三维生物打印,作为对照组。在打印后的既定时间点上,对实验组和对照组分别进行显微镜观察、CCK-8检测、Western blot检测和PCR检测,分析打印体细胞增殖能力和成骨分化能力。结果:显微镜观察和CCK-8检测结果显示,实验组和对照组打印体内细胞在打印完成后24 h和7 d均呈现良好的增殖能力。Western blot结果显示,在打印完成后14 d,实验组和对照组的Runt相关转录因子(Runt-related transcription factor 2,RUNX2)蛋白水平差异无统计学意义。PCR结果显示,在打印完成后14 d,实验组的成骨相关基因RUNX2、osterix(OSX)和骨钙素(osteocalcin,OCN)表达明显高于对照组。结论:纳米羟基磷灰石加入后,打印体内细胞仍具有良好的增殖性,且打印体的体外成骨分化能力得到了增强。
打印,三维;纳米羟基磷灰石;间充质干细胞;脂肪组织
人脂肪来源间充质干细胞(human adipose-derived mesenchymal stem cells,hASCs)是成体间充质干细胞的一种,具有自我更新和多向分化潜能,与骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)相比,具有来源广泛、采集容易、经济便捷、易于临床推广等优点,已成为骨组织工程学研究中的热点[1]。传统的组织工程技术的基本原理是将体外培养扩增的种子细胞复合到支架材料上,构成细胞-支架复合体,再进行体外培养或植入体内相应的病损部位,对支架材料内部的细胞分布和密度难以精确控制,而三维生物打印作为一种新型的组织工程手段,可将细胞和打印基质混合,在计算机辅助下,按照预先设计的特定的三维结构,对活细胞、生物活性组织及相关生物材料等构成的共混物直接进行逐层堆积[2],具有良好的发展前景。
在细胞共混物三维生物打印研究中,由于明胶-海藻酸钠具有良好的生物相容性和可塑形性,为目前该类研究中最常采用的共混物组分[3],但其强度较差,易导致三维打印结构的解体和破坏[4-5],不利于细胞共混物三维生物打印技术的更进一步研究,尤其是体内应用的研究。另一方面,在传统组织工程学的支架材料研究中,纳米羟基磷灰石因其纳米尺寸下较普通羟基磷灰石更优的生物相容性、生物活性以及力学性能成为研究热点,各种纳米羟基磷灰石复合材料得到广泛的研究[6]。
本研究尝试对现阶段常用的三维生物打印基质成分进行初步改良,将纳米羟基磷灰石加入hASCs-海藻酸钠-明胶共混物后进行三维生物打印,研究其对打印后细胞的增殖性以及成骨分化能力的影响,以期获得更优的hASCs共混物三维生物打印基质组分构成,为今后进一步的体内研究提供实验参考。
1 材料与方法
1.1 主要仪器与试剂
主要仪器:Bioplotter三维生物打印机购自德国Envision公司。
主要试剂:hASCs细胞株购自美国Scien Cell公司,海藻酸钠、明胶、无水CaCl2、纳米羟基磷灰石粉末(粉末直径约100 μm)、CCK-8(cell counting kit-8)试剂盒、成骨诱导因子β-磷酸甘油、抗坏血酸、地塞米松均购自美国Sigma公司,DMEM(Dulbecco’s modified Eagle’s medium)培养基、胎牛血清、100×细胞培养用青链霉素混合液均购自美国Gibco公司,Western blot试剂均购自美国AMRESCO公司,PCR提取试剂Trizol购自美国Invitrogen公司,反转录试剂盒(Transcript RT Kit)购自中国天根生化公司,qPCR试剂盒购自美国KAPA Biosystems公司,细胞培养皿等耗材购自美国Corning公司。
1.2 hASCs共混物的三维生物打印
1.2.1 hASCs的培养和传代 将P2代hASCs加入增殖培养基(proliferation medium, PM),成分DMEM+10%(体积分数)胎牛血清+1%(体积分数)青链霉素,置于5%(体积分数)CO2,37 ℃细胞培养箱培养至7 d左右,细胞生长至70%~80%汇合状态后进行细胞传代,每个培养皿中的细胞经过胰酶消化、中和、离心和重悬后,接种至3个培养皿中,每6~7 d汇合度达到80%~90%后,再次进行传代;传代3次后的hASCs标记为P5作为实验用种子细胞。
1.2.2 hASCs共混物的制备 用生理盐水分别溶解海藻酸钠、明胶干粉,配置海藻酸钠-明胶混合溶胶,其中海藻酸为20 g/L,明胶为80 g/L。收集1.2.1小节中培养的P5代hASCs细胞,离心、重悬、计数,确认细胞存活率大于90%后,将细胞悬液与海藻酸钠-明胶水溶胶混合,并以10 g/L浓度加入纳米羟基磷灰石粉末,轻柔搅拌,制备细胞密度为1×106个/mL的hASCs共混物,作为实验组细胞共混物。另按上述方法制备不含纳米羟基磷灰石的hASCs-海藻酸钠-明胶水溶胶共混物,作为对照组细胞共混物。
1.2.3 hASCs共混物三维生物打印 将1.2.2小节中制备获得的实验组共混物置于Bioplotter三维生物打印机的料盒中,并与打印喷头相连,进行打印。打印过程中主要参数如下:打印温度15 ℃,打印喷头直径250 μm,打印微丝直径200 μm,微丝中心间距400 μm,打印设备配套软件系统根据上述设定参数,自动生成打印结构,结构示意图如图1所示。打印机基于微流连续挤出的生物绘图技术,由预先设计的计算机辅助设计(computer aided design,CAD )数字模型及扫描速度驱动打印机的喷头运动,将喷出的共混物拉成丝状,沉积到载有无菌细胞培养皿的平台上,挤出的共混物因明胶的温度敏感性发生物理交联,由溶胶转变为凝胶;打印为逐层进行,不同的打印层面之间交错叠加形成具有三维结构的打印体(图2)。打印完成即刻,使用 100 mmol/L CaCl2和50 mmol/L KCl2的混合溶液对三维打印体进行交联,交联5 min后获得最终的实验组打印体(Gexp)。另将对照组共混物按照上述同样方法和参数进行三维生物打印,获得对照组打印体(G0)。
图1 三维打印结构示意图 图2 具有三维结构的细胞共混物打印体
Figure 1 3D structure diagram of bio-printing Figure 2 Cells mixture with 3D structure after bio-printing
1.3 hASCs共混物三维生物打印体的检测
1.3.1 hASCs共混物三维生物打印体结构观测 将实验组和对照组hASCs共混物打印体均置于PM中进行常规细胞培养,于打印完成即刻、24 h和7 d采用倒置显微镜进行观察。
1.3.2 hASCs共混物三维生物打印体细胞增殖情况检测 将实验组和对照组hASCs共混物打印体均置于PM中进行常规细胞培养,于打印完成即刻、24 h和7 d,将各组打印体加入24孔板后分别对其进行CCK-8检测,记录450 nm各孔光密度值, 检测打印体内细胞增殖情况。
1.3.3 hASCs共混物三维生物打印体细胞成骨分化情况检测 将实验组和对照组hASCs共混物打印体均分别置于PM和成骨培养基(osteogenic medium,OM)中进行培养,成骨培养基成分DMEM+10%(体积分数)胎牛血清+1%(体积分数)青链霉素+10 mmol/L β-磷酸甘油+200 mmol/L抗坏血酸+100 nmol/L地塞米松,体外培养14 d后,获得PM实验组、PM对照组、OM实验组以及OM对照组(PM-Gexp、PM-G0、OM-Gexp以及OM-G0)打印体样本,进行如下检测:(1)Western blot检测:对各组打印体样本内细胞进行蛋白提取、收集、浓度调整、配胶、蛋白上样(每孔蛋白样本量为6 μg)、电泳、转膜、封闭,Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)一抗(Cell Signaling Technology,Danvers,MA,美国)孵育、洗膜,二抗孵育、洗膜,反应、曝光、定影,并对结果进行灰度分析;(2)qRT-PCR检测:对各组打印体样本内细胞进行RNA提取,反转录步骤按照反转录试剂盒(天根生化,中国)商品说明书进行,qRT-PCR检测步骤按照qPCR试剂盒(KAPA Biosystems,美国)商品说明书进行,对RUNX2、osterix(OSX)和骨钙素(osteocalcin,OCN)的基因表达水平进行检测,其中RUNX2、OSX和OCN引物序列如表1所示。
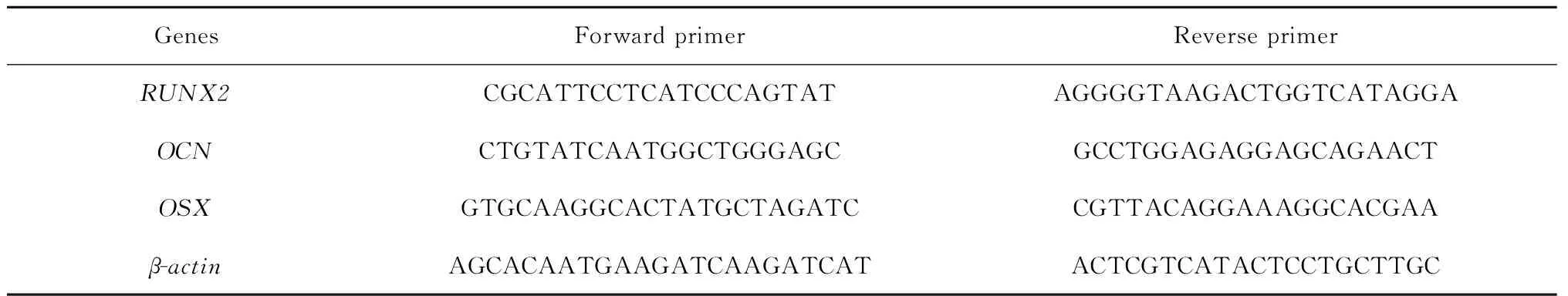
表1 实时定量PCR引物序列Table 1 Sequences of the primers used for real-time PCR
RUNX2, Runt-related transcription factor 2;OCN, osteocalcin;OSX, osterix.
1.3.4 统计学方法 使用SPSS 17.0软件,对1.3.3小节中各组别的qRT-PCR结果采用均值±标准差方式描述,并进行方差分析,检验水准为双侧α=0.05。
2 结果
2.1 hASCs共混物三维生物打印后显微镜观察结果
在打印完成即刻、24 h和7 d,倒置显微镜观察实验组和对照组打印体发现:三维打印体内细胞分布均匀,实验组打印体内可见散在分布的纳米羟基磷灰石颗粒;打印后7 d实验组和对照组打印体内细胞均呈现显著增殖,对照组打印体内局部出现了结构解体现象(图3)。
A,G after printed immediately; A’, G after printed immediately; B, G 24 h after printed; B’, G 24 h after printed; C, G 7 d after printed; C’, G 7 d after printed. Red arrow indicates nano hydroxyapatite particle, white arrow indicates porous structure, and blue arrow indicates disintegration of structure.
图3 细胞共混物打印后的显微镜观察结果
Figure 3 Microscope observation results of hASCs mixture after bio-printing
2.2 hASCs共混物三维生物打印后细胞增殖情况检测
通过CCK-8检测,在打印完成即刻、24 h和7 d分别对实验组和对照组细胞增殖进行观测,并绘制细胞增殖曲线,结果显示,实验组与对照组打印体内细胞在打印完成后24 h和7 d两个观察点均呈现增殖趋势(图4),表明纳米羟基磷灰石的加入对hASCs共混物三维生物打印体内的细胞增殖能力无不良影响。
2.3 hASCs共混物三维生物打印后成骨分化情况
2.3.1 Western blot检测结果 Western blot及灰度分析结果如图5和表2所示,体外培养14 d后,OM组打印体的RUNX2蛋白水平高于PM组,而OM实验组和OM对照组之间以及PM 实验组和PM对照组之间均无明显差异。
图4 打印后细胞增殖曲线
Figure 4 Proliferation curves for cells after bio-printing
2.3.2 qRT-PCR检测结果 体外培养14 d后,各组hASCs共混物打印体基因表达水平的qRT-PCR结果如图6所示。RUNX2、OSX、OCN在各组间差异存在统计学意义(P<0.01),OM组明显高于PM组,OM实验组明显高于OM对照组,PM实验组明显高于PM对照组。
图5 RUNX2蛋白印迹法结果
Figure 5 Western blot results of RUNX2
3 讨论
现阶段三维生物打印研究中所用的打印墨水多为水凝胶类材料[7-8],一般满足以下条件:(1)具有良好的生物相容性;(2)具有可塑型,可通过挤出方式成形;(3)可通过调节材料的温度和交联剂等交
联条件,对材料交联过程进行控制,实现打印体结构的成形稳定;(4)可以为细胞提供相应的生长微环境,利于细胞的生长扩增以及营养物质的渗透扩散。海藻酸钠-明胶混合物较好的满足了上述特性,且海藻酸钠可通过交联剂CaCl2的化学作用发生离子置换而形成降解速度较慢的海藻酸钙,可以在一定时间内维持结构体在三维方向上的稳定性,有研究表明该混合物中的明胶在打印后24 h就有部分流失降解,在海藻酸钙中形成不规则孔隙,利于细胞在打印体中的附着与迁移,因此,海藻酸钠-明胶共混物是目前三维生物打印研究中最为常用的材料之一[9-11]。但是,海藻酸钠-明胶也受水凝胶本身性质限制,强度较低,当进行多层打印或者构建尺寸较大的打印体时,易出现结构塌陷以及结构的不稳定。另外,本课题组在前期研究中发现,细胞共混物三维生物打印体在体外培养7~14 d时,海藻酸钠-明胶构成的打印结构即出现解体现象。
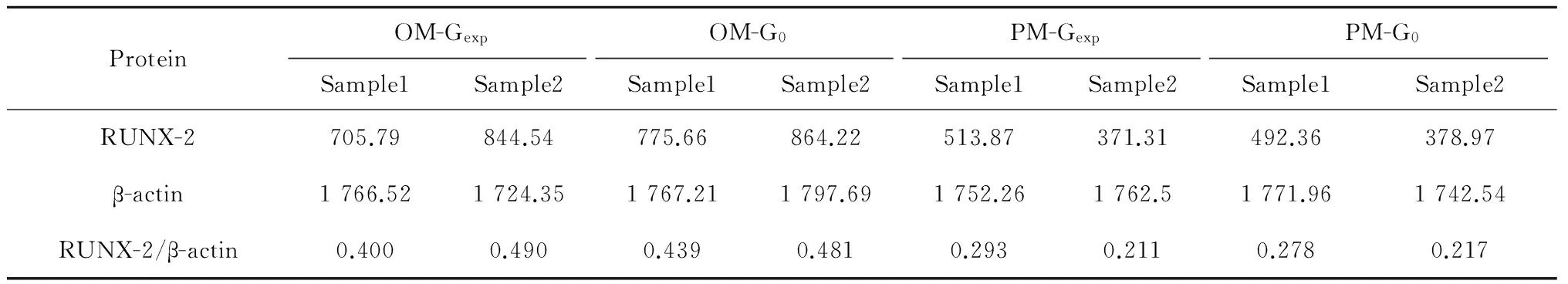
表2 蛋白印迹积分光密度值分析Table 2 Integrated option density results of Western blot
图6 成骨基因表达的qRT-PCR检测结果
Figure 6 qRT-PCR results for osteogenic genes expression
羟基磷灰石作为人和动物骨骼的主要无机物组成成分,具有良好的生物活性和生物相容性[12-13]。研究表明,当羟基磷灰石的尺寸达到纳米级时,该材料会表现出一些新的特殊性能,具有更强的力学性能和生物活性。目前,在组织工程学研究应用中多采用纳米羟基磷灰石与天然高分子或人工高分子材料构成的复合材料,如:纳米羟基磷灰石/胶原蛋白复合材料作为骨组织工程支架材料有利于成骨细胞的早期附着[14],可提高其分化能力[15];纳米羟基磷灰石/壳聚糖-硫酸软骨素复合材料具有良好的矿化能力和力学性能[16]等。
因此,本研究尝试对现有三维生物打印的常用打印基质进行改良,在海藻酸钠-明胶水凝胶中加入纳米羟基磷灰石。所采用的纳米羟基磷灰石颗粒直径小于200 nm,以合适的浓度加入海藻酸钠-明胶水溶胶后得到的混合物可以满足细胞共混物三维生物打印过程中对于打印基质材料流动性和塑形性质的要求;另一方面,基于以往传统组织工程学研究中纳米羟基磷灰石材料所表现出的生物学和力学特性,纳米羟基磷灰石颗粒对于细胞共混物三维生物打印体的结构稳定、力学性能以及生物性能等可能都将产生积极的作用。本实验成功获取了具有高细胞活性的含有纳米羟基磷灰石的三维生物打印结构体,证实了将纳米羟基磷灰石加入细胞共混物三维打印基质的可行性,并获得了纳米羟基磷灰石对打印体内细胞增殖情况和成骨分化情况影响的初步结果。在后续研究中,课题组将就其对于细胞共混物三维生物打印体的力学性能、生物学性能以及动物体内植入实验的影响展开进一步的研究。
[1]Zuk PA,Zhu M, Ashjian P, et al. Human adipose tissue is a source of multipotent stem cell[J]. Mol Biol Cell, 2002, 13(12): 4279-4295.
[2]Mironov V, Boland T, Trusk T, et al. Organ printing: computer-aided jet-based 3D tissue engineering[J]. Trends Biotechnol, 2003, 21(4): 157-161.
[3]Fedorovich NE, Alblas J, de Wijn JR,et al. Hydrogels as extracellular matrices for skeletal tissue engineering: state-of-the-art and novel application in organ printing[J]. Tissue Eng, 2007,13(8): 1905-1925.
[4]Murphy SV, Skardal A, Atala A. Evaluation of hydrogels for bio-printing applications[J]. J Biomed Mater Res A, 2013, 101(1): 272-284.
[5]马成浩. 海藻酸钠防止降解研究[D].江苏: 江南大学, 2005.
[6]涂浩, 闰玉华. 纳米羟基磷灰石复合材料在骨组织工程中的应用[J]. 生物骨科材料与临床研究, 2006, 3(3): 47-49.
[7]Yoo SS.3D-printed biological organs: medical potential and patenting opportunity[J].Expert Opin Ther Pat, 2015, 25(5): 507-511.
[8]Rimann M, Bono E, Annaheim H,et al.Standardized 3D bioprinting of soft tissue models with human primary cells[J]. J Lab Autom, 2016, 21(4): 496-509
[9]薛世华, 吕培军, 王勇, 等. 人牙髓细胞共混物三维生物打印技术[J]. 北京大学学报: 医学版, 2013, 45(1): 105-108.
[10]刘海霞, 颜永年, 王小红, 等. 肝细胞的三维受控组装[J]. 清华大学学报:自然科学版, 2005, 45(8): 1009-1011.
[11]Wang XH, Yan YN, Zhang RJ. Rapid prototyping as a tool for manufacturing bioartificial livers[J]. Trends Biotechnol, 2007, 25(11): 505-513.
[12]冯庆玲, 崔福斋, 张伟. 纳米羟基磷灰石/胶原骨修复材料[J]. 中国医学科学院学报, 2002, 24(2): 124-128.
[13]马雄华, 韩颖超, 李世普. 纳米羟基磷灰石复合材料研究进展[J]. 生物骨科材料与临床研究, 2006, 3(3): 50-53.
[14]马红梅,吴琳,艾红军,等. 纳米羟基磷灰石/胶原/聚乳酸支架材料对人成骨细胞早期附着影响的实验研究[J].生物医学工程与临床, 2007, 11(3): 161-163.
[15]王程越,姚玉胜,艾红军,等.纳米羟基磷灰石/胶原对富血小板血浆促进骨髓基质干细胞向成骨分化的影响[J].口腔医学研究, 2007, 23(3): 241-244.
[16]吕彩霞,姚子华.纳米羟基磷灰石/壳聚糖-硫酸软骨素复合材料的制备及其性能研究[J].复合材料学报, 2007, 24(1): 110-115.
(2015-06-08收稿)
(本文编辑:赵 波)
A preliminary study for the effect of nano hydroxyapatite on human adipose-derived mesenchymal stem cells mixture 3D bio-printing
SONG Yang, WANG Xiao-fei, WANG Yu-guang, DONG Fan, LU Pei-jun△
(Center of Digital Dentistry, Department of Prosthodontics, Peking University School and Hospital of Stomatology & Na-tional Engineering Laboratory for Digital and Material Technology of Stomatology & Beijing Key Laboratory of Digital Stomatology, Research Center of Engineering and Technology for Digital Dentistry of Ministry of Health, Beijing 100081, China)
Objective:To study the effect of nano hydroxyapatite on human adipose-derived mesenchymal stem cells(hASCs) mixture 3D bio-printing for cells’ proliferation and osteogenesis. Methods: P5hASCs were used as seed cells, 10 g/L nano hydroxyapatite was added into the cell-sodium alginate-gelatin mixture (concentration: 20 g/L sodium alginate, 80 g/L gelatin; cell density: 1×106/mL), then the mixture was printed by 3D bio-printer as the experimental group. And the cell-sodium alginate-gelatin mixture without nano hydroxyapatite was printed as the control group. Respectively, both the experimental and control groups were detected by microscope, CCK-8, Western blot and PCR at certain time pointsafter being printed, whose cells’ proliferation and osteogenic differentiation were analyzed. Results: The microscopic observation and CCK-8 results showed that the cells of the experimental group and the control group both had a good proliferation 24 h and 7 d after being printed. The Western blot results showed that 14 d after printing, the expression of Runt-related transcription factor 2 (RUNX2) had no statistical difference between the experimental group and control group. The PCR results showed that 14 d after printing, the expression of osteogenesis-related genes (RUNX2, osterix, and osteocalcin) was significantly higher in the experimental group than in the control group. Conclusion: Nano hydroxyapatite can increase osteogenic differentiation of the hASCs mixture after bio-printing, in which the cells still have a good proliferation.
Printing, three-dimensional; Nano-hydroxyapatite; Mesenchymal stromal cells; Adipose tissue
教育部科学技术研究项目(113002A)资助Supported by Science and Technology Research Project of Chinese Ministry of Education, China (113002A)
时间:2016-9-5 9:44:51
http://www.cnki.net/kcms/detail/11.4691.R.20160905.0944.034.html
R329.4
A
1671-167X(2016)05-0894-06
10.3969/j.issn.1671-167X.2016.05.027
△ Corresponding author’s e-mail, kqlpj@bjmu.edu.cn
