根管封闭剂对牙周膜细胞生物相容性的影响
2016-11-23邹晓英高学军
胡 佳,邹晓英,庄 姮△,高学军
(1. 北京大学口腔医学院·口腔医院,牙体牙髓科 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室, 北京 100081; 2. 福建医科大学附属口腔医院牙体牙髓科, 福州 350002)
·论著·
根管封闭剂对牙周膜细胞生物相容性的影响
胡 佳1,2,邹晓英1,庄 姮1△,高学军1
(1. 北京大学口腔医学院·口腔医院,牙体牙髓科 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室, 北京 100081; 2. 福建医科大学附属口腔医院牙体牙髓科, 福州 350002)
目的:研究氧化锌丁香油类(zinc oxide and eugenol based sealers,ZOE)、环氧树脂类(epoxy resin sealers,ERS)、硅酮基类(silicone based sealers,SBS)根管封闭剂对牙周膜细胞(human periodontal ligmant cells, hPDLCs)的增殖和矿化潜能的影响。方法:选用3颗不同人牙齿来源的hPDLCs进行重复实验,采用酶消化法+组织块培养法进行hPDLCs体外原代培养,按照培养基的不同成分分组:(1)ZOE固化 24 h 浸提液培养基组;(2)ZOE固化 1周浸提液培养基组;(3)ZOE固化 2周浸提液培养基组;(4)ERS固化 24 h 浸提液培养基组;(5)ERS固化 1周浸提液培养基组;(6)ERS固化 2周浸提液培养基组;(7)SBS固化 24 h 浸提液培养基组;(8)SBS固化 1周浸提液培养基组;(9)SBS固化 2周 浸提液培养基组;(10)不含浸提液培养基组(对照组)。采用倒置显微镜观察hPDLCs细胞形态的变化,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(methyl-thiazol-diphenyltetrazolium,MTT)法测定细胞增殖能力,试剂盒法测定碱性磷酸酶(alkaline phosphatase,ALP)活性。选取固化2周的各组材料制备矿化诱导浸提液,不含浸提液的矿化培养基为阳性对照组,采用茜素红染色法及氯化十六烷基吡啶半定量法分析矿化物形成情况。结果:比较相对增殖率( relative growth rate,RGR),ZOE固化2周内均具有中度或严重细胞毒性(RGR为13.6%~39.9%);ERS固化24 h具有轻微细胞毒性(RGR为63.6%~76.4%),固化1周后轻微或无细胞毒性(RGR为87.6%~95.3%);SBS固化后无明显细胞毒性(RGR为91.8%~106.7%)。比较ALP活性,SBS不同固化时间组间差异无统计学意义(F=3.397,P=0.053),且均高于ZOE和ERS组。半定量法检测数据显示,ZOE:D562 nm= 0.180±0.050,ERS:D562 nm= 2.968±0.201,SBS:D562 nm=3.623±0.039,对照组:D562 nm=3.477±0.102,即ZOE 根管封闭剂;牙周膜;细胞,培养的;细胞增殖;牙再矿化 将根管封闭剂充填于根管壁与牙胶之间的不规则空间,对于形成良好的根尖封闭至关重要。然而由于解剖、病理以及医源性等因素可能发生根管封闭剂超填充,即便在恰填充的情况下,封闭剂的溶出物、降解物仍然可能渗透、扩散出根尖孔[1]。人牙周膜细胞(human periodontal ligament cells,hPDLCs)在有根尖病变的患牙中,是组织愈合的主要细胞来源[2],在没有根尖病变的患牙中,直接与根管封闭剂的溶出物、降解物或者超出根尖的部分接触,因此,根管封闭剂对hPDLCs生物活性的影响与根管治疗的效果密切相关。 临床上常用的根管封闭剂有氧化锌丁香油制剂、含钙制剂、玻璃离子制剂以及聚合物类制剂。氧化锌丁香油类根管封闭剂(zinc oxide and eugenol based sealers,ZOE)具有亲水性,研究报道对细胞刺激性较大[3]。环氧树脂类根管封闭剂(epoxy resin sealers,ERS)具有良好流动性和临床可操作性,与牙本质有弱粘接的特性提高了封闭性,然而是否存在细胞毒性评价不一[4]。硅酮基类根管封闭剂(silicone based sealers,SBS)具有良好的流动性和加压触变性,同时也增加了超填充的风险。许多文献报道SBS仅有轻微或无细胞毒性[4-5],然而对于hPDLCs细胞分化及其矿化潜能的影响并无相关研究,因此,本研究评价3种常用根管封闭剂对hPDLCs的细胞毒性和矿化潜能的影响,为探讨根管封闭剂对根尖周组织修复的影响提供理论依据。 1.1 主要材料和仪器 改良Eagle培养基(Dulbecco modified Eagle’s medium/ F12, DMEM/F12)、Ⅰ型胶原酶、胎牛血清(fatal bovine serun,FBS)、青霉素、链霉素、L-谷氨酰胺、0.25% (质量分数)胰蛋白酶-EDTA购自美国Gibco公司,维生素C、β-甘油磷酸钠、地塞米松购自英国Sigma-Aldrich公司,MTT粉末购自美国Amresco公司,BCA蛋白定量试剂盒(PC0020)购自北京索莱宝科技有限公司,碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒购自南京建成科技有限公司,茜素红溶液购自美国Sigma公司,氯化十六烷基吡啶购自国药集团化学试剂有限公司,倒置显微镜购自日本Nikon公司,酶标仪购自美国BioTek公司,超声细胞破碎仪购自美国Branson公司,ZOE购自美国SybronEndo公司,ERS购自美国Dentsply公司,SBS购自德国ColteneWhaledent 公司。 1.2 细胞培养 本研究经北京大学口腔医院生物医学伦理委员会审核批准(批准号:PKUSS-IRB-201310064),实验开始前获得研究对象的知情同意。收集11~19岁因阻生或正畸拔除的健康前磨牙或第三磨牙,采用酶消化法+组织块培养法[6-7],实验细胞来源于3颗牙齿。在超净台内刮取根中部1/3牙周膜组织,加入0.3%(质量分数)的Ⅰ型胶原酶37 ℃消化30 min。1 000 r/min离心3 min,将组织块均匀接种于25 mL细胞培养瓶中,倒置培养瓶,加入5 mL含20%(质量分数)FBS和双抗的DMEM/F12,于5%(体积分数)CO2,37 ℃培养箱中静置培养,4 h后翻转培养瓶。继续培养5 d,之后每2~3天换液一次。细胞生长至80%~90%汇合时,用0.25%(质量分数)胰蛋白酶-EDTA消化传代培养,第3代用于实验。 1.3 浸提液制备 浸提液样本的制备依据《医疗器械生物学评价——第12部分:样品制备与参照样品》,标准号ISO 10993-12:2007。取 ZOE、ERS、SBS 3种根管封闭剂制备成直径 4 mm 、厚3 mm的圆柱体,37 ℃,5%CO2条件下固化24 h,于DMEM/F12培养基中浸提24 h(材料块的表面积/培养液体积=0.125 m2/L),得到固化24 h的浸提液,材料块继续置于DMEM/F12培养基中,隔周换液后分别浸提24 h,得到固化后1周、2周的浸提液,用0.22 μm滤膜过滤除菌,加入10% (质量分数)FBS,制备成浸提液。 1.4 分组情况和hPDLCs细胞增殖能力测定 实验分组:(1)ZOE 24 h 浸提液培养基组;(2)ZOE 1周浸提液培养基组;(3)ZOE 2周浸提液培养基组;(4)ERS 24 h 浸提液培养基组;(5)ERS 1周浸提液培养基组;(6)ERS 2周浸提液培养基组;(7)SBS 24 h 浸提液培养基组;(8)SBS 1周浸提液培养基组;(9)SBS 2周浸提液培养基组;(10)DMEM/F12培养基组(对照组)。取对数生长期第3代hPDLCs以2×104个/孔密度接种于96孔板,37 ℃、5%CO2孵育过夜待其贴壁,记为第 0 天。每孔更换200 μL材料浸提液或DMEM/F12培养基,隔天换液。以接种后第 0、1、3、5、7、14 天为测定点,取各组细胞,每孔加入5 g/L 的MTT 溶液20 μL,4 h后弃原液,每孔加入 150 μL DMSO,振荡 10 min,用酶标仪测定各孔光密度值(D492 nm)。实验重复6次。 细胞毒性反应依据相对增殖率 (relative growth rate,RGR)分为严重(<30%)、中度(30%~60%)、轻微(60%~90%)、无细胞毒性(≥90%)[8]。RGR(%)=(D实验组/D对照组)×100% 1.5 hPDLCs碱性磷酸酶活性检测 取第3代hPDLCs细胞,以5×104个/孔密度接种到24孔板中,置于 37 ℃、5%CO2孵育过夜待细胞贴壁,更换2 mL材料浸提液或DMEM/F12培养基,记为第 0 天。隔天换液,连续培养7 d和10 d后,按照试剂盒说明书进行ALP定量检测。实验重复3次。 1.6 矿化染色及半定量实验 选取固化2周的材料,用矿化诱导液[含10% (质量分数)FBS、10 mmol/L β-甘油磷酸钠、10-4mmol/L地塞米松、50 mg/L维生素C的高糖DMEM培养液]制备各组矿化浸提液,以不含浸提液的矿化诱导液为阳性对照组。取第3代hPDLCs细胞,以5×104个/孔密度接种到24孔板中,待细胞生长至60%汇合后,换各组矿化诱导液培养。此后隔 3 天换各组培养液1次。分别于第 14、 28 天, 用95%乙醛固定15 min,室温下加入等量pH 4.2 的茜素红溶液37 ℃染色30 min,去离子水冲洗去除非特异性染色,倒置显微镜下观察、拍照。将茜素红染色(第28 天)后的孔板彻底晾干,加入 1 mL 100 mmol/L 氯化十六烷基吡啶溶液,室温下 100 r/min 轻摇,各孔分别吸取150 μL紫色溶液转移入96孔板内,用酶标仪测各孔光密度值(D562 nm)。实验重复3次。 1.7 统计学分析 用SPSS 19.0软件处理数据,采用单因素方差及Turkey法分析,假设检验为双侧检验,P<0.05 为差异有统计学意义。 2.1 正常hPDLCs细胞的形态 原代培养的第6 天开始,即有细胞从组织块周围游出,细胞为星形或长梭形,约14 d细胞铺满瓶底的80%,细胞生长旺盛。用于实验的第3代细胞呈漩涡状、栅栏状、放射状外观。高倍镜下观察(图1),细胞呈星形、长梭形,周围有数个长短不同的突起,胞体丰满,胞浆均匀,核圆形或卵圆形,核仁清晰。 图1 正常hPDLCs形态(×200)1 资料与方法
2 结果
Figure 1 Normal morphology of hPDLCs (×200)
2.2 各组细胞形态变化
倒置显微镜下观察,在ZOE各固化时间的浸提液作用下细胞形态发生明显变化。ERS固化早期(24 h)组可见部分细胞圆缩,细胞间间隙增大。ERS固化1周、2周组以及SBS各组细胞未见明显形态变化(图2)。
2.3 各组细胞增殖情况及毒性评级
固化24 h时比较各组浸提液培养下hPDLCs细胞增殖情况。ZOE浸提液组培养下,短时间内(1 d)即出现细胞密度减低,第3 天降至最低,细胞基本无增殖。ERS浸提液组经历了迟缓期、对数增殖期,第7 天开始生长速度减慢。SBS组细胞增殖曲线与对照组一致,均较早进入对数期,第7 天时,细胞密度最高(D492 nm= 0.457±0.059),分别为ERS(D492 nm= 0.326±0.023)的1.3倍,ZOE(D492 nm= 0.014±0.008)的32.6倍,差异有统计学意义(P<0.05)。
固化1周和2周时,ZOE浸提液组培养第1 天均出现细胞密度减低,细胞总体生长缓慢,无典型的生长周期。ERS浸提液组和SBS浸提液组细胞增殖曲线与对照组一致,大约在培养7 天后达到最高生长速度,第14 天时,各组间细胞密度差异无统计学意义(ERS:D492 nm= 0.580±0.027,SBS:D492 nm= 0.619±0.023,P=0.226)。
比较RGR,ZOE固化2周内均具有中度到严重细胞毒性(RGR为13.6%~39.9%)。ERS 24 h浸提液对hPDLCs的生长有轻微细胞毒性(RGR为63.6%~76.4%), 固化1周后轻微或无细胞毒性(RGR为87.6%~95.3%),固化2周后无细胞毒性(RGR为92.8%~99.0%)。SBS各组均无明显细胞毒性(RGR为91.8%~106.7%),见表1。
A, control group; B, zinc oxide and eugenol based sealers ;C, epoxy resin sealers;D, silicone based sealers.
图2 固化24 h浸提液作用下各组细胞形态(×100)
Figure 2 Cell morphology of hPDLCs cultured with medium containing 24 h extract fluids (×100)
表1 根管封闭剂浸提液对hPDLCs细胞毒性分级
Table 1 Cytotoxicity rate of different sealer extractions to hPDLCs
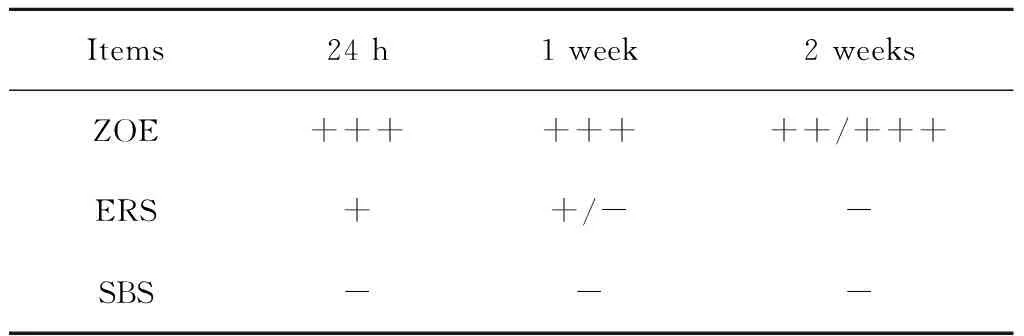
Items24h1week2weeksZOE++++++++/+++ERS++/--SBS---
-, not cytotoxic;+, slightly cytotoxic;++, modetately cytotoxic; +++, severe cytotoxic ; ZOE, zinc oxide and eugenol based sealers;ERS, epoxy resin sealers;SBS, silicone based sealers.
2.4 各组细胞的碱性磷酸酶活性
随着固化时间的延长,ZOE各组浸提液培养hPDLCs的ALP活性有升高趋势,各组间差异有统计学意义(F=17.983,P=0.003)。ERS各组ALP活性随固化时间延长而增加,固化1周和2周组间差异无统计学意义,两组均显著高于固化24 h组(F=6.750,P=0.041)。SBS各组间ALP活性无明显差异(F=3.397,P=0.053), 均高于ZOE和ERS组,见图3。
A, extraction from sealers left to set for 24 h; B, 1 week; C, 2 weeks; *P<0.05, vs. control group; ▲per gram protein; ZOE, zinc oxide and eugenol based sealers;ERS, epoxy resin sealers;SBS, silicone based sealers;Con, control group;ALP, alkaline phosphatase.
图3 培养第7 天和第 10 天 的ALP测定结果
Figure 3 ALP activity of hPDLCs cultured with different medium at day 7 and 10
2.5 各组细胞矿化结节形成情况
矿化培养第14 天,阳性对照组细胞开始复层生长,周围出现许多颗粒样改变,并逐渐连接成片,孔板底部出现肉眼可见的针尖大小灰白色小结节,并逐渐增大,显微镜下见灰黑色小结节聚集成簇。ZOE矿化组无小结节形成,局部出现无细胞区。ERS矿化组镜下可见少量散在灰黑色小结节。SBS矿化组形成多处片状灰白色结节,密度较对照组高,显微镜下见灰黑色小结节聚集成簇,茜素红染色显示为钙结节。
矿化培养第28 天肉眼和镜下观察(图4),ZOE矿化组内仅有散在矿化结节形成,ERS矿化组有中等量矿化结节形成,阳性对照组和SBS矿化组染色和镜下观察均可见大量红染结节。用氯化十六烷基吡啶对矿化第28 天各组封闭剂矿化结节充分溶解染色后进行半定量法检测(图5),数据分析显示ZOE和ERS组钙化低于阳性对照组(ZOE:D562 nm= 0.180±0.050,ERS:D562 nm= 2.968±0.201),差异有统计学意义(P<0.05),SBS组略高于阳性对照组(SBS:D562 nm= 3.623±0.039,阳性对照组:D562 nm= 3.477±0.102),差异无统计学意义(P>0.05)。3种封闭剂浸提液对hPDLCs矿化结节形成的作用为ZOE 影响材料生物相容性的原因包括组成成分、溶解成分、固化特性、固化后稳定性、材料与根尖周组织接触面积等。本研究中ZOE不同固化时间浸提液作用下均出现细胞不规则卷曲、死亡,相对增殖率低于30%,具有严重细胞毒性。ZOE主要由氧化锌粉和丁香油调制而成,与组织液接触后可逐渐溶解,并释放甲醛、丁香油[3]。许多研究报道含有丁香油的根管封闭剂具有长期细胞毒性,其机制可能为芳香环上所含的极性基团与某些酶的活性基团结合,破坏细胞正常的代谢功能,从而影响了细胞的生长。此外,ZOE中持续发挥防腐、杀菌作用的纳米银成分,会对鼠成纤维细胞 L929 产生细胞毒性[9]。 ERS浸提液的细胞毒性结果显示,仅固化24 h的浸提液具有轻微细胞毒性,结果与之前研究相符。ERS固化初期的毒性可能与其释放微量甲醛、环氧树脂(双酚A-二环氧丙酯醚)及固化剂四氮六甲环(hexamethylenetetramine,HMT)有关。手工调和的封闭剂不可避免地会出现不均一或表面出现孔隙的情况,可能释放部分树脂单体,研究认为树脂单体具有细胞毒性和致突变性; HMT由甲醛和氨组成,混合在水溶液或酸环境下可再分解成甲醛和氨,在固化初期具有高细胞毒性[10]。随着固化时间延长,可溶解、降解的成分减少,聚合转化率增高,毒性影响亦随之减弱消退相关。Eldeniz等[11]的研究得出ERS的甲醛释放量随固化后而降低,与材料毒性随固化时间延长而减弱的趋势一致。 硅酮类根管封闭剂SBS显示出良好的生物相容性。本实验结果显示,其固化24 h、1周和2周的浸提液对hPDLCs的增殖均无明显影响,甚至在某些测定点发现轻微促细胞增殖的作用,相似的结果也出现于对小鼠胚胎成骨细胞前体(mouse embryo osteoblast precursor,MC3T3-E1)的研究和另一种硅酮类封闭剂GuttaFlow的体外实验[12-14]。许多文献亦报道SBS仅有轻微或无细胞毒性。A1-Awadhi等[15]从细胞凋亡方面进行研究,结果显示SBS诱使MC3T3-E1细胞凋亡的活性显著低于其他封闭剂,提示暴露于自混型SBS浸提液中的细胞增殖机制未受影响。SBS不抑制细胞增殖的原因可能与其稳定的性质相关,其主要成分聚二甲硅氧烷是修复科的常用材料,具有良好的生物相容性;在室温下发生硅氢交联反应无副产物生成;参照《牙科牙根管充填材料》,标准号ISO 6876-2001所进行的试验结果显示,溶解度仅为0%~0.5%,意味着溶解、降解到周围组织中的成分少、浓度低[5]。 在临床运用中,固化材料的溶解、降解物与根尖周组织接触的浓度随时间逐渐降低的原因是由于体内不同细胞类型的广泛存在,并且机体自我免疫调节具有持续清除刺激的能力造成的[16]。本研究中选择已无明显细胞毒性的浸提液进行矿化实验的原因为:(1)模拟临床使用中材料经机体自我免疫调节清除后处于非急性毒性的情况;(2)避免材料高细胞毒性导致细胞死亡而无法评价其对矿化的影响。Bryan等[17]观察到ERS、钙硅基质封闭剂第6周的浸提液对MC3T3-E1细胞无细胞毒性,并进一步分析了其对MC3T3-E1细胞成骨潜能的影响。 ALP被普遍认为是成骨细胞/成牙骨质细胞分化成熟和成骨、成牙骨质功能的标志酶[18],hPDLCs其中一种亚型即是成骨样细胞,因此ALP活性的改变可以衡量hPDLCs的细胞状态及成骨能力,而矿化结节的形成是细胞具备成骨、成牙骨质特性的另一有力证据,可用来衡量诱导后体外培养的hPDLCs的增殖分化和矿化潜能[2]。本研究中,ZOE组ALP活性低,持续时间短;矿化结节形成量显著低于各组,且出现细胞衰减死亡,提示ZOE影响hPDLCs的细胞状态,降低其向成骨或成牙骨质方向转化的能力,原因可能与ZOE溶解释放甲醛相关。研究表明,甲醛显著降低实验鼠的ALP活性水平[19],可释放甲醛的根管封闭剂显著抑制人成骨细胞的ALP的活性及 mRNA的表达,可能是根管封闭剂引起骨吸收的机制之一[20]。 A, positive control group;B, zinc oxide and eugenol based sealers osteogenic medium,arrow shows the dead zone;C, epoxy resin sealers osteogenic medium;D, silicone based sealers osteogenic medium .3 讨论
图4 矿化诱导第28天茜素红染色结果(×200)
Figure 4 Alizarin red S staining of hPDLCs cultured with different medium at day 28(×200)
*P<0.05, vs. control group; ZOE, zinc oxide and eugenol based sea-lers; ERS, epoxy resin sealers; SBS, silicone based sealers;Con, control group.
图5 矿化诱导第28 天半定量法测量结果
Figure 5 Quantitative detection of calcification deposition of hPDLCs cultured with different medium at day 28
ERS组ALP活性及矿化能力均低于对照组,表明牙周膜细胞的分化可能对微环境变化非常敏感,固化2周内的ERS虽不抑制细胞增殖,但存活的细胞并非完全处于健康状态,表现为ALP活性的降低,可能影响hPDLCs向成骨方向分化及矿化能力。本结果与以往有关ERS在组织矿化、修复中的影响的体内研究有一定的相关性。Kim[21]的研究表明,ERS上调了MC3T3细胞的促炎细胞因子TNF-α,IL-1β的水平,提高了骨炎性因子RANKL,COX-2的表达,降低了成骨相关分子BMP-2,BMP-7和Runx-2的水平。牙周膜细胞与成骨细胞在功能和特征上有着相似性,因此推测ERS在hPDLCs细胞分化及矿化中发挥类似作用,即通过上调促炎细胞因子及骨炎性因子的表达,降低成骨相关分子的水平,影响细胞向成骨方向分化,降低成骨标志物ALP活性和矿化能力,从而延缓细胞外基质的矿化[22]。对实验犬的组织学研究显示,ERS组根尖矿化组织的形成低于SBS组[23]。将ERS植入小型猪下颌骨4周后产生严重炎性反应,观察到坏死骨片[1]。对根尖周病变患牙进行回顾性分析,结果显示6个月复查时ERS恰填充组和超填充组的成功率差异有统计学意义,4年后复查差异无统计学意义,提示ERS超填不阻止但延缓根尖周组织的愈合[24]。
SBS各组ALP活性与矿化结节形成量一致,均高于ERS 组,与对照组差异无统计学意义,提示SBS不抑制hPDLCs向成骨方向分化。研究表明,硅酮类根管封闭剂的炎性因子释放量等同于阴性对照组[12],提示其对细胞的增殖、分化无抑制作用,从而不影响ALP活性及矿化能力。Leonardo等[23]对实验犬的32个牙根进行根备,用SBS和牙胶热垂直加压充填,90 d后观察到43.8%的实验牙根尖有矿化组织形成,56.2%的实验牙根尖部分闭合,结缔组织正常,牙周膜正常或轻微改变,无牙骨质或骨组织吸收。SBS良好的生物相容性是hPDLCs矿化潜能实现的基础,有利于根尖周组织的修复再生。
本体外研究结果表明:ZOE显著抑制hPDLCs细胞增殖,且影响持续。ERS固化早期抑制细胞增殖,并可能影响hPDLCs的分化及矿化潜能。SBS固化后不抑制hPDLCs细胞增殖、分化及矿化潜能,与ZOE和ERS相比具有更好的生物相容性,全面的评价还有待体内实验的进一步研究。本研究提示在根管充填选择根管封闭剂时,不仅要考虑材料的封闭性能,还要考虑到不同种类的材料对根尖周组织生物活性的影响,尤其是对于有根尖病变的病例。
[1]Dahl JE. Toxicity of endodontic filling materials[J]. Endodontic Topics, 2005, 12: 39-43.
[2]张凤秋,孟焕新,韩劼,等.釉基质蛋白对人牙周膜细胞生物学影响的体外研究[J]. 北京大学学报:医学版, 2012, 44(1): 6-10.
[3]Silva EJ, Santos CC, Zaia AA. Long-term cytotoxic effects of contemporary root canal sealers[J]. J Appl Oral Sci, 2013, 21(1):43-47.
[4]Camargo CH.Setting time affectsinvitrobiological properties of root canal sealers[J]. J Endod, 2014, 40(4): 530-533.
[5]Azadi N, Fallahdoost A, Mehrvarzfar P, et al. A four-week solubility assessment of AH-26 and four new root canal sealers[J]. Dent Res J (Isfahan), 2012, 9(1): 31-35.
[6]An S, Gao Y, Huang X, et al. A comparative study of the proli-feration and osteogenic differentiation of human periodontal ligament cells cultured on β-TCP ceramics and demineralized bone matrix with or without osteogenic inducersinvitro[J]. Int J Mol Med, 2015, 35(5): 1341-1346.
[7]Acil Y, Yang F, Gulses A, et al.Isolation, characterization and investigation of differentiation potential of human periodontal ligament cells and dental follicle progenitor cells and their response to BMP-7invitro[J]. Odontology, 2016, 104(2): 123-135.
[8]Scelza MZ, Linhares AB. A multiparametric assay to compare the cytotoxicity of endodontic sealers with primary human osteoblasts[J]. Int Endod J, 2012, 45(1): 12-18.
[9]陈耀忠,陈建明,刘根娣,等.四种根管封闭剂的体外抑菌性能[J]. 中国组织工程研究, 2012, 16(51): 9551-9557.
[10]Scelza MZ, Coil J, Alves GG. Effect of time of extraction on the biocompatibility of endodontic sealers with primary human fibroblasts[J]. Braz Oral Res, 2012, 26(5): 424-430.
[11]Eldeniz AU,Mustafa K,Dahl JE. Cytotoxicity of new resin, cal-cium hydroxide and silicone-based root canal sealers on fibroblasts derived from human gingiva and L929 cell lines[J]. Int Endod J, 2007, 40(5): 329-337.
[12]孙燕,樊明文,李宇红,等. 新型根管封闭剂对MC3T3-E1成骨细胞的细胞毒性评估[J]. 口腔医学研究, 2011, 27(9): 775-777.
[13]马忠雄,雷丽珊,王燕煌,等. GuttaFlow根管充填材料对人牙周膜成纤维细胞的毒性[J]. 牙体牙髓牙周病学杂志, 2012,22(8): 453-456.
[14]Accardo C, Himel VT, Lallier TE. A novel GuttaFlow sealer supports cell survival and attachment[J]. J Endod, 2014, 40(2):231-234.
[15]Al-Awadhi S, Spears R, Gutmann JL, et al. Cultured primary osteoblast viability and apoptosis in the presence of root canal sea-lers[J]. J Endod, 2004, 30(7): 527-533.
[16]Rodrigues C, Costa-Rodrigues J, Capelas JA, et al. Long-term dose- and time-dependent effects of endodontic sealers in human inose:a osteoclastogenesis[J]. J Endod, 2013, 39(6): 833-838.
[17]Bryan TE, Khechen K, Brackett MG, et al.Invitroosteogenic potential of an experimental calcium silicate-based root canal sealer[J]. J Endod, 2010, 36(7): 1163-1169.
[18]孙卫斌,吴亚菲,丁一,等. 纳米羟基磷灰石诱导人牙周膜细胞碱性磷酸酶表达的研究[J]. 中华口腔医学杂志, 2006,41(6): 348-349.
[19]Gulec M, Gurel A,Armutcu F. Vitamin E protects against oxidative damage caused by formaldehyde in the liver and plasma of rats[J]. Mol Cell Biochem, 2006, 290(3): 61-67.
[20]Huang FM, Yang SF, Chang YC. Effects of root canal sealers on alkaline phosphatase in human osteoblastic cells[J]. J Endod, 2010, 36(7): 1230-1233.
[21]Kim YL. The antioxidant property of pachymic acid improves bone disturbance against AH plus-induced inflammation in MC-3T3 E1 cells[J]. J Endod, 2013, 39(4): 461-466.
[22]洪弘,郑金绚,卢新华,等.牙周膜相关蛋白1在人牙周膜细胞成骨分化过程中的表达[J]. 中华口腔医学研究杂志:电子版, 2013, 7(6): 453-459.
[23]Leonardo MR. A comparison study of periapical repair in dog’s teeth using roekoseal and AH plus root canal sealers:a histopathological evaluation[J]. J Endod, 2008, 34(7): 822-825.
[24]Sari SD. Radiographic evaluation of periapical healing of permanent teeth with periapical lesions after extrusion of AH plus sealer[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2007, 3(104): e54-e59.
(2014-12-01收稿)
(本文编辑:刘淑萍)
Effect of root canal sealers on biocompatibility of human periodontal ligament cells
HU Jia1,2,ZOU Xiao-ying1,ZHUANG Heng1△,GAO Xue-jun1
(1. Department of Cariology and Endodontology, Peking University School and Hospital of Stomatology & National Enginee-ring Laboratory for Digital and Material Technology of Stomatology & Beijing Key Laboratory of Digital Stomatology, Beijing 100081, China; 2. School of Stomatology,Fujian Medical University,Fuzhou 350002, China)
Objective:To compare the effects of three root canal sealers with respect to time on biocompatibility of human periodontal ligament cells (hPDLCs).The sealers included zinc oxide and eugenol based sealers (ZOE), epoxy resin sealers (ERS) and silicone based sealers (SBS). Methods: hPDLCs were primarily cultured,with the method combining of tissue explant and enzymatic digestion. The cells were then exposed to different extract fluids:(1)ZOE extracted for 24 h group ;(2)ZOE extracted for 1 week group;(3)ZOE extracted for 2 weeks group;(4)ERS extracted after 24 h group;(5)ERS extracted after 1 week group;(6)ERS extracted after 2 weeks group;(7)SBS extracted after 24 h group;(8)SBS extracted after 1 week group;(9)SBS extracted after 2 weeks group;(10)Dulbecco modified Eagle’s medium/F12(DMEM/F12)as negative control group. Cell morphology was observed under an inverted microscope.Cell proliferation was measured by methyl-thiazol-diphenyltetrazolium (MTT)assay.ALP assay kit was used for measuring alkaline phosphatase (ALP) activity. Sealers of 2 weeks’ setting time were then immersed in an osteogenic medium for examination of mineral nodules and calcium deposits. Results: Considering the relative growth rate(RGR),ZOE was severely to moderately cytotoxic(RGR:13.6%-39.9%),while ERS was slightly or not cytotoxic (RGR: 87.6%-95.3%).Only SBS did not show any cytotoxicity after setting (RGR: 91.8%-106.7%). The setting time influenced the cytotoxicity of ERS which decreased after 1 week. Considering the ALP activity,there was no difference between SBS group and control group(F=3.397,P=0.053). According to the results of calcium deposits, ZOE:D562 nm= 0.180±0.050,ERS:D562 nm= 2.968±0.201,SBS:D562 nm= 3.623±0.039,Control:D562 nm= 3.477±0.102,the ranking of ALP activity and calcium deposits was as follows: ZOE Root canal sealer; Periodontal ligament; Cells, cultured; Cell proliferation; Tooth remineralization 时间:2016-05-12 13:41:03 http://www.cnki.net/kcms/detail/11.4691.R.20160512.1341.042.html R783.1 A 1671-167X(2016)05-0871-07 10.3969/j.issn.1671-167X.2016.05.023 △Corresponding author’s e-mail, doctorzhuang@163.com
