不同浓度雷公藤甲素肝损伤大鼠模型初步研究
2016-11-22张亚敏林文津徐小妹徐榕青于虹敏
张亚敏 林文津 徐小妹 徐榕青 于虹敏
福建省医学科学研究院福建省医学测试重点实验室,福建福州350001
不同浓度雷公藤甲素肝损伤大鼠模型初步研究
张亚敏 林文津 徐小妹 徐榕青 于虹敏
福建省医学科学研究院福建省医学测试重点实验室,福建福州350001
目的建立不同浓度雷公藤甲素肝损伤大鼠模型,为雷公藤谱毒相关性研究奠定实验基础。方法以SD大鼠为实验动物,尾静脉注射给药,优选给药剂量、取血时间,以大鼠血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)为检测指标,同时观察大鼠肝脏病理变化。结果与空白对照组比较,尾静脉给药12 h后低、中、高三个剂量组(700、1000、1300μg/kg雷公藤甲素)大鼠血清ALT、AST水平均显著增高(P约0.01),且大鼠肝脏均出现不同程度的肝损伤,呈现剂量依赖性。结论采用大鼠尾静脉注射700、1000、1300μg/kg雷公藤甲素可以建立不同程度肝损伤大鼠模型。
雷公藤甲素;肝损伤;丙氨酸氨基转移酶;天门冬氨酸氨基转移酶;大鼠模型
雷公藤引起的毒性反应事件频繁报道,成为近半个世纪以来发生中毒事件最多的中草药之一,其毒性在传统中草药中排第三,毒副作用发生率高达58.1%[1]。雷公藤甲素既是雷公藤中活性最高的环氧二萜内酯化合物,同时也是引起毒副作用的主要成分[2-13]。肝脏是雷公藤甲素毒性作用最重要的靶器官之一[14-15]。建立雷公藤早期预警机制对及时调整给药剂量(包括停药)、防止肝损伤的进一步恶化、实现雷公藤的安全用药具有十分重要的意义[7-8]。本课题组目前已分别尝试建立三维毛细管电泳指纹图谱、双向蛋白电泳指纹图谱等与雷公藤肝损害的相关性,以期实现雷公藤肝肾毒性的早期预警。在雷公藤肝损害的谱毒相关性研究中,如何建立不同程度肝损害动物模型,是保证研究取得预期成果的关键[16-20]。本试验研究不同给药剂量雷公藤大鼠肝毒性,以建立不同程度肝损害动物模型,为雷公藤谱毒相关性研究奠定实验基础。
1 材料与方法
1.1 试验动物
SD大鼠(本实验动物研究遵循福建省医学科学研究院所制订的有关实验动物保护和使用的指南,并经实验动物伦理委员会批准),雌雄各半,体重180耀220g(1.3个月龄),由福建省医学科学研究院动物实验室提供,动物合格证号院SYXK(闽)2011-002。保持室温25益,每天保证12h光照,空气流通,相对湿度维持在40%耀50%之间。
1.2 试验药物
本实验中使用的药物雷公藤甲素购自中国食品药品检定研究院,批号院1566-200201。1,2-丙二醇,氯化钠,均为分析纯级,实验用水均为超纯水。
1.3 主要仪器
AL204型电子分析天平(梅特勒-托利多仪器(上海)有限公司);TGL-16G型高速离心机(上海博通公司);5L/H50w型超纯水机(Aquapr艾科浦);KQ2200E型超声波清洗机(昆山市超声仪器有限公司);酶标仪(上海博通公司)。
1.4 药液的制备
精密称取雷公藤甲素对照品0.0100 g,置于50mL烧杯中,加入20 m L的1,2-丙二醇溶液,在热水浴中超声溶解30 min,然后,转移到100 mL的容量瓶中,用0.9%的生理盐水定容至刻度,摇匀,制成每1 mL含100μg甲素的溶液,备用,即为雷公藤甲素注射液。高剂量组、中剂量组、低剂量组注射用药液均通过此溶液稀释一定的倍数得到。以20%的1,2-丙二醇作为稀释溶液。空白对照组为20%的1,2-丙二醇的氯化钠溶液。
1.5 给药方法
采用尾静脉注射给药的方法,先将大鼠固定在固定器内,让其尾巴完全暴露在外,注射前需用75%乙醇轻轻地将尾部擦拭均匀,使得大鼠尾部的血管扩张,选取大鼠尾部两侧的静脉进行尾静脉注射,给药前先禁食一晚,给药后大鼠自由饮水,进食。
1.6 采样方法
采用眼球后静脉丛取血的方法取血,取血前需用乙醚先进行麻醉,注意每次取血量不多于1mL。
1.7 观测指标
观察给药前后大鼠的摄食量、大便、小便、行为、皮毛等的变化。动物处死后还需进行解剖,观察其肝脏的变化。测定大鼠血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)的含量。
1.8 最佳采样时间的选择
随机抽取SD大鼠3只,尾静脉注射给药,给药剂量为600μg/kg。分别于给药前及给药后4、8、12、24、28、32、36 h进行眼眶采血,采血量约为0.5 mL,4000 r/min离心10 min(离心半径6 cm),得到血清,置于4益冰箱保存,测定大鼠血清中ALT、AST含量,结果显示在12 h左右大鼠ALT、AST达到最大值,故选取第12小时作为采样时间。
1.9 最佳给药剂量的选择
将体重180耀220 g的SD大鼠随机分为9组,分别注射雷公藤甲素700、800、900、1000、1100、1200、1300、1400、1600μg/kg。于注射前和注射后12 h采样,观察注射后SD大鼠的死亡情况。结果发现,1600μg/kg剂量组SD大鼠在给药后36 h内死亡,1400μg/kg剂量组SD大鼠在给药后48 h内死亡,其他剂量组未有大鼠死亡,所以给药剂量应选择低于1400μg/kg的给药剂量。选定1300μg/kg作为高剂量组给药剂量。
1.10 不同给药剂量雷公藤甲素SD大鼠肝毒性
将体重180耀220 g的SD大鼠随机分为4组,除一组作为空白对照组外,低、中、高三个剂量组分别注射雷公藤甲素700、1000、1300μg/kg。于注射前和注射后12 h采样,观察SD大鼠活动情况,测定血清中ALT、AST的水平,大鼠肝脏采用4%多聚甲醛固定,脱水、浸蜡包埋后切片,贴于载玻片上,用二甲苯梯度脱蜡,苏木精-伊红(hematoxylin-eosin,HE)染色,在200倍光学显微镜下观察。
1.11 统计学方法
采用统计学软件SPSS 22.0对试验结果进行统计分析,计量资料数据以均数依标准差(x±s)表示,采用单因素方差分析,组间两两比较采用LSD-t检验,以P约0.05为差异有统计学意义。
2 结果
2.1 大鼠的一般状态
高、中、低剂量三个剂量组给药后的大鼠均出现活动减少、反应迟钝、被毛无光泽、轻微掉毛等现象,高剂量组尤为明显,所有的SD大鼠基本拒食。高、中、低三个剂量组的大鼠均有棕色便腹泻的情况,高剂量组大鼠腹泻等毒性症状则更为明显。
2.2 不同剂量组大鼠ALT、AST水平比较
与空白对照组比较,大鼠尾静脉给药700、1000、1300μg/kg雷公藤甲素12 h后,高、中、低剂量组大鼠血清中ALT、AST水平均显著增高,差异均有高度统计学意义(均P约0.01)。见表1。

表1 不同剂量组大鼠ALT、AST水平比较(U/L,x±s)
2.3 大鼠肝脏病理切片光镜观察
从SD大鼠肝脏病理切片的观察中发现,低剂量组肝细胞发生了轻度退变,肝血窦轻度扩张;中剂量组大鼠中央静脉周围肝细胞轻度退变,肝血窦轻度扩张,汇管区扩大,小胆管增生,少量慢性炎症细胞浸润,胆管增生;高剂量组大鼠的中央静脉周围肝细胞轻度退变,肝血窦轻度扩张,近中央静脉周围肝细胞轻度退变,中央静脉瘀血,周边肝细胞轻度退变,汇管区轻度扩大,少量慢性炎症细胞浸润。见图1。
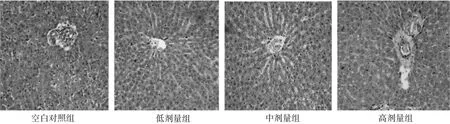
图1 不同剂量组大鼠肝脏病理切片光镜观察(HE染色,200伊)
3 讨论
本研究发现高、中、低剂量组SD大鼠血清中ALT、AST两个生化指标在注射雷公藤甲素后有较大增高,ALT、AST的相对变化量与空白对照组有显著差异。当注射剂量超过一定浓度,ALT和AST的增高值随着给药剂量的增大而增加,呈现剂量依赖性,超过1400μg/kg大鼠将出现死亡。故要想制备不同程度肝损害动物模型,一定要控制好给药剂量这个关键因素。
目前临床上使用的雷公藤制剂为雷公藤多苷片[21]和雷公藤内酯软膏,还没有雷公藤甲素注射液制剂,所以在试验剂量的选择上,本研究主要参考文献[8]的给药剂量。实验过程中还研究了200、300μg/kg等多个剂量组的生化指标在给药前后的变化,结果显示只有当雷公藤甲素的浓度达到一定浓度后,才引起ALT、AST升高,超过一定剂量后大鼠死亡,这与雷公藤甲素的治疗窗较窄相一致。
本研究发现不同的大鼠对雷公藤甲素的敏感性不同,临床使用时由于患者个体差异较大,可以考虑应用个体化给药方案来降低雷公藤甲素在临床应用中的毒性,本研究所建立的不同剂量雷公藤甲素肝毒性大鼠模型为下一步开展雷公藤谱毒相关性研究奠定了实验基础。
[1]任春晓.雷公藤的药理基础及其制剂的研究进展[J].黑龙江医药,2010,23(2):160-162.
[2]MaJ,DeyM,YangH.Anti-inflammstoryandimmunosuppressive compounds from Tripteryium wilfordii[J].Phytochenistry,2007,68(8):1172-1178.
[3]Brinker AM,Ma J,lipsky PE,et al.Medic inal chemistry and pharmacology of genus Tripterygium(celastraceae)[J]. phytochemistry,2007,68(6):732-766.
[4]Liu CF,Lin N.Progress in research on mechanisms of anti-rheumatoid arthritis of triptiolide[J].Zhongguo Zhongyao Za Zhi,2006,31(19):1575-1579.
[5]刘建群,张维,高书亮,等.凤尾草对雷公藤甲素致小鼠肝损伤的保护作用研究[J].中国药房,2010,21(43):4033-4035.
[6]言枫,陈昊,顾一煌.电针足三里对雷公藤甲素致大鼠急性肝损伤的保护作用及其机制研究[J].四川中医,2014,32(8):64-66.
[7]黄敏聪,潘伟,卢觅佳,等.雷公藤甲素对BRL大鼠肝细胞增殖和凋亡的影响[J].上海中医药杂志,2015,49(4):87-90.
[8]丁虹,吴建元,童静,等.雷公藤甲素急性毒性及其机制研究[J].中药材,2004,27(2):115-118.
[9]赵庆华,李晓宇,冯群,等.基于剂量的雷公藤抗小鼠免疫性炎症野效-毒冶关联性评价[J].中国中药杂志,2015,40(6):1139-1143.
[10]林君容,林兵,宋洪涛.雷公藤甲素与雷公藤红素的体内药动学研究进展[J].中草药,2016,47(3):528-532.
[11]许永亮.雷公藤甲素抗生育作用研究进展[J].海峡药学,2015,27(11):11-13.
[12]刘泽洲,许可嘉,张天娇,等.雷公藤甲素诱导小鼠急性肝损伤的形态学研究[J].现代生物医学进展,2015,15(17):3207-3211.
[13]程鉥泺,言枫,顾一煌.不同电针刺激量对雷公藤甲素致大鼠急性肝损伤作用观察[J].辽宁中医药大学学报,2015,17(12):23-25.
[14]翟边.武汉科学家首次发现雷公藤有望成为抗癌新药[J].中国制药信息,2006,22(9):15.
[15]孙小霞,张冰,林志健,等.近年医保目录含毒性药材中药制剂的药物警戒思考[J].实用药物与临床,2016,19(2):251-256.
[16]禄保平,苗明三,杨晓娜.应用雷公藤多苷灌胃建立小鼠急性肝损伤模型的研究[J].中药药理与临床,2007,23(2):75-77.
[17]王桂玲,任春娥,王丽.雷公藤多甙对雌性大鼠不良反应的实验研究[J].河北医药,2009,31(4):416-418.
[18]褚克丹,李煌,徐伟,等.HPLC法测定雷公藤内酯醇和内酯酮的含量[J].福建中医药大学学报,2011,21(5):27-29.
[19]库尔班江,赛得合买提,张焱,等.雷公藤药材高效液相色谱指纹图谱研究[J].喀什师范学院学报,2009,30(3):48-52.
[20]黄金盈.雷公藤提取物的肝毒性试验[J].世界最新医学信息文摘,2016,16(26):165-166.
[21]符兰芳,蒙绪标,熊青,等.免疫抑制剂联合抗甲状腺药物对Graves病患者的临床疗效及血清炎症因子的影响[J].中国医药导报,2015,12(34):122-125.
Primary study of rat models w ith liver in jury established by different concentrations of triptolide
ZHANG Yamin LINWenjin XU Xiaomei XU Rongqing YU Hongmin
Fujian Academy of Medical Sciences Fujian Key Laboratory of Medical Measurement,Fujian Province,Fuzhou 350001,China
Ob jective To establish ratmodels with liver injury by different concentrations of triptolide,so as to lay the foundation for the relevant researches of spectrum poison of Tripterygium wilfordii.Methods SD ratswere taken as ex-perimental animals and injected via tail vein,the dosage of administration and time of collecting blood were taken opti-mization.The serum alanine aminotransferase(ALT),aspartate aminotransferase(AST)in ratswere taken as testing in-dexes,and the liver pathologic changes in rats were observed at the same time.Results Compared with blank control group,the levels of serum ALT,AST in rats of low,medium and high dose group(700,1000,1300μg/kg of triptolide) after administration for 12 hours via tail vein were significantly increased(P约0.01),and all the rats liver showed dif-ferent degrees of injury,at a dose-dependentmanner.Conclusion Injection of 700,1000,1300μg/kg of triptolide via tail vein can establish ratmodelswith different degrees of liver injury.
Triptolide;Liver injury;Alanine aminotransferase;Aspartate aminotransferase;Ratmodels
R285.5
A
1673-7210(2016)07(a)-0007-03
院2016-03-06本文编辑院张瑜杰)
福建省自然科学基金资助项目(2014J01296)。
