单色多重荧光实时定量PCR测定端粒长度
2016-11-22仲韵
仲韵
南京医科大学附属淮安第一医院老年科,江苏淮安223300
单色多重荧光实时定量PCR测定端粒长度
仲韵
南京医科大学附属淮安第一医院老年科,江苏淮安223300
目的在罗氏LightCycler 480上建立单色多重荧光实时定量聚合酶链反应(MMQPCR)方法测定端粒长度。方法在罗氏480定量PCR仪上使用MMQPCR方法测定39例人外周血白细胞端粒长度(相对T/S比值),并与DNA印迹法(Southern blot)测得的平均末端限制性片段(TRF)长度作比较。结果MMQPCR方法测定端粒长度相对T/S比值为1.13依0.21,Southern blot方法测量平均TRF长度为(7.46依1.21)kb,两种方法测定结果的相关性分析R2=0.6706(P<0.001)。结论本研究建立的MMQPCR方法测定端粒长度重复性好、省时、简便、可靠,可高通量处理大量样品。
端粒长度;多重定量PCR;T/S比值;末端限制性片段
有研究表明,端粒长度是生物学老化的标志[1],端粒缩短被认为与多种心脑血管病的发生及进展有关[2-5]。端粒长度的测定方法最早由Harley等[6]在1990年提出,即通过Southern blot测定末端限制性片段(TRF)的长度,该方法虽然过程繁琐,所需DNA量大,但至今仍是端粒长度测量方法的野金标准冶。随后人们提出了定量荧光原位杂交(Q-FISH)[7]和建立流式荧光原位杂交(Flow-FISH)[8](流式荧光原位杂交)。2002年,Cawthon[9]首创了荧光定量PCR测定端粒相对长度的方法,即通过计算端粒拷贝数(T)与单拷贝基因拷贝数(S)的比值T/S来反映平均端粒长度,但该方法中端粒DNA和单拷贝基因的扩增是在不同的反应管中进行,使得模板起始量的不同对结果的变异产生重要影响,为解决这一问题,2009年,Cawthon[9]还提出了单色多重定量PCR方法(MMQPCR)[10]。该方法对荧光定量PCR仪有一定要求,即能够在一个循环中两次收集SYBR Green荧光信号,而国内外实验室使用较多的ABI系列如7900HT、7700等无此功能。因此,目前研究者仍普遍采用Cawthon[11]于2002年提出的定量PCR方法测定端粒长度。罗氏480(LightCycler480)荧光实时定量PCR仪被广泛应用于诊断和研究,但文献中较少见到其被用于测定端粒长度[11-13],本文参照Cawthon[9]2009提出的MMQPCR,优化实验中的参数,阐述在罗氏480实时定量PCR仪上建立MMQPCR的过程,并与传统的Southern b lot方法测量平均TRF长度作相关性分析。
1 材料与方法
1.1 材料
实验标本选自2013年11月1~30日南京医科大学附属淮安第一医院(以下简称野我院冶)检验科体检者的肘静脉新鲜EDTA抗凝血2 mL,共40例,其中男19例,女21例,年龄38~79岁,平均(61.46依11.58)岁。本研究获得我院医学伦理委员会审查通过,所有入选者均签署知情同意书。
1.2 方法
1.2.1 单色多重荧光实时定量PCR测定端粒长度使用富士核酸提取系统提取基因组DNA,操作严格按照说明书进行。微量紫外分光光度计测DNA的浓度与纯度,OD260/280为1.7~1.9为合格,记录DNA的浓度。使用TB缓冲液将待测样本DNA浓度稀释至7 ng/滋L,任意选取一样本作为标准品,使用Milli-Q超纯水按1︰2.5的比例将标准品DNA浓度依次等比稀释为45、18、7.2、2.88、1.152 ng/滋L,并放于-20益冰箱保存备用。端粒长度的测定参照Cawthon2009年提出的MMQPCR[7]。反应使用的引物由英潍捷基(上海)贸易有限公司合成,序列如下院telg 5忆-ACAC-TAAGGTTTGGGTTTGGGTTTGGGTTTGGGTTAGTGT-3忆;telc 5忆-TGTTAGGTATCCCTATCCCTATCCCTATC-CCTATCCCTAACA-3忆;hbgu 5忆-CGGCGGCGGGCG-GCGCGGGCTGGGCGGCTTCATCCACGTTCACCTTG-3忆;hbgd 5忆-GCCCGGCCCGCCGCGCCCGTCCCGCCG-GAGGAGAAGTCTGCCGTT-3忆。反应体系院SYBR Green玉Master(罗氏公司)7.5滋L,样本DNA 5滋L(待测样本DNA含量为35 ng,标准品含量依次为225、90、36、14.4、5.76 ng),端粒引物telg、telc终浓度均为500 nmol/L;单拷贝基因引物HBGU、HBGD终浓度均为200 nmol/L。反应在同一块384孔板上进行,标准品和待测样本均设置3复孔,另外设置以相同体积的超纯水作为DNA的阴性对照,亦为3个复孔。使用仪器为LightCycler 480实时荧光定量PCR仪(罗氏公司)。反应条件为玉院95益15 min;域院94益15 s,49益15 s,2个循环;芋院94益15 s,62益10 s,74益15 s,84益10 s,85益15 s,38个循环。反应结束后建立熔解曲线。从LightCycler480v1.5拷出原始数据,使用软件野Conversion from LightCycler480 to Lin-RegPCR冶将其转换并导入LinRegPCR(v12.15)软件进行分析。
1.2.2 Southe rn b l o t测量平均TRF长度实验前进行琼脂糖凝胶电泳检验待测DNA的完整性,使用罗氏试剂盒TeloTAGGG Telomere Length Assay(罗氏公司)完成平均TRF的测定,琼脂糖、尼龙膜亦购于该公司,实验参照试剂盒提供的步骤进行。具体为院限制性内切酶Hinf I和Rsa I酶切基因组DNA(1.2μg,包括试剂盒提供的对照DNA)2 h,将酶切DNA连同地高辛标记的marker放于0.8%琼脂糖凝胶中以5V/cm的电压电泳10 cm,使用毛细管转移法将DNA转移至带正电荷尼龙膜上,120益烘烤30 min,使用试剂盒提供的杂交液42益预杂交1 h后,用地高辛标记的端粒探针42益杂交3 h,洗膜后,加入显影底液,并将尼龙膜放入LAS-4000数字成像系统中进行连续曝光,曝光时间15~20min,选择曝光强度最适宜的一张照片进行TRF长度测定。使用图像处理软件Image J(v1.44p),根据公式TRF=移(ODi)/移(ODi/Li)计算平均TRF长度。其中,ODi表示位置i的光密度值,Li表示位置i的marker长度,不同批次的结果根据control DNA进行校正。
1.3 观察指标
淤观察PCR产物的熔解曲线、端粒与单拷贝基因的标准曲线;于观察T/S比值的重复性,计算批内变异系数及批间变异系数;盂分析T/S比值与平均TRF长度的相关性。
2 结果
2.1 熔解曲线、标准曲线及相对T/S比值的计算
PCR产物的熔解曲线如图1所示,熔解曲线为两个完全分开的双峰,Tm值分别为78益和91益,分别为端粒扩增产物和单拷贝基因扩增产物。分别计算各个浓度标准品端粒和单拷贝基因的平均Ct值,并以DNA含量的对数值log[DNA]作横坐标,以Ct值作纵坐标,在Microsoft Excel中绘制端粒和单拷贝基因的标准曲线,得出R2值和公式(图2)。从图中可以看出,端粒和单拷贝基因的标准曲线R2均>0.99,且两条标准曲线几乎平行,说明端粒和单拷贝基因扩增效率相近,提示在225~5.76 ng范围内,使用该标准曲线计算待测样本的端粒长度可靠。将各个待测样本的原始Ct值代入公式,进行幂转换,得到每个待测样本相对于标准品的端粒的纳克数(T)和单拷贝基因的纳克数(S),最后计算3个复孔T/S比值的平均值,即得到每个待测样本相对于标准品的T/S比值。

图1 PCR产物熔解曲线

图2 端粒和单拷贝基因的标准曲线
2.2 T/S比值的重复性检验
计算每个待测样本3个复孔T/S比值的变异系数,然后计算39个样本变异系数的几何均数,得出批内变异系数为2.9%。为了检验该MMQPCR方法的批间重复性,同样的39个样本于第2天进行重复测量,仍为3个复孔,且保证每个样本在384孔板上的位置与前一次不同,以减少位置效应。两次独立实验各个样本T/S均值的相关性见图3,可以发现线性回归线的斜率接近于1,且在Y轴上的截距接近于零。计算两次实验每对样本T/S比值的变异系数,最后求得39对样本变异系数的几何均数,即批间变异系数为3.4%。

图3 相同样本两次实验所得T/S均值的相关性
2.3 T/S比值与平均TRF长度的相关性分析
计算39个样本DNA的平均T/S比值为1.13依0.21,平均TRF长度为(7.46依1.21)kb,从图4可以看出两种不同方法测得的结果存在明显相关性(R2= 0.6706,P<0.001)。
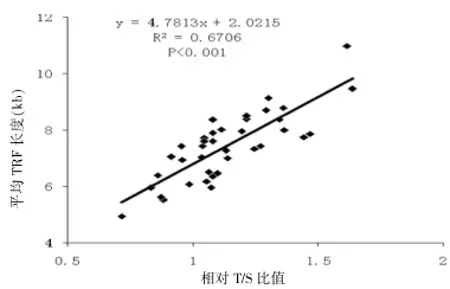
图4 相对T/S比值与平均TRF长度的相关性
3 讨论
MMQPCR将端粒和单拷贝基因置于同一个反应管中扩增,利用端粒和单拷贝基因丰度和产物Tm值的差异,使用SYBR Green染料在一个循环中顺序收集端粒荧光信号和单拷贝基因荧光信号。该方法与传统多重PCR不同的是两个目标基因的扩增并不是同时进行。端粒首先扩增并在74益收集信号,由于端粒的丰度远比单拷贝基因高,此时单拷贝基因的Ct值仍在基线水平以下,因此74益的Ct值仅代表端粒。温度继续升高到85益,因为此时端粒产物已完全解链,释放DNA聚合酶用于单拷贝基因的扩增,由于单拷贝基因引物5忆端被加了野GC钳冶,提高了退火温度,使其在85益仍能扩增,因此此时收集的荧光仅代表单拷贝基因产物。该方法与之前的PCR方法比较,试剂和模板用量以及时间均减少了一半,更为重要的是消除了模板起始量不同对结果产生的影响,减少了批内误差。
扩增效率是影响定量PCR可靠性的最重要因素[14],由于实时定量PCR通过Ct值来计算模板的起始量,因此所有样本的扩增效率一致显得很重要。端粒的定量PCR利用两个基因的扩增来计算端粒长度,其中任何一个都有可能存在效率误差,因而对效率误差尤为敏感。有文献报道了端粒定量PCR可接受的效率范围为95%~103%[16],但这个范围只是象征性的,如果所有的样本的扩增效率一致,具体的数值并不重要,80%和100%一样可靠,因为导致效率误差的是样本之间扩增效率的差别[15]。另一个与扩增效率有关的问题与标准品有关。端粒定量PCR通过外部标准曲线法计算端粒长度,一般来说应使用任一个待测样本,或多个样本的混合作为标准品。因为在血样本的保存及DNA的提取过程中有很多化学物质可抑制PCR反应,如乙醇、酚、EDTA等[17],而标准品与待测样本来源相同可以控制抑制因子对PCR的影响,从而减少标准品与待测样本之间的效率误差[15]。相反,使用购买的高度纯化的标准品[18]和来自细胞系的标准品[19-20]则不能消除抑制因子的影响。
本实验在罗氏LightCycler480荧光定量PCR仪上进行端粒与单拷贝基因的扩增,利用LinRegPCR软件进行数据分析,解决了仪器自带软件无法分析数据的问题,从而拓宽了MMQPCR方法测定端粒长度的应用范围。与传统的Southern blot方法比较,MMQPCR方法具有省时、简便的特点,可高通量处理大量样品。
[1]von ZglinickiT,Martin-Ruiz CM.Telomeres as biomarkers for ageing and age-related diseases[J].CurrMolMed,2005,5(2):197-203.
[2]Hunt SC,Kimura M,Hopkins PN,et al.Leukocyte telomere length and coronary artery calcium[J].Am J Cardiol,2015,116(2):214-218.
[3]De Vusser K,Pieters N,Janssen B,et al.Telomere length,cardiovascular risk and arteriosclerosis in human kidneys院an observational cohort study[J].Aging,2015,7(10):766-775.
[4]Ding H,Chen C,Shaffer JR,et al.Telomere length and risk of stroke in Chinese[J].Stroke,2012,43(3):658-663.
[5]Strazhesko I,Tkacheva O,Boytsov S,et al.Association of insulin resistance,arterial stiffness and telomere length in adults free of cardiovascular diseases[J].PLoSOne 2015,10(8):e0136676.
[6]Harley CB,Futcher AB,Greider CW.Telomeres shorten during ageing of human fibroblasts[J].Nature,1990,345(6274):458-460.
[7]Lansdorp PM,Verwoerd NP,van de Rijke FM,et al. Heterogeneity in telomere length of human chromosomes [J].Hum Mol Genet,1996,5(5):685-691.
[8]Baerlocher GM,Vulto I,de Jong G,et al.Flow cytometry and fish to measure the average length of telomeres(flow fish)[J].Nat Protoc,2006,1(5):2365-2376.
[9]Cawthon RM.Telomeremeasurementbyquantitative PCR[J]. Nucleic Acids Res,2002,30(10):e47.
[10]Cawthon RM.Telomere length measurement by a novel monochrome multiplex quantitative PCR method[J]. Nucleic Acids Res,2009,37(3):e21.
[11]Hsieh AYY,Saberi S,Ajaykumar A,et al.Optimization of a relative telomere length assay by monochromatic multiplex real-time quantitative PCR on the LightCycler 480[J].JournalofMolecular Diagnostics Jmd,2016,18(3):425-437.
[12]GilME,Coetzer TL.Real-timequantitative PCR of telomere length[J].Mol Biotechnol,2004,27(2):169-172.
[13]Jodczyk S,Pearson JF,Aitchison A,et al.Telomere length measurement on the Roche LightCycler 480 Platform[J]. Genet Test Mol Biomarkers,2015,19(2):63-68.
[14]Nordgard O,Kvaloy JT,Farmen RK,etal.Error propagation in relative real-time reverse transcription polymerase chain reaction quantificationmodels院the balance between accuracy and precision[J].Anal Biochem,2006,356(2):182-193.
[15]Horn T,Robertson BC,Gemmell NJ.The use of telomere length in ecology and evolutionary biology[J].Heredity(Edinb),2010,105(6):497-506.
[16]Nolan T,Hands RE,Bustin SA.Quantification of mrna using real-time Rt-PCR[J].Nat Protoc,2006,1(3):1559-1582.
[17]Wilson IG.Inhibition and facilitation of nucleic acid amplification[J].Appl Environ Microbiol,1997,63(10):3741-3751.
[18]Martin-Ruiz C,Saretzki G,Petrie J,et al.Stochastic variation in telomere shortening rate causes heterogeneity of human fibroblast replicative life span[J].JBiol Chem,2004,279(17):17826-17833.
[19]Fehrer C,Voglauer R,Wieser M,et al.Techniques in gerontology院cell lines as standards for telomere length and telomeraseactivity assessment[J].Exp Gerontol,2006,41(6):648-651.
[20]GrabowskiP,Hultdin M,Karlsson K,etal.Telomere length as a prognostic parameter in chronic lymphocytic leukemia with special reference to VH gene mutation status[J].Blood,2005,105(12):4807-4812.
Telomere length measurem ent by m onochrom e m ultip lex quantitative PCR m ethod
ZHONG Yun
Department of Geriatrics,Huai忆an First People忆s Hospital,Nanjing Medical University,Jiangsu Province,Huai忆an 223300,China
Ob jective To establish amonochromemultiplex real-time quantitative polymerase chain reaction(MMQPCR), for telomere lengthmeasurementon theRoche LightCycler480(LC480)real-time PCR platform.M ethods Telomere lengths (T/S ratio)weremeasured from 39 DNA samples extracted from human white blood cells using the MMQPCR method on the LC480 platform,and were compared with terminal restriction fragment(TRF)lengthsmeasured by Southern blot. Results Relative T/S ratiomeasured by MMQPCR was 1.13依0.21,and mean TRF length was(7.46依1.21)kb.The cor-relation coefficient(R2)for the relationship of the two differentmethodswas 0.6706(P<0.001).Conclusion The MM-PQPCR method is reproducible,rapid,and simple,thus reliable for a high throughput of samples.
Telomere length;Multiplex quantitative PCR;T/S ratio;Terminal restriction fragment
R34
A
1673-7210(2016)07(a)-0014-04
院2016-03-21本文编辑院任念)
仲韵(1988.10-),女,硕士;研究方向院心脑血管病患者生物标志物研究。
