MIP-1α诱导肺癌脑转移患者CIK细胞跨内皮迁移的研究
2016-11-22皮新苗李泽宇马怡然李东文
皮新苗,李泽宇,马怡然,李东文
(1.辽宁中医药大学研究生学院2013级,沈阳 110847;2.中国医科大学附属第一医院输血科,沈阳 110001;3.中国人民解放军第四六三医院干部病房,沈阳 110042)
·论著·
MIP-1α诱导肺癌脑转移患者CIK细胞跨内皮迁移的研究
皮新苗1,3,李泽宇2,马怡然2,李东文3
(1.辽宁中医药大学研究生学院2013级,沈阳 110847;2.中国医科大学附属第一医院输血科,沈阳 110001;3.中国人民解放军第四六三医院干部病房,沈阳 110042)
目的 检测肺癌脑转移患者和健康人细胞因子诱导的杀伤细胞(CIK细胞)表达MIP-1α的能力,探究MIP-1α诱导肺癌脑转移患者CIK细胞在人脑微血管内皮细胞(HBMEC)中跨内皮迁移作用。方法 培养CIK细胞及HBMEC,RNA干扰和siRNA转染MIP-1α入CIK细胞,通过跨内皮迁移试验和细胞黏附试验,检测MIP-1α的表达,观察转染MIP-1α的CIK细胞穿过血脑屏障能力。结果 MIP-1α在肺癌脑转移患者的CIK细胞中高表达,能诱导肺癌脑转移患者CIK细胞在HBMEC构建的血脑屏障模型中跨内皮细胞迁移。结论 本研究为CIK细胞穿透血脑屏障机制的初步探索,为干预CIK细胞免疫治疗肺癌脑转移瘤提供了新的靶点。
CIK细胞;肺癌;人脑微血管上皮细胞
过继性免疫治疗(adoptive cellular immunotherapy,ACI)是肿瘤免疫治疗的重要手段之一,目前已成为肿瘤治疗研究中一个新的热点[1,2]。细胞因子诱导的杀伤细胞(cytokine-induced killer cell,CIK细胞)免疫治疗是新一代肿瘤ACI方法。CIK细胞免疫治疗通过采集人体外周血T淋巴细胞,经体外扩增后再回输肿瘤患者体内,在治疗各种恶性肿瘤方面有着相当广阔的前景,一般认为中枢神经系统由于血脑屏障的存在而具有免疫豁免性,因而关于CIK细胞治疗肺癌脑转移瘤的实验和临床报道较少。研究[3,4]表明,一些趋化因子如MIP-1α和MCP-1α,在某些病理情况下与T细胞跨内皮转运有关。在成人T淋巴细胞白血病初期,T淋巴细胞也能分泌MIP-1α[5]。而且,之前的研究[3]也表明,阿尔茨海默病患者的外周T淋巴细胞中MIP-1α会过度表达,它能辅助T淋巴细胞迁移入脑。然而DC-CIK细胞穿透血脑屏障的机制尚不明确,所以本研究提出一个假设:MIP-1α可能是肺癌脑转移患者外周血CIK细胞进入中枢神经系统的影响因素。本研究检测了肺癌脑转移患者和健康人CIK细胞表达MIP-1α的能力,并对MIP-1α诱导肺癌脑转移患者CIK细胞在人脑微血管内皮细胞(human brain microvessel endothelial cell,HBMEC)模型中的透过率、迁移能力和细胞黏附力进行分析。
1 材料与方法
1.1 材料
CIK细胞来自中国医科大学附属第一医院招募的志愿者,已签署知情同意书,并获得医院医学伦理委员会同意,HBMEC由中国医科大学细胞生物学实验室提供。10%小牛血清(美国Hyclone公司),RPMI1640培养液(美国Invitrogen公司),MIP-1α siRNA(美国Santa Cruz公司),RNase-free DNaseⅠ(日本TaKaRa生物公司),AMV逆转录酶(美国Promega公司),pGEM T载体(美国Promega公司),荧光染料CM-Dil(Invitrogen公司),Nucleofector转录系统(德国Amaxa公司),Millicell-ERS系统(美国World Precision Instruments公司),PE5700RT-PCR系统(美国Perkin Elmer公司),Transwell(美国Corning Costar公司)。
1.2 方法
1.2.1 CIK细胞及HBMEC培养:分别采集肺癌脑转移患者和健康人外周血,淋巴细胞分离液分离、密度梯度离心获得外周血单个核细胞,于含10%小牛血清的RPMI1640培养液中,在37℃,5%CO2培养箱中培养4 h,收集未贴壁细胞,调整细胞浓度至4× 106/mL,加入IFN-γ(1 000 U/mL),24 h后加入CD3单抗(50 μg/mL)、IL-2(300 U/mL)、IL-1α(100 U/mL),以后每2 d更换新鲜培养基,并补加IL-2(300 U/mL),培养至14 d左右,收获CIK细胞。HBMEC加入含10%小牛血清的RPMI 1640营养液,10%Nuserum,2 mmol/L谷氨酰胺,1 mmol/L丙酮酸钠,非必需氨基酸,MEM维生素,在37℃,5%CO2,95%湿度的细胞培养箱中培养。每2 d更换新鲜培养液,待细胞在培养瓶底面生长至90%左右,用含0.25%胰蛋白酶细胞消化液消化细胞,再加入培养液,吹打成单细胞悬液后,1∶4传代于新的培养瓶中。
1.2.2 RNA干扰和siRNA转染CIK细胞:MIP-1α siRNA一般由3~5个针对目的基因设计使其表达的19~25个核苷酸片段组成。将MIP-1α siRNA利用Nucleofector系统分别电转染到肺癌脑转移患者和健康人CIK细胞,试剂盒设定在D32程序(295 V,1 180 μF和5 000 Ω),一般24 h内完成转染,大约70%的细胞能成功转染。
1.2.3 实时PCR:总RNA经RNase-free DNaseⅠ处理,加入AMV逆转录酶进行逆转录,实时PCR在PE5700RT-PCR系统中执行,MIP-1α扩增条件为94℃2 min,然后94℃15 s,58℃1 min,40个循环;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)扩增条件为95℃15 s,64℃1 min,40个循环;标准曲线用含有MIP-1α pGEM T载体或GAPDH cDNA构建。目标mRNA的起始拷贝数通过标准曲线进行计算。引物和探针见表1。

表1 MIP-1α实时PCR引物和探针Tab.1 MIP-1α primer and probe for real-time PCR
1.2.4 体外血脑屏障模型的建立和内皮渗透性试验:在24孔3 μm孔径的Transwell小室上建立血脑屏障模型,Transwell上室以2×105密度接种HBMEC,将24孔板放于37℃,5%CO2的细胞培养箱中培养4~5 d,Millicell-ERS系统(购自美国World Precision Instruments公司)检测跨内皮电阻,当跨膜电阻TEER值>200 Ω·cm-2时,将小室以无血清RPMI1640培养液洗2次,在上室加入0.5 μmol/L被RPMI1640培养液溶解的辣根过氧化物酶(horse radish peroxidase,HRP),2 h后收集下室培养液,用分光光度计在吸收光为492 nm波长处检测HRP浓度,当下室没有HRP时,此模型可以进行跨内皮迁移实验。
1.2.5 肺癌脑转移患者CIK细胞跨内皮迁移试验:将肺癌脑转移患者CIK细胞(2×105)加入Transwell上室作用20 h,后收集Transwell下室细胞,用细胞计数仪计数细胞穿过率。MIP-1α siRNA处理的肺癌脑转移患者CIK细胞(2×105)加入Transwell上室作用20 h,后收集Transwell下室细胞,用细胞计数仪计数细胞穿过率。
1.2.6 肺癌脑转移患者CIK细胞黏附实验:将HBMEC细胞(2×105)接种于Transwell上,当跨内皮电阻达到200 Ω/cm2以上时,分别将荧光染料CM-Dil标记的肺癌脑转移患者CIK细胞(2×105)、经MIP-1α siRNA处理的肺癌脑转移患者CIK细胞加入上室,在1、2、3、4 h进行测试,用RPMI1640培养液轻柔地洗去未黏附于HBMEC表面的CIK细胞,然后将Transwell膜取出并固定细胞,于荧光显微镜下200倍放大,计数10个随机视野中的CIK细胞。
1.3 统计学处理
2 结果
2.1 肺癌脑转移患者CIK细胞表达MIP-1α的能力
对肺癌脑转移患者和健康人CIK细胞表达MIP-1α的能力进行分析,肺癌脑转移患者CIK细胞表达MIP-1α的能力高于健康人CIK细胞(图1)。
2.2 MIP-1α诱导肺癌脑转移患者CIK细胞的跨内皮迁移
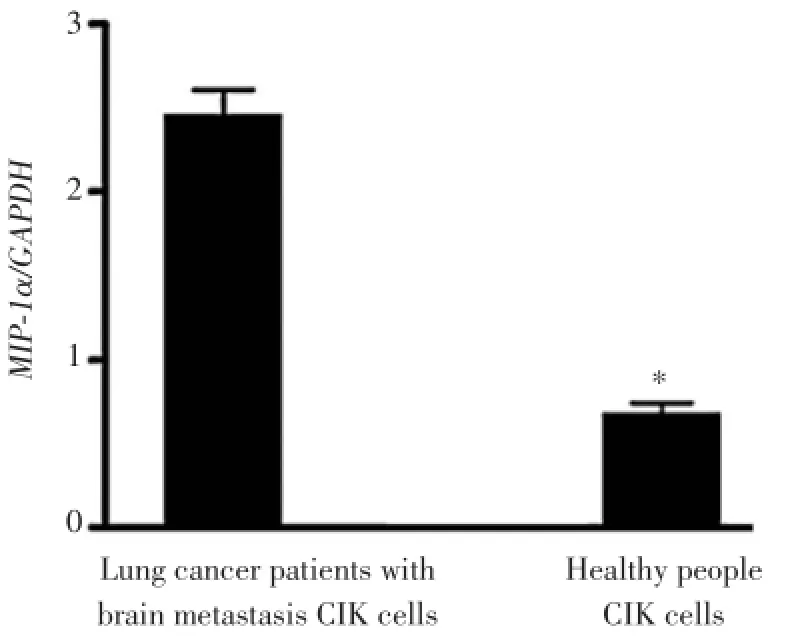
图1 实时RT-PCR检肺癌脑转移患者和健康人CIK细胞表达MIP-1α水平Fig.1 MIP-1αmRNA expression level in CIK cells of lung cancer patients with brain metastasis and healthy individuals RT-PCR
肺癌脑转移患者CIK细胞被MIP-1α siRNA转染后,实时PCR检测显示MIP-1α siRNA组MIP-1α/ GAPDH比值明显低于对照组(图2A,P<0.05)。MIP-1αsiRNA干扰的肺癌脑转移患者CIK细胞和未被干扰的肺癌脑转移患者CIK细胞分别与HBMEC作用20 h后,对穿过HBMEC的细胞数计算表明,MIP-1α siRNA干扰的肺癌脑转移患者CIK细胞的跨内皮细胞穿透率明显低于未被干扰的肺癌脑转移患者CIK细胞(图2B,P<0.01)。肺癌脑转移患者CIK细胞和经MIP-1α siRNA干扰的肺癌脑转移患者CIK细胞与HBMEC单层作用20 h,检测跨内皮细胞电阻TEER值和Transwell下室HRP浓度发现,经MIP-1α siRNA干扰后的肺癌脑转移患者CIK细胞的HBMEC跨内皮电阻TEER值显著高于未被干扰的肺癌脑转移患者CIK细胞(图2C,P<0.05),经MIP-1α siRNA干扰后的肺癌脑转移患者CIK细胞HRP渗透力显著低于未被干扰的肺癌脑转移患者CIK细胞(图2D,P<0.05)。MIP-1α siRNA能阻断肺癌脑转移患者CIK细胞的跨内皮迁移,MIP-1α能诱导肺癌脑转移患者CIK细胞的跨内皮迁移。
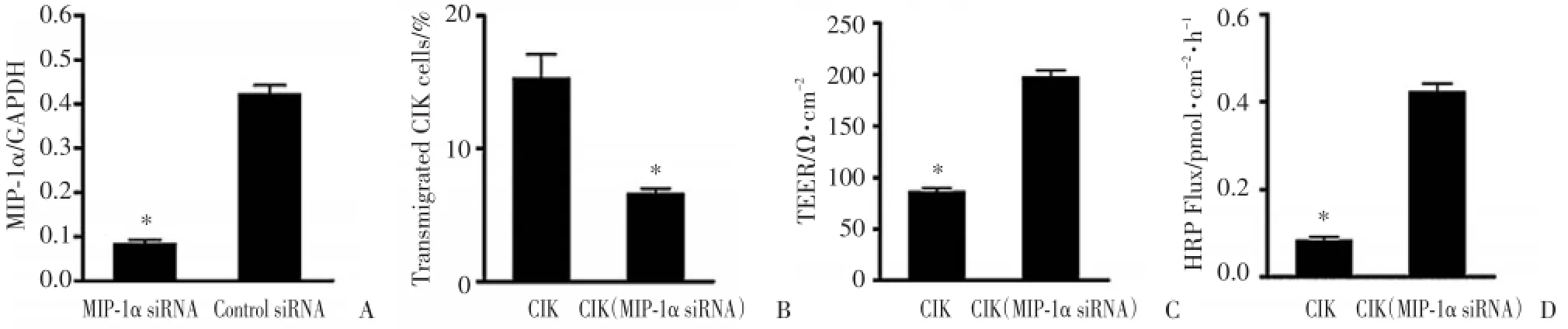
图2 肺癌脑转移患者CIK细胞和MIP-1αsiRNA干扰的肺癌脑转移患者CIK细胞的渗透和迁移能力Fig.2 Penetration and transmigration ability of CIK cells from lung cancer patients with brain metastasis and MIP-1α siRNA-CIK cells
2.3 MIP-1α siRNA降低肺癌脑转移患者CIK细胞对HCMEC的黏附性
细胞黏附试验中发现,将MIP-1α siRNA干扰的肺癌脑转移患者CIK细胞与HBMEC相互作用1、2、3、4 h后,其细胞黏附力增加,并呈时间依赖性。但是与未被干扰的肺癌脑转移患者CIK细胞对HBMEC粘附力相比,作用1 h时2组间无统计学差异,在相互作用2、3、4 h后,MIP-1αsiRNA干扰的肺癌脑转移患者CIK细胞与HBMEC的黏附力显著低于未被干扰的肺癌脑转移患者CIK细胞(图3,P<0.05)。

图3 MIP-1αsiRNA对肺癌脑转移患者CIK细胞黏附HBMEC的影响Fig.3 Effect of MIP-1αsiRNA on adherence of CIK cells from lung cancer patients with brain metastasis to HBMEC
3 讨论
肺癌脑转移瘤在所有脑转移瘤中占有很重要的比例[6],其中小细胞肺癌较非小细胞肺癌更易发生脑转移,肺腺癌脑转移风险比鳞癌高[7]。患者的中位生存期仅3~12个月[8]。目前针对脑转移瘤的治疗主要以放疗、手术治疗、化疗为主。目前这三种治疗方法针对肺癌脑转移瘤的治疗的确有效,但是光靠这三种方法是远远不够的,DC-CIK细胞免疫治疗作为新一代肿瘤ACI方法,在提高患者免疫力、改善晚期癌症患者生活质量、延长患者生存期等方面有着巨大的潜力。蒋琦等[9]报道了1例肺癌脑转移患者,在放疗、化疗不耐受的情况下行DC-CIK治疗,取得了生存期72个月、脑转移后无疾病生存期23.5个月的良好疗效。本研究表明,肺癌脑转移患者的CIK细胞能高表达MIP-1α,MIP-1α能诱导肺癌脑转移患者的CIK细胞在HBMEC构建的血脑屏障模型中跨内皮细胞迁移,为进一步研究CIK细胞进入血脑屏障抗颅内肿瘤提供理论依据。
趋化因子是一种低分子多肽,目前已发现达50余种,具体被分为CC、CXC、C及CX3C 4个家族[10],MIP-1α是CC家族趋化因子的一种,它能趋化淋巴细胞、单核细胞、中性粒细胞等各种白细胞向炎症部位聚集,介导了免疫细胞对组织的浸润、定位及活化[11],MIP-1α通过CCR1和CCR5表达驱动DC前体细胞的动员,还可通过诱导MIP-3α,间接驱动CCR+DC前体招募[12,13]。MIP-1α主要由单核细胞、中性粒细胞、小胶质细胞和星形胶质细胞产生,有文献[14,15]报道,阿尔茨海默症患者激活的T细胞能高表达MIP-1α穿过血脑屏障,到达中枢神经系统参与免疫反应。而趋化因子家族的另一成员,人单核细胞趋化蛋白1(human monocyte chemoattractant protein 1,MCP-1)能与鼠脑微血管内皮细胞上表达的CCR2相互作用,增加脑微血管内皮细胞的通透性[4],之前的研究[3]也表明,阿尔茨海默症患者的外周T淋巴细胞中MIP-1α能过度表达,它能辅助T淋巴细胞迁移入脑。
本研究探讨了肺癌脑转移患者和健康人CIK细胞表达MIP-1α的能力,并对MIP-1α诱导肺癌脑转移患者CIK细胞在HBMEC模型中的透过率、迁移能力和细胞黏附力进行分析。发现肺癌脑转移患者的CIK细胞表达MIP-1α的能力高于健康人CIK细胞。进一步用MIP-1α siRNA干扰肺癌脑转移患者的CIK细胞,与未被干扰的肺癌脑转移患者的CIK细胞比较,发现MIP-1α siRNA能阻断肺癌脑转移患者CIK细胞的跨内皮迁移,被MIP-1α siRNA干扰过的肺癌脑转移患者CIK细胞对HCMEC的黏附性降低,说明MIP-1α能诱导肺癌脑转移患者CIK细胞在HBMEC构建的体外血脑屏障模型中跨内皮迁移。本研究为CIK细胞透过血脑屏障机制的初步探索,从MIP-1α表达的角度分析了CIK细胞穿透血脑屏障的能力,为干预CIK细胞免疫治疗肺癌脑转移瘤提供了新的靶点。
[1]Ballen KK,Colvin G,Dey BR,et al.Cellular immune therapy for refractory cancers:novel therapeutic strategies[J].Exp Hematol,2005,33(12):1427-1435.
[2]Thorne SH,Negrin RS,Contag CH.Synergistic antitumor effects of immune cell-viral biotherapy[J].Science,2006,311(5768):1780-1784.
[3]Man SM,Ma YR,Shang DS,et al.Peripheral T cells overexpressMIP-1α to enhance its transendothelial migration in Alzheimer's disease[J].Neurobiol Aging,2007,28(4):485-496.
[4]Stamatovic SM,Keep RF,Kunkel SL,et al.Potential role of MCP-1 in endothelial cell tight junction‘opening’:signaling via Rho and Rho kinase[J].J Cell Sci,2003,116(Pt 22):4615-4628.
[5]Hara T,Wakatsuki S,Ozaki S,et al.Primary adult T-cell leukemia/ lymphoma of bone[J].Int J Hematol,2004,79(2):157-160.
[6]Kawabe T,Phi JH,Yamamoto M,et al.Treatment of brain metastasis from lung cancer[J].Prog Neurol Surg,2012,25:148-155.
[7]Lee DS,Kang JH,Lee CG,et al.Predicting survival in patients with advanced non-squamous non-small cell lung cancer:validating the extent of metastasis[J].Cancer Res Treat,2013,45(2):95-102.
[8]徐春华,于力克,张宇.肺癌脑转移患者的临床特征及预后分析[J].肿瘤学杂志,2014,20(6):468-470.
[9]蒋琦,钱其军.DC-CIK细胞免疫治疗肺癌脑转移病例报告一例[J].中国肿瘤生物治疗杂志,2015,22(2):252-254.
[10]Kakinuma T,Hwang ST.Chemokines,chemokine receptors,and cancer metastasis[J].J Leukoc Biol,2006,79(4):639-651.
[11]任欣会,张会娟,高慧祯.趋化因子MIP-1α、MIP-1β、MCP-1在自身免疫性甲状腺疾病中的表达及意义[J].重庆医科大学学报,2013,38(7):776-779.
[12]吴雨岗,汪良,丘凌,等.趋化性细胞因子MIP-1α促小鼠外周血DC前体细胞动员的实验研究[J].现代免疫学,2005,25(3):191-195.
[13]张春辉,金华,朱振亚,等.趋化因子MIP-1α和MIP-3α募集树突状细胞前体细胞的研究[J].现代免疫学,2012,32(3):210-215.
[14]曼淑梅,陈誉华.阿尔茨海默病患者外周血免疫细胞的亚型变化及其穿过血脑屏障的能力[J].中国神经精神疾病杂志,2004,30(4):266-269.
[15]Ransohoff RM,Kivisäkk P,Kidd G.Three or more routes for leukocyte migration into the central nervous system[J].Nat Rev Immunol,2003,3(7):569-581.
(编辑 于 溪)
MIP-1αEnhances Trans-endothelialMigration ofCIKCellsin Lung Cancer Patientswith Brain Metastasis
PIXin-miao1,3,LIZe-yu2,MAYi-ran2,LIDong-wen3
(1.Graduate SchoolofGrade 2013,Liaoning University ofTraditionalChinese Medicine,Shenyang 110847,China;2.DepartmentofBlood Transfusion,The FirstHospital,China MedicalUniversity,Shenyang 110001,China;3.Cadre Ward,The 463rd HospitalofChinese People’s Liberation Army,Shenyang 110042,China)
Objective To evaluate the MIP-1α expression level of CIK cells in lung cancer patients with brain metastasis and healthy individuals,and explore the role of MIP-1 in trans-endothelial migration of CIK cells in lung cancer patients.Methods The CIK cells and human brain microvascular endothelial cell(HBMEC)were cultured,and MIP-1α siRNA was transfected into the CIK cells.The expression of MIP-1α was determined,and the ability of the MIP-1α transfected CIK cells on passing through the blood brain barrier was observed through trans-endothelial migration and celladhesion test.Results CIKcells ofpatients with brain metastasis from lung cancerexhibited over-expressed MIP-1α,and MIP-1αcan promote CIK cells to migrate through endothelial cells in the blood brain barrier model which constructed by HBMEC.Conclusion This study is a preliminary study of the mechanism of CIK cells penetrating the blood brain barrier,which provides a new target for the treatment of brain metastasis oflung cancer.
cytokine-induced killer cell;lung cancer;human brain micro-vascular endothelial cell
R733.7
A
0258-4646(2016)02-0141-04
10.12007/j.issn.0258-4646.2016.02.010
辽宁省自然科学基金(2014020167)
皮新苗(1988-),男,硕士研究生.
李东文,E-mail:Ldw415985@sohu.com
2015-08-04
网络出版时间:
