姜黄素对NAFLD大鼠肝组织PPAR-γ和NF-κB p65mRNA及蛋白表达的影响
2016-11-22王子超赵丽娟
王子超,赵丽娟
(辽宁医学院1.研究生学院;2.附属第三医院消化内科,辽宁 锦州 121000)
·论著·
姜黄素对NAFLD大鼠肝组织PPAR-γ和NF-κB p65mRNA及蛋白表达的影响
王子超1,赵丽娟2
(辽宁医学院1.研究生学院;2.附属第三医院消化内科,辽宁 锦州 121000)
目的 研究姜黄素对高脂诱导的非酒精性脂肪性肝病(NAFLD)中肝过氧化物酶体增殖物激活受体γ(PPAR-γ)和核因子κB(NF-κB)p65 mRNA及蛋白表达的影响。方法 建立大鼠NAFLD模型,按照随机化原则分为5组:正常组、模型组、低剂量治疗组、中剂量治疗组、高剂量治疗组。正常组给予普通饮食,其余4组给予高脂饮食,同时分别用羧甲基纤维素钠(CMC)和低、中、高剂量姜黄素进行治疗。持续治疗12周后,处死各组大鼠并进行处理分析。血清生物化学方法检测大鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和总胆固醇(TC)的含量;HE染色对大鼠肝组织进行病理学观察;免疫组织化学检测大鼠肝组织PPAR-γ和NF-κB p65蛋白的表达情况;RT-PCR检测PPAR-γ和NF-κB p65mRNA的表达情况。结果 治疗组(低、中、高剂量)大鼠血清中ALT、AST、TG、TC含量较模型组明显降低(P<0.05)。治疗组(低、中、高剂量)大鼠肝组织的脂肪变性程度较模型组明显减轻。与正常组比较,模型组肝组织PPAR-γmRNA及蛋白的表达水平均明显降低(P<0.05),而NF-κB p65mRNA及蛋白的表达水平均明显升高(P<0.05)。与模型组比较,治疗组(低、中、高剂量)大鼠肝组织PPAR-γ的表达明显增加(P<0.05),PPAR-γ的表达水平以高剂量治疗组升高更加明显(P<0.01);与模型组相比,治疗组(低、中、高剂量)大鼠肝组织NF-κB p65的表达显著减少(P<0.05),NF-κB p65的表达水平以高剂量治疗组降低更加明显(P<0.01)。结论 姜黄素可明显减轻高脂诱导的大鼠NAFLD肝组织的脂肪变性和炎性反应,其抗脂肪变性和抗炎的机制可能与姜黄素激活PPAR-γ的表达,从而抑制NF-κB p65的活性有关。PPAR-γ和NF-κB p65的表达参与了NAFLD的发生发展,控制这些信号分子的表达可能是姜黄素治疗NAFLD的重要机制之一。
姜黄素;非酒精性脂肪性肝病;过氧化物酶体增殖物激活受体γ;核因子κB p65
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指非过量饮酒所引起的一组肝脏疾病的总称,通常与肥胖、2型糖尿病和代谢综合征密切相关。NAFLD的发病机制复杂,涉及氧化应激、脂毒性、线粒体损伤、胰岛素抵抗和炎性反应。过量的脂肪摄入会增加肝脏脂质大量生成和脂肪重新合成,影响胰岛素信号通路,从而促进肝脏甘油三酯的积累,最终导致NAFLD的发生[1]。NAFLD的病理特征以弥漫性肝细胞大泡性脂肪变为主,包括单纯性脂肪性肝病、脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、脂肪性肝纤维化和肝硬化。在过去的20年里,NAFLD的患病率已明显增加,它反映了一个重大的公共健康问题。流行病学[2]表明,NAFLD的患病率在成人和儿童中不断增加,为3%~10%,尤其在肥胖儿童中,其患病率上升到了40%~70%。因此引起了研究者越来越多的关注。
姜黄素是一种从姜黄根茎中提取的天然黄色多酚,姜黄生长在地球热带和亚热带地区,在许多亚洲国家被广泛用于食品制作。除了烹饪用途外,由于姜黄素有抗氧化、抗炎,抗突变,抗菌,抗癌等特性,因此在一些国家的传统医学中被认为是一种草药。姜黄素已被证明是一种影响许多炎性分子靶点作用的多效性分子。姜黄素对各种疾病的作用性质已被许多研究所证实。体外和体内研究[3]表明姜黄素在许多慢性疾病(如炎症性肠病、关节炎、胰腺炎、慢性前葡萄膜炎和癌症等)中可能是一种潜在的治疗剂。先前的体内研究[4]也使用不同的动物模型证明姜黄素对NAFLD的保护和治疗潜力。本实验研究姜黄素对NAFLD大鼠肝组织PPAR-γ和NF-κB p65表达的影响,旨在为治疗NAFLD提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:普通级健康雄性SD大鼠36只,体质量(200±20)g,由辽宁医学院实验动物中心提供,饲养于辽宁医学院科技楼动物房,温度20~25℃,12 h昼夜交替,按实验要求饲养。
1.1.2 主要药品与试剂:胆固醇(批号Y140306)购于安徽科宝生物工程有限公司,猪油于市场购买,三号胆盐(批号20140416)购于北京奥博星生物技术有限责任公司,姜黄素购于天津市光复精细化工研究所,羧甲基纤维素钠(CMC)购于天津市光复精细化工研究所,甲醛溶液购于沈阳天罡化学试剂厂,RT-PCR试剂盒(编号:RR047O)购于大连宝生物工程有限公司,PPAR-γ(sc-7273)抗体、NF-κB p65(ZS-8008)抗体购于北京中杉金桥生物技术有限公司。
1.1.3 主要仪器:PCR分析仪(型号:TC-512)购于英国TECHNE公司,全自动凝胶成像系统(型号:Gene Genius Match systems)购于英国SYNGENE公司。其他仪器有电子天平(型号MP200A)、离心机、高压锅、电磁炉、微波炉、莱卡DMI4000显微镜和电泳仪。
1.2 方法
1.2.1 动物模型建立与给药:将36只大鼠用普通正常饲料适应性喂养1周后,对每只大鼠进行编号,按照随机化原则分为5组,正常组(8只),普通正常饲料喂养;其余28只均分为4组:模型组和姜黄素低、中、高剂量治疗组,此4组给予高脂饮食(高脂饲料组成:87.5%基础饲料、10%猪油、2%胆固醇、0.5%胆盐)。12周后,每组分别处死1只大鼠,观察大鼠NAFLD造模情况,造模过程中正常组大鼠死亡1只。肝组织病理学方法证明造模成功后,各组大鼠继续按照原方式喂养,同时治疗组大鼠按不同药物剂量[姜黄素(25 mg/kg、50 mg/kg、100 mg/kg)溶解于0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC)配成混悬液]分为低、中、高剂量组。每天在固定时间分别对低、中、高剂量治疗组大鼠进行灌胃治疗(按0.8 mL/100 g体质量给药),正常组和模型组给予相应体积的0.5%CMC进行灌胃治疗。持续治疗12周,最后1次给药后禁食不禁水,次日上午称量体质量后,腹腔注射水合氯醛(0.3 mL/100 g体质量)麻醉。下腔静脉取血后,将一部分肝组织经液氮冷冻后保存于-80℃冰箱中备用,另一部分肝组织放于10%甲醛溶液中固定,常规石蜡包埋切片,HE染色作病理形态学观察和免疫组织化学染色。
1.2.2 血清生物化学指标测定:全自动生物化学分析仪检测分析大鼠血清中的谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)。
1.2.3 组织病理学观察:大鼠的肝组织10%甲醛溶液固定,常规石蜡包埋切片,HE染色后用光学显微镜进行观察。
1.2.4 免疫组织化学检测肝组织中PPAR-γ和NF-κB p65的表达:Envision两步法检测肝组织中PPAR-γ和NF-κB p65的表达,方法如下,石蜡切片常规脱蜡至水;用pH6.0枸橼酸缓冲液高压修复抗原,PBS洗5 min,共3次;3%过氧化氢溶液灭活内源性过氧化物酶,PBS洗5 min,共3次;滴加适当浓度一抗(1∶100稀释),4℃孵育过夜,PBS洗5 min,共3次;滴加二抗IgG多聚体,37℃孵育30 min,PBS洗5 min,共3次;DAB显色;苏木素复染,脱水,透明,封片,光镜下观察。根据阳性细胞的百分比和染色强度,参照文献[5]的判定标准来测定。
1.2.5 RT-PCR方法检测肝组织中PPAR-γ和NF-κB p65 mRNA的表达:每只大鼠取100 mg组织加入Ep管中,用剪刀剪碎,加入Trizol溶液(1 mL)提取总RNA,以总RNA为模板,逆转录合成cDNA,以适量的cDNA为模板,以β-肌动蛋白(β-actin)为内部参照,PCR扩增PPAR-γ和NF-κB p65基因片段。应用两步法试剂盒进行,反应体系为20 μL,42℃2 min,4℃。PCR反应参数设置:95℃预变性30 s;95℃变性5 s,60℃退火30 s,72℃延伸30 s,共40个循环;72℃延伸10 min;4℃终止反应。采用2%琼脂糖凝胶进行电泳,应用全自动凝胶成像系统进行拍照检测,采用Gene Tool软件对条带进行分析,用目的基因与内参基因吸光度的比值来表示结果,见表1。
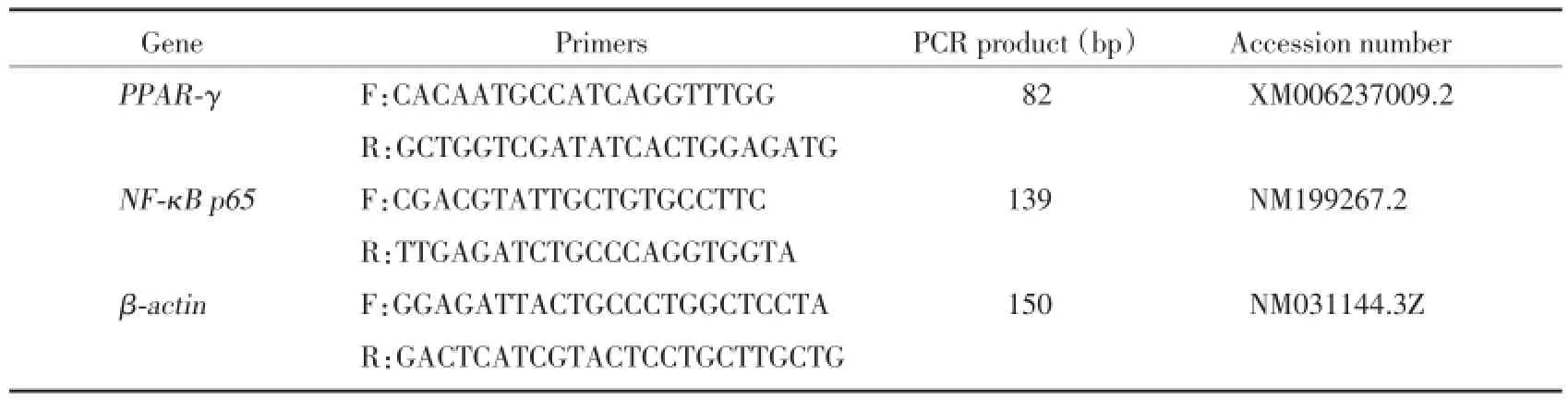
表1 引物设计Tab.1 Primer design
1.3 统计学分析
2 结果
2.1 血清肝功能和血脂指标分析
与正常组比较,模型组大鼠血清中ALT、AST、TG和TC含量均明显增加(P<0.05)。与模型组相比,姜黄素(低、中、高剂量)治疗组大鼠血清中ALT、AST、TG和TC含量均明显减少(P<0.05),其中高剂量治疗组含量减少最明显(P<0.01),见表2。
2.2 肝组织的病理形态学变化
HE染色可见正常组大鼠肝小叶结构完整,肝索排列整齐,肝细胞形态规则,无脂肪变性及炎症坏死情况;模型组大鼠肝小叶边界模糊,肝索结构紊乱,肝细胞脂肪变性,可见大小不等的空泡变性,炎症坏死明显;与模型组相比,治疗组大鼠肝小叶结构变清晰,肝细胞排列呈条索状,脂肪变性明显减轻,以姜黄素高剂量治疗组更加明显,差异显著,见图1。
2.3 免疫组织化学法测定PPAR-γ和NF-κB p65的表达
表2 不同剂量姜黄素对大鼠血清ALT、AST、TG和TC的影响()Tab.2 Effect of different doses of curcumin on serum ALT,AST,TG and TC()

表2 不同剂量姜黄素对大鼠血清ALT、AST、TG和TC的影响()Tab.2 Effect of different doses of curcumin on serum ALT,AST,TG and TC()
1)P<0.05 vs normal group;2)P<0.05,3)P<0.01 vs model group.Cur-L,low dose curcumin group;Cur-M,middle dose curcumin group;Cur-H,high dose curcumin group.
Group n ALT(IU/L) AST(IU/L) TG(mmol/L) TC(mmol/L)Normal 6 79.00±10.54 148.00±11.53 0.28±0.07 1.06±0.08 Model 6 172.50±8.261) 320.50±10.971) 0.71±0.121) 2.27±0.091)Cur-L 6 101.00±8.892) 299.00±8.542) 0.46±0.112) 2.05±0.092)Cur-M 6 88.00±12.532) 232.00±7.812) 0.38±0.082) 1.34±0.072)Cur-H 6 79.5±11.263) 199.50±9.843) 0.32±0.123) 1.32±0.113)

图1 大鼠肝组织 HE×200Fig.1 Optical micrographs of rat liver tissues HE×200
如图2所示,与正常组比较,模型组肝细胞核内见少量棕色颗粒,表示模型组肝细胞核内PPAR-γ蛋白表达显著减少;与模型组比较,姜黄素低、中、高剂量治疗组肝细胞核棕色颗粒显著增加(P<0.05),尤其高剂量治疗组PPAR-γ蛋白增加更明显。姜黄素高剂量治疗组PPAR-γ蛋白较低、中剂量治疗组增加明显,差异有统计学意义(P<0.01),呈现剂量依 赖关系。见表3。
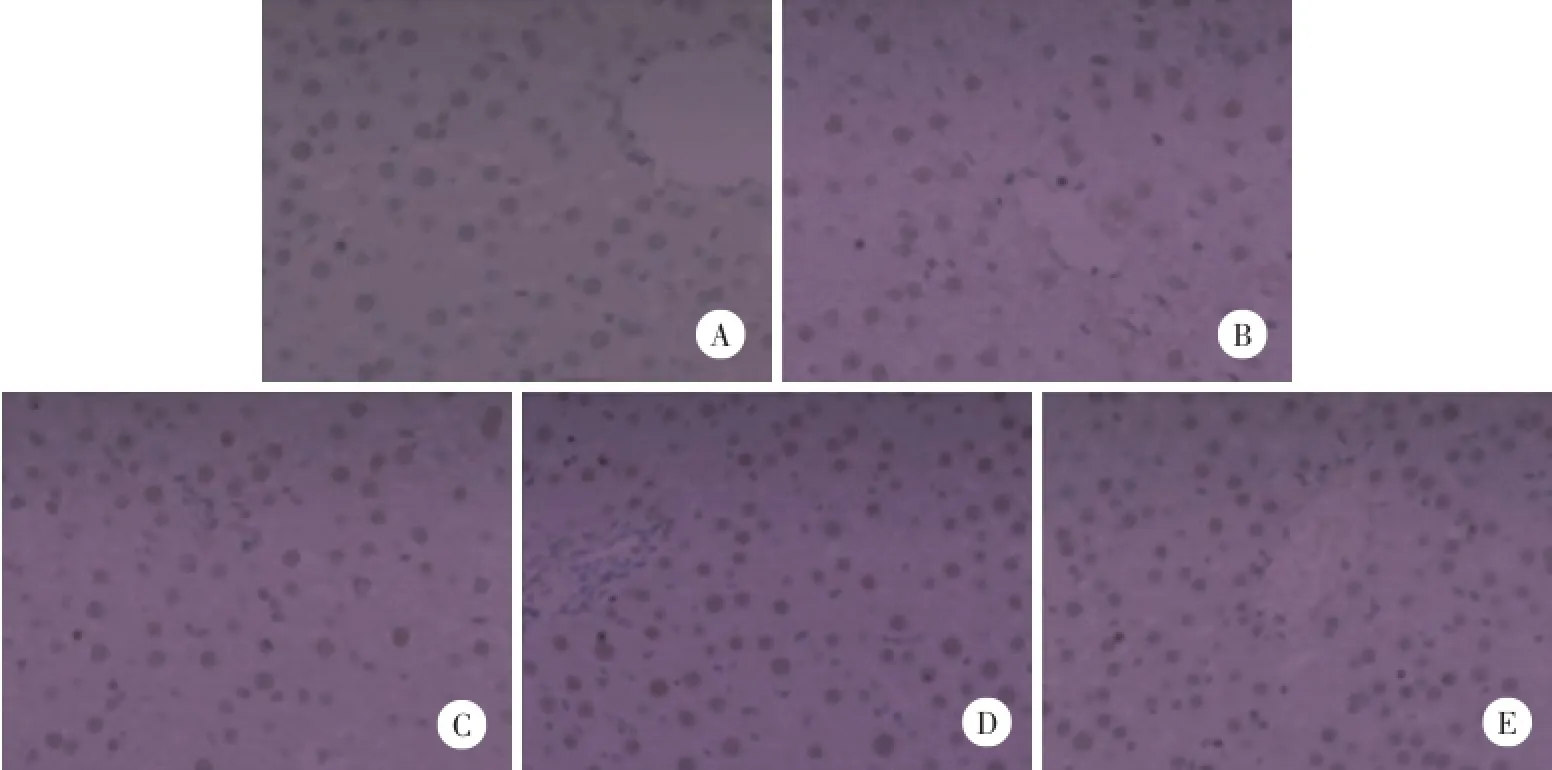
图2 大鼠肝组织PPAR-γ免疫组织化学染色 DAB×200Fig.2 Immunohistochemical staining of PPAR-γ in rat liver tissue DAB×200

表3 各组大鼠肝组织PPAR-γ蛋白的表达Tab.3 The expression of PPAR-γ protein in rat liver tissue
与正常组比较,模型组肝细胞胞质和胞核内见大量棕色颗粒,表示模型组肝细胞胞质和胞核内NF-κB p65蛋白表达显著增加;与模型组比较,姜黄素不同剂量治疗组肝细胞胞质棕色颗粒显著减少(P<0.05),尤其高剂量治疗组NF-κB p65蛋白减少更明显,表示NF-κB p65蛋白表达降低。姜黄素高剂量治疗组NF-κB p65蛋白较低、中剂量治疗组降低更明显,差异有统计学意义(均P<0.01),呈剂量依赖关系,见图3、表4。
2.4肝组织中PPAR-γ和NF-κB p65 mRNA表达

图3 大鼠肝组织NF-κB p65免疫组化染色 DAB×200Fig.3 Immunohistochemical staining of NF-κB p65 in rat liver tissue DAB×200
RT-PCR结果表明,模型组大鼠肝组织PPAR-γ mRNA表达较正常组显著降低(P<0.05);与模型组相比,姜黄素治疗12周后,各剂量治疗组肝组织中PPAR-γmRNA表达明显增加(P<0.05),尤其以姜黄素高剂量治疗组增加更明显,差异有统计学意义(P<0.01)。与此同时,模型组大鼠肝组织中NF-κB p65mRNA表达较正常组显著升高(P<0.05);与模型组相比,姜黄素各剂量治疗组肝组织中NF-κB p65mRNA表达明显减少(P<0.05),尤其以高剂量治疗组减少更明显,差异有统计学意义(P<0.01),见图4、表5。
3 讨论
NAFLD的病因较多,发病机制至今尚未完全明确,目前有几个发病学说,但最为成熟的是“二次打击”学说。第一次打击是脂肪变性的发展,长期营养过剩导致脂质代谢紊乱,引起了游离脂肪酸(free fatty acids,FFAs)和甘油三酯在肝脏的积聚。肝细胞中游离脂肪酸的不断增加降低了β-氧化,因而又提高了脂肪酸的积聚。第二次打击是脂肪变性发展到炎症和纤维化的阶段,由于氧化应激,线粒体功能障碍和炎性细胞因子导致肝细胞炎症和坏死,并激活纤维化级联反应。
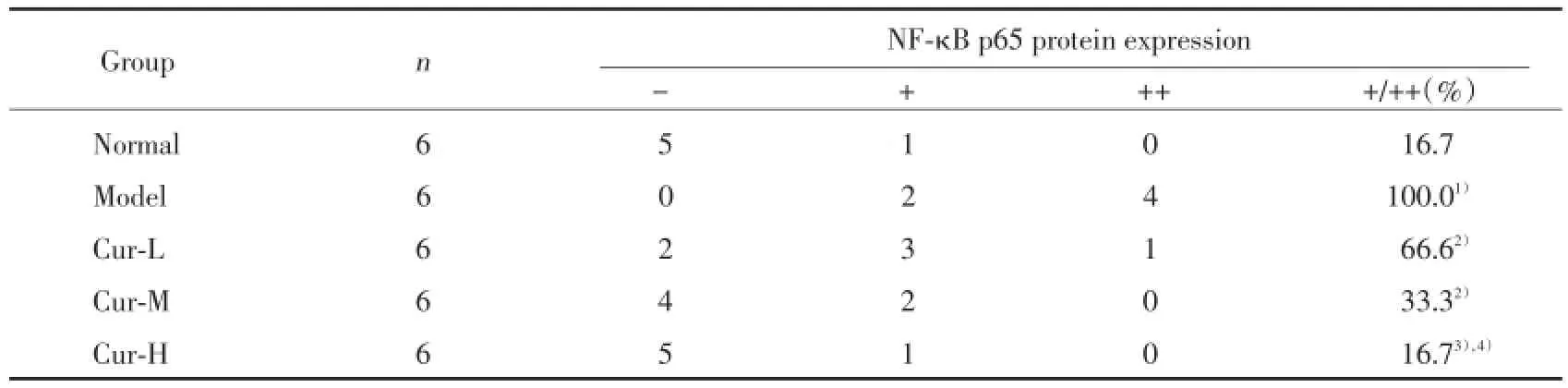
表4 各组大鼠肝组织NF-κB p65蛋白的表达Tab.4 The expression of NF-κB p65 protein in rat liver tissue

图4 大鼠肝组织PPAR-γ和NF-κB p65mRNA的表达水平Fig.4 The mRNA expression level of liver tissue PPAR-γand NF-κB p65
表5 姜黄素对大鼠肝组织PPAR-γ和NF-κB p65mRNA表达的影响()Tab.5 Effects of curcumin on mRNA expression of PPAR-γ and NF-κB p65 in rat liver tissue()

表5 姜黄素对大鼠肝组织PPAR-γ和NF-κB p65mRNA表达的影响()Tab.5 Effects of curcumin on mRNA expression of PPAR-γ and NF-κB p65 in rat liver tissue()
1)P<0.05 vs normal group;2)P<0.05,3)P<0.01 vs model group.Cur-L,low dose curcumin group;Cur-M,middle dose curcumin group;Cur-H,high dose curcumin group.
Group n NF-KB p65mRNA PPAR-γmRNA Normal 6 0.13±0.04 0.28±0.03 Model 6 0.75±0.051) 0.18±0.031)Cur-L 6 0.61±0.052) 0.29±0.042)Cur-M 6 0.52±0.042) 0.32±0.032)Cur-H 6 0.38±0.043) 0.43±0.033)
PPAR-γ是一种核受体和配体激活的转录因子超家族成员之一,激活后可以控制葡萄糖和脂质代谢、脂肪细胞分化、调节炎性反应。有研究[6]显示,PPAR-γ可以转录调节脂肪的生成,在脂肪储存的过程中起着重要作用。一些研究[7,8]表明,PPAR-γ在大鼠模型的过表达可以防止脂肪肝进展,用PPAR-γ激动剂罗格列酮治疗已被证明也有类似的效果。PPAR-γ的保护作用可能是由于脂肪组织和骨骼肌对胰岛素的敏感性提高,导致肝脏中游离脂肪酸的沉积减少。此外,PPAR-γ表达显示出在星状细胞、巨噬细胞和上皮细胞具有抗炎和抗纤维化效果[9]。
Xu等[10]研究表明,姜黄素能显著诱导PPAR-γ的基因表达和激活PPAR-γ。Zheng等[11]报道指出,姜黄素能够激活体外活化的肝星状细胞PPAR-γ的活性,这对减少细胞增殖、诱导细胞凋亡和抑制细胞外基质基因的表达来说十分必要。本研究结果表明,姜黄素可明显增加PPAR-γ的活性,提高PPAR-γ的表达,从而抑制肝细胞的脂肪变性和坏死凋亡。
NF-κB是一种转录因子,能被各种刺激(包括细胞因子、促细胞分裂剂、致癌物质、化疗试剂、物理和化学应力、辐射、缺氧和其他炎性刺激等[12~14])激活。NF-κB在所有细胞的细胞质中处于静止状态,只有激活时才移位到细胞核与相应的基因序列相结合。在静止状态下,NF-κB由p50、p65和IκB组成异源三聚体存在于细胞质中。磷酸化、泛素化以及IκB的降解将会导致p50-p65异源二聚体的活化,然后转位到细胞核并在相应的基因上结合特定的应答元件,从而对细胞组织产生一定的调节作用。有研究[15]已经证明姜黄素可以下调NF-κB的活性。姜黄素通过抑制IκB激酶和Akt的激活可以下调细胞增殖基因、抗凋亡基因和转移性基因产物的表达[16]。随后,其他的研究[17]也表明姜黄素可以通过抑制IκB激酶的激活来下调NF-κB的表达。本研究结果表明,姜黄素可明显抑制NF-κB p65的活性,降低NF-κB p65的表达,从而减轻炎性反应。由于NF-κB在肝组织的脂肪变性、炎性反应和细胞凋亡中发挥着重大的作用,因此作为一种基因转录调控因子,NF-κB越来越多地引起了研究者的关注。
关于姜黄素激活PPAR-γ后,是否与NF-κB p65相关联共同发挥抗炎作用,有研究[18~20]已证明其内在的关系。本研究结果与之前的研究结果一致。本实验中模型组大鼠肝组织PPAR-γ表达降低,NF-κB p65表达增高;而姜黄素不同剂量治疗组PPAR-γ表达增高,NF-κB p65表达降低,两者呈明显的负相关。姜黄素可通过促进PPAR-γ的表达使NF-κB p65的表达明显降低,干扰NF-κB p65的核转位,减轻肝细胞的炎性反应和坏死凋亡,从而有助于改善NAFLD的发生和进展。Kelly等[21]证明,PPAR-γ通过降低NF-κB的活性,可以下调炎症基因的表达,从而调节炎症通路。还有研究[22,23]表明PPAR-γ可以直接与NF-κB的亚基p65/p50相互结合,两者之间发生相互作用,形成转录抑制复合物,降低NF-κB与DNA元件之间的结合活性,抑制NF-κB DNA的合成,从而抑制它的表达,间接影响了NF-κB对其他转录因子的表达,进而对一些炎性因子和蛋白的生成产生影响。可见,PPAR-γ与NF-κB p65的联系非常紧密,两者之间相互作用、相互影响,共同调节机体脂肪肝的发生、进展。
综上所述,本研究结果表明姜黄素可以降低NAFLD大鼠血清中ALT、AST、TG和TC的含量,减轻肝细胞的变性坏死。在抑制肝组织脂肪变性的过程中,细胞脂肪变性程度与姜黄素存在着明显的剂量依赖关系。姜黄素可以调控肝组织中PPAR-γ和NF-κB p65的表达水平,两者存在着明显的负相关。姜黄素可以通过抑制NAFLD大鼠肝组织的脂肪变性和炎性反应对NAFLD产生明显的治疗作用,此研究为今后姜黄素治疗NAFLD提供了重要的理论依据。
[1]Pan MH,Lai CS,Tsai ML,et al.Chemoprevention of nonalcoholic fatty liver disease by dietary natural compounds[J].Mol Nutr Food Res,2014,58(1):147-171.
[2]Bellentani S,Scaglioni F,Marino M,et al.Epidemiology of non-alcoholic fatty liver disease[J].Dig Dis,2010,28(1):155-161.
[3]Jurenka JS.Anti-inflammatory properties of curcumin,a major constituent of curcuma longa:a review of preclinical and clinical research[J].Altern Med Rev,2009,14(2):141-153.
[4]Wang S,Moustaid-Moussa N,Chen L,et al.Novel insights of dietary polyphenols and obesity[J].J Nutr Biochem,2014,25(1):1-18.
[5]许中良,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):299.
[6]Okamura M,Inagaki T,Tanaka T,et al.Role of histone methylation and demethylation in adipogenesis and obesity[J].Organogenesis,2010,6(1):24-32.
[7]Gupte AA,Liu JZ,Ren Y,et al.Rosiglitazone attenuates age-and diet-associated nonalcoholic steatohepatitis in male low-density lipoprotein receptor knockout mice[J].Hepatology,2010,52(6):2001-2011.
[8]Wu CW,Chu ES,Lam CN,et al.PPAR gamma is essential for protection against nonalcoholic steatohepatitis[J].Gene Ther,2010,17(6):790-798.
[9]成扬,平键,刘成,等.姜黄素激活过氧化物酶体增殖因子活化受体γ信号对大鼠肝星状细胞基质金属蛋白酶2、9活性和胞核核因子-κB p65表达的影响[J].中国中西医结合杂志,2007,27(5):439-443.
[10]Xu J,Fu Y,Chen A.Activation of peroxisome proliferator-activated receptor-gamma contributes to the inhibitory effects of curcumin on rat hepatic stellate cell growth[J].Am J Physiol Gastroint Liver Physiol,2003,285(1):G20-30.
[11]Zheng S,Chen A.Curcumin suppresses the expression of extracellular matrix genes in activated hepatic stellate cells by inhibiting gene expression of connective tissue growth factor[J].Am J Physiol Gastroin Liver Physiol,2006,290(5):G883-893.
[12]Aggarwal BB.Nuclear factor-kappa B:the enemy within[J].Cancer Cell,2004,6(3):203-208.
[13]Baldwin AS.Series introduction:the transcription factor NF-kappa B and human disease[J].J Clin Investigation,2001,107(1):3-6.
[14]Pahl HL.Activators and target genes of Rel/NF-kappa B transcription factors[J].Oncogene,1999,18(49):6853-6866.
[15]Leclercq IA,Farrell GC,Sempoux C,et al.Curcumin inhibits NF-kappa B activation and reduces the severity of experimental steatohepatitis in mice[J].J Hepatol,2004,41(6):926-934.
[16]Aggarwal S,Ichikawa H,Takada Y,et al.Curcumin(diferuloylmethane)down-regulates expression of cell proliferation and antiapoptotic and metastatic gene products through suppression of ikappa B alpha kinase and Akt activation[J].Mol Pharmacol,2006,69(1):195-206.
[17]Jobin C,Bradham CA,Russo MP,et al.Curcumin blocks cytokinemediated NF-kappa B activation and proinflammatory gene expression by inhibiting inhibitory factor I-kappa B kinase activity[J].J Immunol,1999,163(6):3474-3483.
[18]Jimenez-Flores LM,Lopez-Briones S,Macias-Cervantes MH,et al. A PPAR gamma,NF-kappa B and AMPK-dependent mechanism may be involved in the beneficial effects of curcumin in the diabetic db/db mice liver[J].Molecules,2014,19(6):8289-8302.
[19]Zhao CY,Wang JB,Deng ZJ,et al.Relationship between NF-kappa B binding activity and expression of PPAR gamma mRNA in the livers of rats with fatty liver disease[J].Zhonghua Gan Zang Bing Za Zhi,2005,13(2):96-100.
[20]Romics L Jr,Kodys K,Dolganiuc A,et al.Diverse regulation of NF-kappa B and peroxisome proliferator-activated receptors in murine nonalcoholic fatty liver[J].Hepatology,2004,40(2):376-385.
[21]Kelly D,Campbell JI,King TP,et al.Commensal anaerobic gut bacteria attenuate inflammation by regulating nuclear-cytoplasmic shuttling of PPAR-gamma and RelA[J].Nat Immunol,2004,5(1):104-112.
[22]Li M,Pascual G,Glass CK.Peroxisome proliferator-activated receptor gamma dependent repression of the inducible nitric oxide synthase gene[J].Mol Cell Biol,2000,20(13):4699-4707.
[23]Chung SW,Kang BY,Kim SH,et al.Oxidized low density lipoprotein inhibits interleukin-12 production in lipopolysaccharide-activated mouse macrophages via direct interactions between peroxisome proliferator-activated receptor-gamma and nuclear factor kappa B[J].J Biol Chem,2000,275(42):32681-32687.
(编辑 武玉欣)
Effectsof Curcumin on mRNAand Protein Expression of PPAR-γand NF-κBp65in NAFLD Liver Tissue
WANGZi-chao1,ZHAO Li-juan2
(1.Graduate College,Liaoning Medical University,Jinzhou 121000,China;2.Department of Digestive Disease,The Third Affiliated Hospital,Liaoning Medical University,Jinzhou 121000,China)
Objective To investigate the effects of curcumin on mRNA and protein expression of hepatic peroxisome proliferator activated receptor gamma(PPAR-γ)and nuclear factor kappa B(NF-κB)p65 in rats with high-fat induced nonalcoholic fatty liver disease(NAFLD).Methods NAFLD model was established in rats.The rats were randomly divided into five groups:normal group,model group,low dose group,middle dose group and high dose treatment group.Normal group was given ordinary diet,and the remaining four groups were fed with high fat diet,while the rats were treated with sodium carboxymethyl cellulose(CMC)and low,medium and high dose curcumin.After twelve weeks of treatment,the rats were sacrificed and effects ofthe treatmentwere analyzed.The contentin serum ofratwas detected foralanine transaminase(ALT),aspartate aminotransferase(AST),triglyceride(TG)and total cholesterol(TC)by biochemistry method.Pathological changes of liver tissue were observed in rats by HE staining.Expression ofPPAR-γand NF-κB p65 protein was detected in livertissue ofratsby immunohistochemistry.Expression of PPAR-γand NF-κB p65mRNA was detected by RT-PCR method.Results The contents of ALT,AST,TG and TC in the serum of the treatment group were significantly lowerthan those in the modelgroup(P<0.05).The hepatic steatosis in treatmentgroup wassignificantly lowerthan thatin modelgroup.Compared with normalgroup,the mRNAand protein expression levels ofPPAR-γin the modelgroup were significantly decreased(P<0.05),while themRNA and protein expression levels of NF-κB p65 were significantly increased(P<0.05).Compared with the model group,the expression of PPAR-γ in livertissue of the treatment group was significantly increased(P<0.05),and the expression level of PPAR-γ was significantly higherin high dose group(P<0.01).Compared with the modelgroup,the expression ofNF-κBp65 in livertissue ofthe treatmentgroup was significantly decreased(P<0.05),and the expression ofNF-κB p65 in high dose treatmentgroup decreased more significantly(P<0.01).Conclusion Curcumin can significantly reduces high-fat induced hepatic steatosis and inflammation reaction in rats,and the mechanism of its anti hepatic steatosis and anti-inflammation may be that curcumin enhances the expression of PPAR-γ and inhibits the activity of NF-κB p65.It was proved that the expression ofPPAR-γand NF-κBp65 was involved in the developmentofNAFLD.Controlling the expression ofthese molecules may be one ofthe importantmechanisms ofcurcumin in NAFLD treatment.
curcumin;nonalcoholic fatty liver disease;peroxisome proliferator activated receptor gamma;nuclear factor kappa B p65
R575.5
A
0258-4646(2016)02-0120-07
10.12007/j.issn.0258-4646.2016.02.006
辽宁省科学技术计划(2012225019)
王子超(1988-),男,硕士研究生.
赵丽娟,E-mail:qingsong201575@sina.com
2015-07-15
网络出版时间:
