miR-152在非小细胞肺癌患者血清中的表达及临床意义
2016-11-21吴海卫李忠东
强 勇,杨 楠,张 雷,李 鹏,刘 凯,吴海卫,申 翼,李忠东
(南京军区南京总医院心胸外科 210002)
论著·临床研究 doi:10.3969/j.issn.1671-8348.2016.28.023
miR-152在非小细胞肺癌患者血清中的表达及临床意义
强 勇,杨 楠,张 雷,李 鹏,刘 凯,吴海卫,申 翼,李忠东△
(南京军区南京总医院心胸外科 210002)
[摘要] 目的 通过检测非小细胞肺癌(NSCLC)患者血清中microRNA-152(miR-152)的水平,探讨其与NSCLC的关系。方法 采用Real time-PCR法检测61例NSCLC患者和80例健康对照者血清miR-152的表达水平,并分析其与临床病理指标间的关系。结果 NSCLC组血清miR-152 的表达水平显著降低(P<0.01)。且其表达量与患者吸烟史和TNM分期有关,有吸烟史的NSCLC晚期的患者表达更低(P<0.05),而在不同年龄、性别、组织学类型、肿瘤分化间差异无统计学意义(P>0.05)。根据miR-152的表达水平绘制ROC曲线,曲线下面积为0.820(95%CI=0.752~0.889),临界值取0.48时,灵敏度和特异度分别为63.80%和90.20%。结论 NSCLC患者血清中miR-152表达低,且与肿瘤分化程度相关,miR-152可能作为NSCLC诊断的特异肿瘤标志物。
miR-152;癌,非小细胞癌;逆转录聚合酶链反应;ROC曲线
[Abstract] Objective Tto investigate the expression of microRNA-152(miR-152)in the serum of patients with non-small cell lung cancer(NSCLC),and to explore the clinical significance of NSCLC.Methods The relative expression levels of miR-152 in serum of 61 NSCLC patients and 80 healthy individuals were assessed by quantitative real-time PCR(RT-PCR),and the clinical pathological parameters was analyzed.Results The expression of miR-152 was significantly lower in the serum of NSCLC than that of controls(P<0.01).Down regulation of miR-152 was found to be correted with the clinicopathological features such as smoking histroy and TNM staging(P<0.05),but there was no significant difference in different age,sex,histological type and tumor differentiation(P>0.05).The ROC curve for miR-152 revealed a strong diagnostic performance,the value of the area under ROC(AUC-ROC)was 0.820(95%CI:0.752-0.889),optimal sensitivity and specificity were 63.80% and 90.20% when 0.48 was selected as the critical value.Conclusion It was found that miR-152 is significantly reduced in serum samples of NSCLC patients,and the data suggests that it may be a particular biomarker for the clinical diagnosis of NSCLC.
肺癌,尤其是非小细胞肺癌(non-small cell lung cancer,NSCLC)是人类罹患癌症死亡的主要原因,每年全球有超过500 000人死亡[1]。尽管近年来在NSCLC的早期发现和治疗上有所进步,但其高病死率并未显著下降。NSCLC往往在确诊时已属晚期,且5年生存率低于15%[2]。NSCLC的不良预后主要是由于缺乏规范有效而又经济实用的诊断方式,以便能够筛选出早期的肿瘤。有文献报道及时诊断治疗早期NSCLC可将患者5年生存率提高到60%~80%[1,3],所以开发这样的生物标志物是一个关乎公共健康,势在必行的举措。微小RNA(miRNAs)是一类含量丰富的,包含17~25个核苷酸的小的非编码RNA,它通过直接结合到靶mRNA的3′端非翻译区(3′UTR区),从而在转录后水平调控基因表达[4-5]。miRNAs是一类重要的调节因子,参与到很多生理病理过程,例如细胞生长、分化、凋亡及肿瘤的发生、转移、恶化[6-7]。鉴于它的多功能性,miRNAs的表达水平或许能够作为肿瘤的标志物。miR-152属于miR-148/152家族[8],已经确定它在标本和细胞系下调[9-10]。然而,miR-152在NSCLC患者血清中的表达报道还不多。因此,在本研究中,笔者通过检测61例NSCLC患者和 80例健康个体血清miR-152的表达水平,来分析其表达与患者临床资料间的联系。
1 资料与方法
1.1 一般资料 血样来自2014年3月至2015年4月在本院接受原发性NSCLC手术切除的患者61例(NSCLC组),原发性NSCLC均为初次发现,均经病理组织学确诊,术前未行任何抗肿瘤治疗。患者中男40例,女21例,中位年龄60岁(32~77岁)。病理类型包括鳞癌26例,腺癌30例,腺鳞癌5例。TNM分期按照国际肺癌研究会(IASLC)公布的标准,Ⅰ/Ⅱ期37例,Ⅲ/Ⅳ期24例。本研究经本院医学伦理学委员会批准,患者签署知情同意书。此外,选取本院同期80例体检中心健康个体为对照组,男50例,女30例,年龄28~72岁,中位年龄58岁。经检查均无肝、肺、肾、脑等脏器疾病,无消化道和血液系统疾病史。研究对象均于清晨空腹采血3~5 mL于促凝管中,3 000 r/min离心10 min分离血清,吸取上清液并迅速置于-80 ℃保存。
1.2 主要试剂及仪器 基因扩增检测仪LightCycler480RⅡ购自德国Roche公司;miRcute miRNA提取分离试剂盒、miRcute miRNA cDNA第一链合成试剂盒和miRcute miRNA荧光定量检测试剂盒购自Tiangen公司;引物均由上海英骏生物技术有限公司合成并修饰。
1.3 总RNA提取 按miRcute miRNA提取试剂盒说明书抽提血清,用核酸蛋白检测仪在OD260/280 nm处测定OD值,计算miRNA的含量及纯度。利用miRcute miRNA cDNA第一链合成试剂盒反转录成20 μL cDNA,cDNA样本置-20 ℃保存备用。
1.4 实时荧光定量 PCR(qRT-PCR)检测 扩增所用的miR-152和U6的引物序列见表1。PCR总反应体系为20.0 μL,内含2×miRcute miRNA Premix 10.0 μL,10 μmol/L的上、下游引物各0.4 μL,cDNA 2.0 μL,其余加双蒸水补足。扩增条件为:94 ℃预变性2 min;94 ℃ 20 s,60 ℃ 34 s(温度转换率均为20 ℃/s),扩增40个循环。60 ℃延伸时采集荧光信号,所有样品均做复孔,miR-152的相对表达量用2-ΔΔCt法表示。

表1 miRNAs的引物序列

2 结 果
2.1 miR-152的表达水平 miR-152的相对表达量通过同一样本miR-152与U6的比值来表示。NSCLC患者血清miR-152 的表达量为0.23±0.19,显著低于对照组的1.54±0.67,差异有统计学意义(P<0.01),见图1。
2.2 肺癌患者临床参数与miR-152表达的关系 分析NSCLC患者中miR-152表达水平与患者年龄、性别、吸烟史、组织学类型、肿瘤分化及TNM分期等临床病理参数的关系。结果显示,miR-152在有吸烟史的患者中表达量低于无吸烟史的患者(P<0.05);且晚期患者miR-152表达水平显著下降,差异有统计学意义(P<0.05),见表2。
2.3 miR-152对NSCLC的诊断价值 对61例NSCLC患者血清miR-152水平建立ROC曲线,见图2,利用ROC曲线评价miR-152的诊断价值。AUC为0.820(95%CI:0.752~0.889)。当临界值取0.48时,灵敏度和特异度分别为63.80%和90.20%。

>a:P<0.05。
图1 NSCLC组和对照组血清的miR-152表达水平
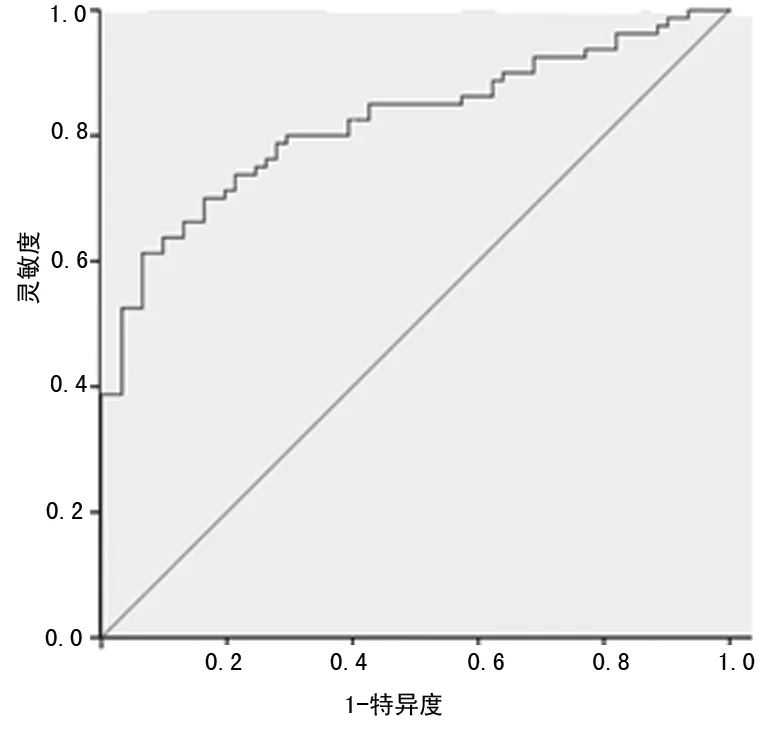
图2 miR-152 ROC曲线
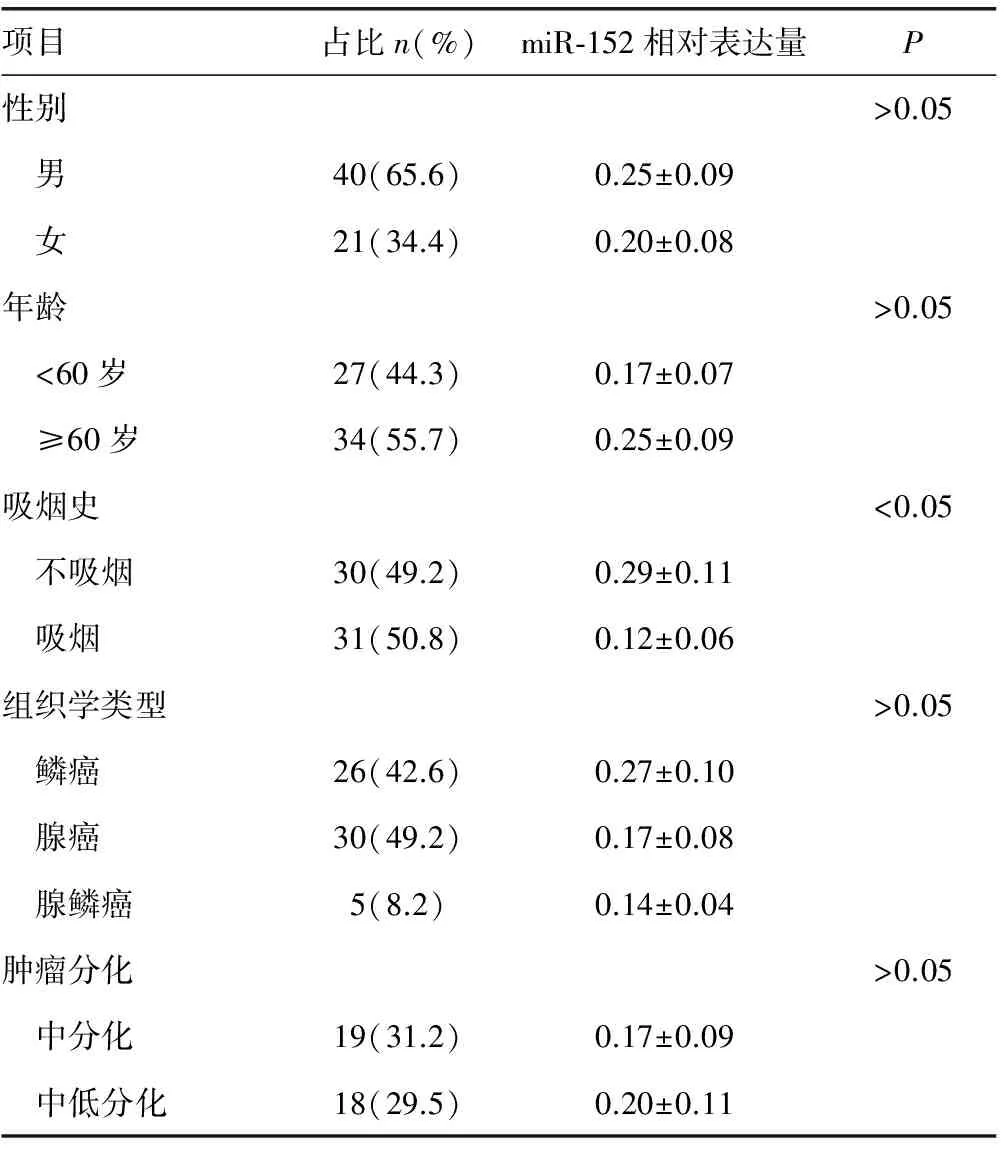
项目占比n(%)miR⁃152相对表达量P性别>0.05 男40(65.6)0.25±0.09 女21(34.4)0.20±0.08年龄>0.05 <60岁27(44.3)0.17±0.07 ≥60岁34(55.7)0.25±0.09吸烟史<0.05 不吸烟30(49.2)0.29±0.11 吸烟31(50.8)0.12±0.06组织学类型>0.05 鳞癌26(42.6)0.27±0.10 腺癌30(49.2)0.17±0.08 腺鳞癌5(8.2)0.14±0.04肿瘤分化>0.05 中分化19(31.2)0.17±0.09 中低分化18(29.5)0.20±0.11

续表2 NSCLC患者临床参数及其与血清中miR-152水平的关系
3 讨 论
miRNAs非常稳定,即使是在成分复杂的富含RNase酶的血清中,也可以长时间存在[11]。在某些疾病包括NSCLC中,它们的表达水平会发生变化[12],由此他们可被选作生物标志物,用来检测疾病的发生和进展。目前,一些在疾病发病过程中有明显改变的miRNAs,已作为新型的血液标志物应用到这些疾病的诊断和预后上。NSCLC病死率居全球癌症前两位,迄今为止仍然无非常可靠的生物指标来诊断早期的NSCLC。
本研究中,作者通过定量RT-PCR检测血清中miR-152的表达,发现miR-152在NSCLC患者中显著下调(P<0.001)。进一步分析发现miR-152与临床病理特征,如患者的吸烟史、TNM分期相关(P<0.05)。ROC曲线显示血清miR-152能作为诊断NSCLC的可靠生物标志物,其AUC为0.820(95%CI:0.752~0.889),灵敏度和特异度分别达到63.80%和90.20%。本试验证实miR-152的表达水平在NSCLC患者和健康个体中显著不同,依据其表达差异,miR-152可用于筛选患NSCLC的个体。这一研究表明,血清中的miR-152可作为区分NSCLC的一种新型的非侵入性生物标志物。
已有文献报道了miR-152在很多肿瘤中表达下调,例如miR-152在HBV相关的肝癌组织中表达下调[13];Chen等[14]报道了胃肠道肿瘤组织及细胞株中miR-152表达显著降低,并且降低的程度与肿瘤组织大小及肿瘤分期密切相关;而在肺癌方面,Cheng等[9]通过检测30例NSCLC患者的肿瘤组织和正常组织发现miR-152在肺癌组织中表达下降,并与其预后不良相关;Su等[10]证实这一结果,并且发现上调miR-152表达能明显抑制NSCLC细胞的增殖、克隆形成及迁移和侵袭。进一步分析表明了miR-152通过下调靶基因FGF2和ADAM17的表达[9-10],从而抑制NSCLC的增殖和侵袭。虽然对NSCLC肿瘤中miR-152的研究较多,但对NSCLC患者外周血中miR-152研究较少,作者的研究填补了这一空缺,也证实miR-152在NSCLC患者血清中的表达与之前组织中的报道一致,均显著减少。但是因为本研究所选用的样本数较少,所以研究结果还带有一定的局限性。
综上所述,本研究发现miR-152在NSCLC患者的血清中表达显著减少。检测外周血中miR-152的可作为一种无创性、快速的诊断工具,用于筛选患NSCLC的个体。下一步笔者将收集更多患呼吸道疾病的血清样本,进一步确定miR-152的表达是否可作为一个潜在的预测NSCLC的生物标志物。
[1]Mellema WW,Burgers SA,Smit EF.Tumor flare after start of RAF inhibition in KRAS mutated NSCLC:a case report[J].Lung Cancer,2015,2(87):201-203.
[2]Blanchon F,Grivaux M,Asselain B,et al.4-year mortality in patients with non-small-cell lung cancer:development and validation of a prognostic index[J].Lancet Oncol,2006,7(10):829-836.
[3]International EI,Henschke CI,Yankelevitz DF,et al.Survival of patients with stage I lung cancer detected on CT screening[J].N Engl J Med,2006,17(355):1763-1771.
[4]Jia LF,Wei SB,Gong K,et al.Prognostic implications of micoRNA miR-195 expression in human tongue squamous cell carcinoma[J].PLoS One,2013,8(2):e56634.
[5]Sandhu R,Rivenbark AG,Mackler RM,et al.Dysregulation of microRNA expression drives aberrant DNA hypermethylation in basal-like breast cancer[J].Int J Oncol,2014,44(2):563-572.
[6]Rutnam ZJ,Yang BB.The involvement of microRNAs in malignant transformation[J].Histol Histopathol,2012,27(10):1263-1270.
[7]Winter J,Jung S,Keller S,et al.Many roads to maturity:microRNA biogenesis pathways and their regulation[J].Nat Cell Biol,2009,11(3):228-234.
[8]Chen Y,Song YX,Wang ZN.The microRNA-148/152 family:multi-faceted players[J].Mol Cancer,2013,12:43.
[9]Cheng Z,Ma R,Tan W,et al.MiR-152 suppresses the proliferation and invasion of NSCLC cells by inhibiting FGF2[J].Exp Mol Med,2014,46(1):e112.
[10]Su Y,Wang Y,Zhou H,et al.MicroRNA-152 targets Adam17 to suppress NSCLC progression[J].FEBS Lett,2014,588(10):1983-1988.
[11]Leuenberger N,Robinson N, Saugy M.Circulating miRNAs:a new generation of anti-doping biomarkers[J].Anal Bioanal Chem,2013,30(405):9617-9623.
[12]Morley-Smith AC,Mills A,Jacobs S,et al.Circulating microRNAs for predicting and monitoring response to mechanical circulatory support from a left ventricular assist device[J].Eur J Heart Fail,2014,16(8):871-879.
[13]Huang J,Wang Y,Guo Y,et al.Down-regulated microRNA-152 induces aberrant DNA methylation in hepatitis B virus-related hepatocellular carcinoma by targeting DNA methyltransferase 1[J].Hepatology,2010,52(1):60-70.
[14]Chen Y,Song Y,Wang Z,et al.Altered expression of MiR-148a and MiR-152 in gastrointestinal cancers and its clinical significance[J].J Gastrointest Surg,2010,14(7):1170-1179.
Serum microRNA-152 expression and its clinical significance in patients with non-small cell lung cancer
QiangYong,YangNan,ZhangLei,LiPeng,LiuKai,WuHaiwei,ShenYi,LiZhongdong△
(DepartmentofCardiothoracicSurgery,NanjingGeneralHospitalofNanjingMilitaryCommand,Nanjing,Jiangsu210002,China)
microRNA-152;carcinoma,non-small cell lung;R7-PCR;Roc curve
强勇(1978-),主治医师,硕士,主要从事肺癌基础与临床研究。△
R735.1
A
1671-8348(2016)28-3956-03
2016-06-05
2016-07-20)
