3D打印辅助体外开窗支架技术治疗Stanford B型主动脉夹层1例报道
2016-11-21汤凯丰朱杰昌范海伦张益伟胡凡果罗宇东戴向晨
汤凯丰 朱杰昌 冯 舟 范海伦 张益伟 胡凡果 罗宇东 戴向晨
天津医科大学总医院血管外科,天津 300070
3D打印辅助体外开窗支架技术治疗Stanford B型主动脉夹层1例报道
汤凯丰 朱杰昌 冯 舟 范海伦 张益伟 胡凡果 罗宇东 戴向晨*
天津医科大学总医院血管外科,天津 300070
3D打印;开窗技术;Stanford B型主动脉夹层
开窗支架技术是治疗此类主动脉夹层的一种有效的微创手术方式。其与去分支杂交手术相比,具有减少手术创伤及颅脑并发症的优势;与烟囱技术相比,可有效减少内漏、逆撕及烟囱支架闭塞等并发症;与分支支架技术相比,支架不需定制、容易获取且释放操作相对简单。开窗支架技术可分为体外开窗及原位开窗2种方式。原位开窗技术在术中将阻断分支动脉血流、术中开窗破膜可能会造成远端动脉栓塞,均可能造成弓上动脉闭塞而引起颅脑缺血并发症。体外开窗虽然技术难度略高,但不存在以上问题,具有一定的可操作性和稳定性。其技术成功最关键的因素是开窗位置的准确性,这取决于术前的测量结果。采用3D打印模型可在直视下了解病变解剖学情况[1],在体外开窗过程中比传统的CT工作站测量手段更加直接和准确,使开窗过程更为简洁与准确。天津医科大学总医院血管外科近期已完成11例开窗TEVAR治疗Stanford B型主动脉夹层病例,其中应用3D打印技术辅助体外开窗1例,报道如下。
1 临床资料
1.1病例资料
患者58岁,中年男性,因“胸背部疼痛伴呕吐15 h”入院。入院后查胸腹主动脉CTA并行三维重建,结果见图1。 CT工作站测量结果显示:主动脉第1破口距LSA开口远端仅8.0 mm,第2破口距LSA开口远端14.0 mm,且逆撕血肿已累及LSA,左颈总动脉对应主动脉弓平均直径为29.8 mm,左颈总动脉距LSA为10.0 mm,LSA直径为9.0 mm,对应主动脉弓平均直径为26.6 mm。降主动脉真腔受压严重,夹层累及整个降主动脉、右侧髂总动脉以及右髂外动脉近端,压迫腹腔干及右肾动脉,重要分支无假腔供血。
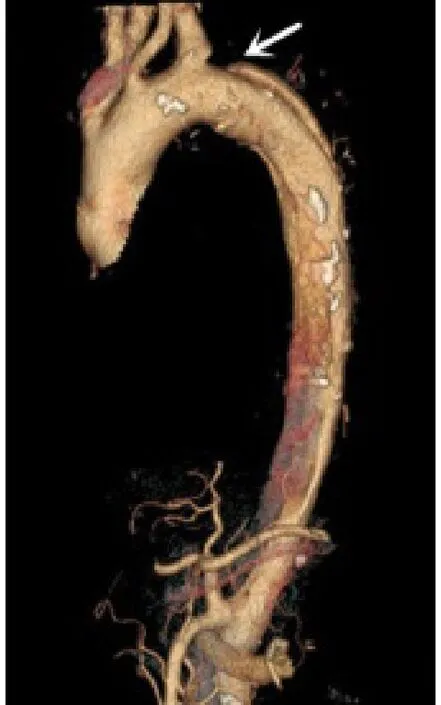
图1 术前CTA三维重建结果
1.2建立模型
采用GE Discovery CT750 HD行胸腹CTA检查,扫描范围包括整个夹层累及范围,从主动脉弓上缘至耻骨联合水平,扫描条件:管电流280 mA、管电压120 kV,扫描数据以DICOM格式导出,进行三维重建。提取病变部分,包括主动脉弓及部分降主动脉,进行3D打印(图2)。

图2 3D打印完成的主动脉夹层模型
1.3模型评估
3D打印模型辅助评估要点如下:⑴ 对比3D模型与胸腹CTA三维重建结果的测量值是否一致,整体观察主动脉破口及重要分支位置;⑵ 了解主动脉弓形态,评估支架释放位置;⑶ 模拟真腔大小,评估选用支架直径;⑷ 评估支架释放后与LSA及夹层的解剖关系,即开窗后LSA的血供情况。
3D打印模型测量结果:主动脉第1破口位于LSA左侧8 mm,且逆撕血肿累及LSA,左颈总动脉对应主动脉弓直径为30 mm,左颈总动脉距LSA为10 mm,LSA直径为9 mm,对应主动脉弓直径为27 mm,真腔受压严重,最窄处仅6 mm。3D打印模型与CT工作站的测量结果基本一致,并且更加直接地观察了主动脉夹层与LSA的解剖关系以及真腔受压情况。
2 结果
2.1拟定手术方案
根据3D打印模型与CT工作站的测量结果拟定手术方案:⑴ 动脉夹层第1破口距离LSA仅8 mm,而且有血肿逆撕至LSA,为增加支架的近端健康锚定区距离,拟于手术中将支架覆膜端释放于左颈总动脉开口远端,覆盖LSA,根据3D打印模型在覆膜支架上开窗,拟于手术中经开窗置入LSA分支支架;⑵ 夹层累及整个降主动脉、压迫腹腔干近端以及右肾动脉,真腔狭窄,术中拟置入腹主动脉裸支架扩张真腔。
2.2实际手术情况
手术在全麻下进行,穿刺左肱动脉,置入4 F鞘,导丝导管配合将猪尾导管置于升主动脉,造影示主动脉夹层(Stanford B型),第1破口位于LSA左侧0.8 cm(图3A)。以Seldinger技术穿刺左侧股总动脉(CTA示夹层累及右侧髂总动脉和右侧髂外动脉近端),导丝导管配合将金标猪尾导管置于腹主动脉,造影证实为真腔,且真腔重度狭窄,沿真腔将导管向上送入升主动脉。术中根据CTA以及3D打印模型结果,使用Relay32-28-200 mm覆膜支架进行开窗,于开窗内自内向外置入1根直径0.014 in(0.36 mm)的导丝作为牵引导丝,并回装入导鞘内。自左股总动脉处交换特硬导丝后,撤除金标导管及导鞘,于腹主动脉区置入24-80 mm裸支架1枚,打开真腔。沿左肱动脉入路置入导丝、导管至左股动脉引出。将预置导丝送入左肱动脉导管引出备用,沿特硬导丝置入开窗支架,定位于左颈总动脉开口远端,开窗位置对应LSA,造影定位后释放(图4)。再沿预置导丝置入10-40 mm裸支架1枚,定位于LSA与开窗支架内,支架进入覆膜支架内约1 cm,并后扩张。术后造影见覆膜支架与分支支架位置良好,主动脉夹层第1破裂口封堵良好,近端夹层消失,无内漏(图3B),胸腹主动脉真腔较前明显扩张(图5),LSA以及腹主动脉各重要分支血流通畅。
2.3术后复查
患者于术后3个月行胸腹主动脉CTA,其结果显示:支架位置良好,未发生位移、断裂。近端夹层消失,第1破口封堵良好,未见内漏及逆撕,LSA及其他重要分支血流通畅(图6)。
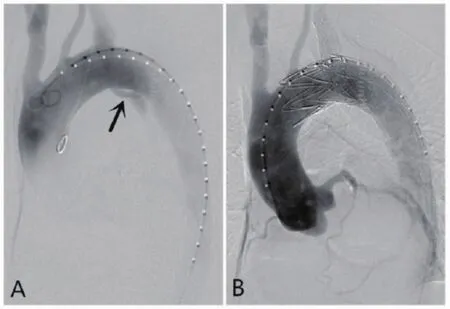
图3 主动脉弓术中造影
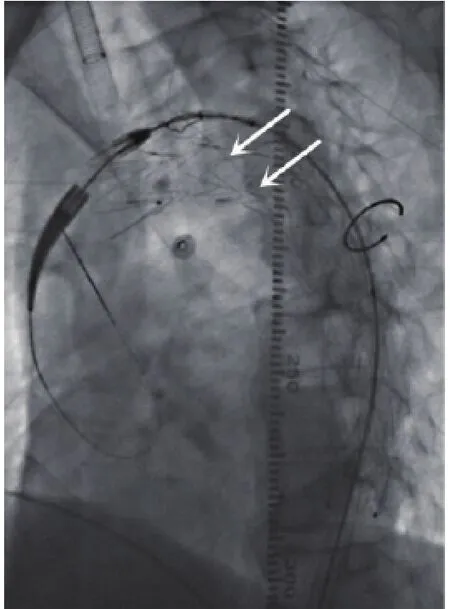
图4 开窗支架释放过程

图5 术中造影结果

图6 术后3个月复查CTA结果
3 讨论
主动脉夹层是一种复杂而危险的心血管疾病,病情凶险且死亡率高,治疗困难且复杂。近年来,随着CT、MR等各项技术的常规开展以及诊断水平的不断提高,其检出率和发病率呈逐年升高的趋势。国外相关统计资料显示,主动脉夹层的发病率达10~29/100万[2]。1970年,Stanford大学Daily教授等[3]提出根据是否累及升主动脉将主动脉夹层分为Stanford A型和Stanford B型,B型即为病变范围起源于降主动脉,且未累及升主动脉和主动脉弓的夹层。
采用何种方式治疗Stanford B型夹层一直是临床工作的难点,Dake等[4]于1994年首先报道采用TEVAR治疗Stanford B型主动脉夹层,TEVAR因其能有效避免开腹手术导致的麻醉意外、主动脉邻近结构脏器的损伤,以及大量出血导致的输血、感染等后期损伤,已逐渐成为治疗Stanford B型主动脉夹层的主要治疗方式。然而,单纯的TAVER并不适用于所有的Stanford B型夹层,主要原因是缺乏足够的近端锚定区,包括近端锚定区不足(夹层第1破口距LSA开口远端距离<15 mm)和近端锚定区不健康(夹层第1破口距LSA开口远端距离>15 mm但逆撕夹层或血肿已累及至LSA)。此时,单纯的TAVER必然影响LSA的血供。虽然当右侧的椎动脉为优势动脉且颅内Willis环完整时,可直接覆盖LSA,但在Cooper等[5]的系统性荟萃分析中,LSA覆盖402例,4.7%的患者出现脑血管意外。因此重建LSA以获得足够近端锚定区是当前治疗锚定区不足或者锚定区不健康的Stanford B型夹层的重要技术要求,也是当前TEVAR面临的难题,当前重建LSA的技术主要包括:⑴ 去分支杂交技术,最常见的术式为左颈总动脉-左锁骨下动脉人工血管旁路术+近端左锁骨下动脉结扎术。这种方式简单可靠,但需要杂交手术室,很多地区尚不具备条件,并且增加了手术创伤和费用。⑵ 烟囱技术,即在LSA释放1枚与主动脉覆膜支架平行的支架,从而保证LSA的血供,但易发生内漏、逆撕和烟囱支架闭塞等并发症。⑶ 分支支架技术,Inoue等[6]首次报告了采用一体化分支型主动脉覆膜支架的技术,但该研究中分支支架被拉入LSA时会对动脉内壁造成损伤。同时,分支支架需要定制,增加了不必要的术前准备时间,且支架释放困难。⑷ 开窗技术,包括原位开窗和体外开窗技术。原位开窗技术,即支架覆盖后,通过左肱动脉逆向在覆膜支架上开窗,再通过球囊扩张或支架保留LSA的血供。破膜方式包括导丝导管破膜和激光破膜,不论哪种破膜方式,破膜后的碎片都无法有效控制,可能会造成动脉栓塞,且可能影响支架的使用寿命。另外,释放覆膜支架后阻断了分支动脉的血流,可能引起颅脑缺血等并发症。体外开窗技术,即根据术前测量结果,在支架上预留对应LSA的开口。虽然在操作上有一定的难度,但是体外开窗技术不存在上述问题。
体外开窗技术能否成功,十分依赖于术前测量的准确性以及术中支架释放位置的准确。而3D打印技术的出现,为体外开窗技术的术前测量提供了一个直观和有形的3D制作模型,超越了一个简单的屏幕上的三维重建[7]。其最为显著的优势在于将夹层病变部位的解剖学情况可视化,并模拟了支架植入前后与临近结构的关系。术前运用3D打印模型精确定位,可准确评估夹层与邻近结构的解剖关系,恰好弥补了开窗技术的不足,减少了由测量不准确而导致对位不准的可能性,精确的测量结果也为手术支架的选择提供了依据[8]。相比于传统的CT工作站测量数据,运用3D打印模型测量简单直接,受个人因素影响小,结果更为准确。
但3D打印模型也存在其自身的缺点,3D打印材料主要包括工程塑料、光敏树脂、橡胶类材料、金属材料和陶瓷材料等[9],目前,国内外尚不具备真实模拟血管的材料。材料本身的限制,使模型仅在外形上复制了主动脉病变的关注部分,而本身并不具备真实模拟术中导丝在腔内的走行,也难以真实反应支架释放后对主动脉及其重要分支的压迫,尤其难以还原血流冲击情况。同时,设备与材料价格高昂,使3D打印并不具备规模经济的优势[10]。
现阶段而言,3D打印技术在心血管、骨科、泌尿外等领域多有报道[11-15],而对于Stanford B型主动脉夹层的治疗鲜有运用。本次报道探索了3D打印在辅助体外开窗技术治疗主动脉夹层中所起的作用,着重探讨了3D打印模型构建主动脉夹层关注部分的解剖关系以及对手术方案制定的辅助作用。3D打印技术使CTA三维重建结果转化为可视的、可触的结构关系,测量更加简单而直接,有效避免了体外开窗技术因测量不准导致的对位问题,成功地辅助体外开窗技术完成了Stanford B型主动脉夹层的治疗。
笔者所报道的主动脉夹层1例,其3D打印模型与三维重建测量结果接近,在主动脉夹层治疗中,在确定支架释放位置、选用支架直径、评估支架释放后LSA血供等方面提供了重要的参考。就单点开窗来说,3D打印所发挥的作用并非不可替代,仅凭借CT工作站的测量数据即能很好地确定开窗位置;当然,对于更加复杂的主动脉夹层,需要了解多个破口之间以及重要分支的解剖关系,需要多点开窗,仅凭借三维重建结果可能会大大增加测量的难度、降低测量的准确性,此时借助3D打印模型进行评估则显得至关重要。精确的测量甚至可能为体外开窗技术治疗部分Stanford A型夹层提供帮助。同时,3D打印材料的发展使得今后真实模拟血管与支架力学变化成为可能。相信3D打印技术的逐步发展,能使其成为主动脉夹层腔内治疗术前评估中的重要手段。
[1]李鉴轶. 3D打印技术促进临床医学发展[J]. 中国临床解剖学杂志,2014,(3):241-242.
[2]Meszaros I, Morocz J, Szlavi J, et al. Epidemiology and clinicopathology of aortic dissection[J]. Chest, 2000, 117 (5): 1271-1278.
[3]Daily PO, Trueblood HW, Stinson EB, et al. Management of acute aortic dissections[J]. Ann Thorac Surg, 1970, 10 (3): 237-247.
[4]Dake MD, Miller DC, Semba CP, et al. Transluminal placement of endovascular stent-grafts for the treatment of descending thoracic aortic aneurysms[J]. N Engl J Med, 1994,331 (26): 1729-1734.
[5]Cooper DG, Walsh SR, Sadat U, et al. Neurological complications after left subclavian artery coverage during thoracic endovascular aortic repair: a systematic review and meta-analysis[J]. J Vasc Surg, 2009, 49 (6):1594-1601.
[6]Inoue K, Sato M, Iwase T, et al. Clinical endovascular placement of branched graft for type B aortic dissection[J]. J Thorac Cardiovasc Surg, 1996, 112 (4): 1111-1113.
[7]Kim GB, Lee S, Kim H, et al. Three-Dimensional Printing: Basic Principles and Applications in Medicine and Radiology[J]. Korean J Radiol, 2016, 17 (2): 182-197.
[8]Müller-Eschner M, Rengier F, Partovi S, et al. Accuracy and variability of semiautomatic centerline analysis versus manual aortic measurement techniques for TEVAR[J]. Eur J Vasc Endovasc Surg, 2013, 45 (3): 241-247.
[9]李涤尘,田小永,王永信,等. 增材制造技术的发展[J].电加工与模具,2012,(S1):20-23.
[10]曾昆. 3D打印的材料之殇[J]. 新材料产业,2014,(10):39-41.
[11]Kurenov SN, Ionita C, Sammons D, et al. Three-dimensional printing to facilitate anatomic study, device development,simulation, and planning in thoracic surgery[J]. J Thorac Cardiovasc Surg, 2015, 149 (4): 973-979.
[12]Schmauss D, Haeberle S, Hagl C, et al. Three-dimensional printing in cardiac surgery and interventional cardiology: a single-centre experience[J]. Eur J Cardiothorac Surg, 2015, 47 (6): 1044-1052.
[13]Youssef RF, Spradling K, Yoon R, et al. Applications of three-dimensional printing technology in urological practice[J]. BJU Int, 2015, 116 (5): 697-702.
[14][14]Shi D, Liu K, Zhang X, et al. Applications of threedimensional printing technology in the cardiovascularfield[J]. Intern Emerg Med, 2015, 10 (7): 769-780.
[15]Zhou Z, Buchanan F, Mitchell C, et al. Printability of calcium phosphate: calcium sulfate powders for the application of tissue engineered bone scaffolds using the 3D printing technique[J]. Mater Sci Eng C Mater Biol Appl, 2014, 38: 1-10.
R543.1
A
10.19418/j.cnki.issn2096-0646.2016.05.21
戴向晨,E-mail:13302165917@163.com
