结缔组织生长因子介导动脉粥样硬化易损斑块的形成及机制研究
2016-11-21周心涛赵黎丙闵新文郎明健
周心涛,赵黎丙,闵新文,陈 娇,郎明健
结缔组织生长因子介导动脉粥样硬化易损斑块的形成及机制研究
周心涛,赵黎丙,闵新文,陈 娇,郎明健
目的 探讨结缔组织生长因子(CTGF)介导动脉粥样硬化易损斑块的形成及机制。方法 2011年8月—2015年2月选择在湖北医药学院附属东风医院诊治的动脉粥样硬化脑梗死病人72例作为病例组,同期选择健康体检者72名作为对照组,两组均进行颈动脉超声检测,判断动脉内-中膜厚度(IMT)和动脉粥样硬化易损斑块形成状况,同时进行血清CTGF含量与炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)含量的检测,分析血清CTGF含量与颈动脉粥样硬化易损斑块形成的相关性。结果 病例组中易损斑块检出率83.3%,对照组中易损斑块检出率为2.8%,两组间易损斑块检出率差异有统计学意义(P<0.01);病例组IMT值明显高于对照组(P<0.05)。病例组与对照组血清CTGF含量分别为(189.24±45.33)ng/L和(15.45±2.89)ng/L,病例组CTGF含量明显高于对照组(P<0.01)。病例组血清TNF-α、IL-6和IL-1β浓度明显高于对照组(P<0.05或P<0.01)。有斑块组血清CTGF含量(203.55±47.11)ng/L,明显高于无斑块组的(9.14±3.11)ng/L(t=65.584,P<0.01);直线相关分析显示:血清CTGF含量与IMT呈正相关(r=0.692,P<0.05),也与血清TNF-α(r=0.322,P<0.05)、IL-6(r=0.422,P<0.05)和IL-1β(r=0.309,P<0.05)浓度呈正相关。结论 CTGF在颈动脉粥样硬化性脑梗死中呈现高表达状态,且能有效影响炎症因子的表达,从而介导动脉粥样硬化易损斑块的形成。
动脉粥样硬化;结缔组织生长因子;脑梗死;易损斑块;炎症因子
脑血管病是指因脑血管破裂或脑血栓形成而产生脑部出血性或缺血性损伤的临床症状,其病理基础在于形成动脉粥样硬化易损斑块[1-2]。动脉粥样硬化易损斑块会使得颈内动脉和总动脉管腔狭窄,进而显著提高脑梗死和脑缺血的发生率和危险性,是导致脑血管病病人死亡与致残的主要原因[3]。有学者常常将易损斑块作为评估全身动脉粥样硬化病变情况的指标,同时将其作为评价脑血管病可能发生率的关键危险因素[4]。结缔组织生长因子(CTGF)拥有多种生理功能,主要包括调节血管生成、调节细胞外基质的生成、促进血管内膜增厚、促进有丝分裂,同时还是机体组织创伤修复的关键调节因子[5-6]。相关研究显示:CTGF可促进动脉粥样硬化,主要通过直接诱导细胞外基质生成以及结缔组织细胞分裂引起,而动脉粥样硬化又是脑梗死发生发展的重要危险因素[7-8]。本研究分析CTGF介导动脉粥样硬化易损斑块的形成及机制,现报道如下。
1 资料与方法
1.1 研究对象 2011年8月—2015年2月选择在我院诊治的动脉粥样硬化脑梗死病人72例作为病例组,纳入标准:经颅脑CT或磁共振成像(MRI)等影像学检查证实,以及根据全国脑血管病会议脑梗死标准确诊为动脉粥样硬化性脑梗死;超声检查结果显示有颈动脉粥样硬化。另设对照组72名,为健康人群。对照组和病例组在年龄、吸烟史等基线资料方面差异无统计学意义(P>0.05),详见表1。两组病人都排除肺纤维化、周围血管血栓性疾病以及其他性质疾病、严重感染、近期手术、自身免疫疾病、外伤史、严重的肝肾功能不全;且研究对象知情同意,并获得医院伦理委员会的批准。
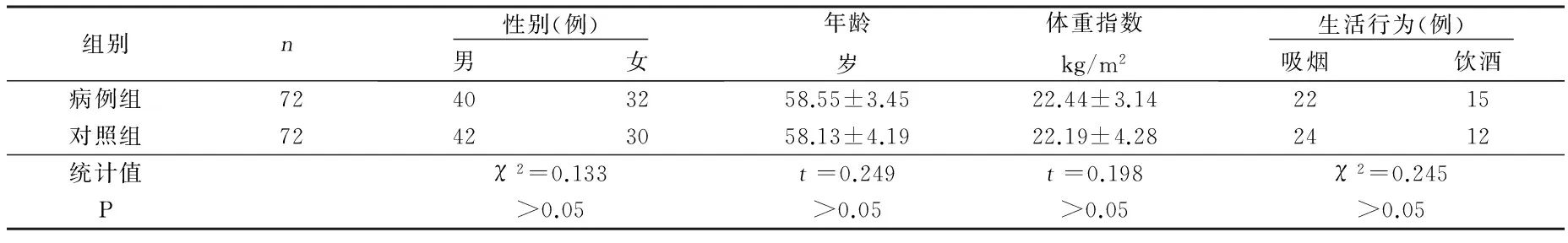
表1 两组基线资料比较
1.2 超声检测 本研究通过彩色多普勒超声检查仪来检测病人动脉粥样硬化易损斑块状况,分别对病人颈内动脉、双侧颈总动脉、颈外动脉及其分叉部分的内-中膜厚度(IMT)进行测定。正常情况下,颈动脉IMT<1.0 mm,IMT在1.0 mm~1.5mm之间为内膜增厚但未形成易损斑块,IMT≥1.5 mm表明已经形成了动脉粥样硬化易损斑块。
1.3 CTGF检测 入院24 h内抽取病例组病人4 mL静脉血,体检时对照组空腹抽取4 mL静脉血,室温放置1 h后,4 000 r/min低速离心10 min,分离得到上层血清,血清样品冻存于-70 ℃冰箱,后续通过酶联免疫吸附法(ELISA)进行CTGF检测。
1.4 炎症因子检测 取同样时间点的血清样本,采用ELISA法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)浓度。所有检测试剂盒均为美国R&D systems公司生产,从北京中山生物技术有限公司购买,实验过程严格参照说明书进行。
2 结 果
2.1 颈动脉IMT与易损斑块情况比较 经过超声检测,对照组中只有2例(2.8%)病人检测出易损斑块,而病例组有60例(83.3%)病人检测出斑块,两组间斑块检出率差异有统计学意义(P<0.01);病例组的IMT值明显高于对照组(P<0.05)。详见表2。
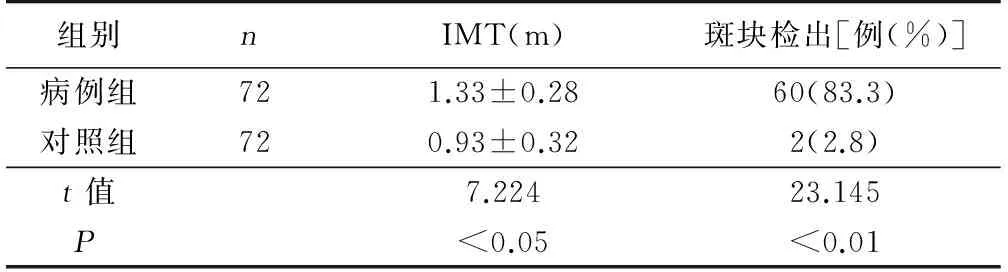
表2 两组IMT值及斑块检出例数比较
2.2 两组血清CTGF含量比较 病例组血清CTGF含量明显高于对照组(P<0.01)。详见表3。
表3 两组血清CTGF含量比较(±s) ng/L
2.3 两组血清炎症因子水平比较 病例组血清TNF-α、IL-6和IL-1β水平都明显高于对照组(P<0.05或P<0.01)。详见表3。
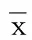
表3 两组血清炎症因子水平比较(±s) μmol/L
2.4 血清CTGF含量与颈动脉粥样硬化易损斑块形成的相关性 将所有研究对象分为无斑块组(82例)和有斑块组(62例),结果显示:有斑块组血清CTGF含量(203.55±47.11)ng/L,明显高于无斑块组的(9.14±3.11)ng/L,差异有统计学意义(t=65.584,P<0.01)。直线相关分析表明:血清CTGF含量与IMT呈正相关(r=0.692,P<0.05),也与血清TNF-α(r=0.322,P<0.05)、IL-6(r=0.422,P<0.05)和IL-1β(r=0.309,P<0.05)浓度呈正相关。
3 讨 论
随着社会的不断发展,脑血管疾病已成为严重威胁人类健康的主要疾病之一。颈动脉粥样硬化是当前多数脑血管疾病的基础病理表现,大部分病人的动脉系统都存在不同程度的损伤,常常表现为易损斑块,血管壁变厚、顺应性低和僵硬化,有比较高的致残率和死亡率[9-10]。本研究显示:病例组中易损斑块检出率83.3%,对照组中易损斑块检出率为2.8%,两组间易损斑块检出率差异有统计学意义(P<0.01);同时病例组的IMT值明显高于对照组(P<0.05),说明颈动脉粥样硬化病人多伴随有易损斑块,且颈动脉内-中膜厚度明显增加。 颈动脉粥样硬化是一个长期的演变过程,最早表现为血管通透性增大,越来越多脂蛋白可透过血管内皮细胞,接着表现为血管壁堆积大量淋巴细胞和氧化低密度脂蛋白,最后出现平滑肌细胞迁移[11]。
人类结缔组织生长因子(hCTGF)本身为一种分泌性多肽因子,富含半胱氨酸,其cDNA最早从人脐静脉内皮细胞中克隆得到,由5个外显子和4个内含子组成;人源性CTGF是通过成纤维细胞和活化的肝星状细胞的高尔基体分泌的,在细胞增殖、分化、伤口愈合以及胚胎发育方面可能发挥调节作用[12]。目前研究发现CTGF与其他生长因子和细胞因子能诱导纤维斑块的新生血管形成,促进内皮细胞的迁移和增殖,参与阻塞性血栓形成[13];随着CTGF表达水平的进一步提高,游离的CTGF可进入细胞间隙以及体循环中,从而进一步诱发血管纤维化或血管增生[14]。本研究结果显示:病例组与对照组的血清CTGF含量分别为(189.24±45.33)ng/L和(15.45±2.89)ng/L,病例组明显高于对照组(P<0.01)。表明CTGF在颈动脉粥样硬化中呈现高表达状态。
有研究表明:炎症因子TNF-α、IL-6、IL-1β能促使血管平滑肌细胞增殖,迁移并可能参与导致血管的再狭窄[15]。已知TNF-α是一种多向性的炎性介质,可以加速培养的血管平滑肌细胞的移动,并且导致一些生长因子、黏附分子、细胞因子、细胞外基质降解金属蛋白酶的表达,促进血栓形成[16]。相关研究也表明:载脂蛋白E敲除的鼠中IL-6 mRNA 在心肌损伤区域及损伤血管再狭窄区域表达明显增多,IL-1β通过上调黏附分子,可与TNF-α共同促进炎症细胞聚集和浸润;IL-1β也与TNF-α协同作用,诱导多种细胞分泌IL-6,并能增强TNF-α对靶细胞的损伤,抑制新生内膜形成[17]。本研究结果显示:病例组的血清TNF-α、IL-6和IL-1β浓度都明显高于对照组(P<0.05或P<0.01)。由此可见TNF-α、IL-6、IL-1β在颈动脉粥样硬化的形成中起了重要的作用。
作为一种细胞生理调节因子,CTGF的分泌和表达受到细胞内信号系统的精准调控。相关研究结果显示:CTGF是导致动脉粥样硬化的重要因素,可提高斑块不稳定性以及促进粥样斑块形成。文献报道通过免疫组化方法检测斑块中CTGF水平,结果显示纤维斑块中CTGF水平显著高于复杂性斑块,表明CTGF能够促使单核细胞移行到粥样硬化病变处从而促成动脉粥样硬化的形成[18]。本研究结果显示:有斑块组的血清CTGF含量为(203.55±47.11)ng/L,明显高于无斑块组的(9.14±3.11)ng/L(t=65.584,P<0.01);直线相关分析表明:血清CTGF含量与IMT呈直线正相关(r=0.692,P<0.05),也与血清TNF-α(r=0.322,P<0.05)、IL-6(r=0.422,P<0.05)和IL-1β(r=0.309,P<0.05)浓度呈正相关,说明CTGF是动脉粥样硬化易损斑块发生发展的关键诱发因素,可用于预测颈动脉病变程度和粥样硬化斑块的稳定性;抑制CTGF表达或拮抗CTGF活性可能是临床预防和治疗颈动脉粥样硬化的有效途径之一。
总之,CTGF在颈动脉粥样硬化性脑梗死中呈现高表达状况,且能有效影响炎症因子的表达,从而介导动脉粥样硬化易损斑块的形成。
[1] Beaufort N,Scharrer E,Kremmer E,et al.Cerebral small vessel disease-related protease HtrA1 processes latent TGF-β binding protein 1 and facilitates TGF-β signaling[J].Proc Natl Acad Sci USA,2014,111(46):16496-16501.
[2] 刘学文,白学琴,韩轩茂,等.急性白血病治疗前后骨髓中VEGF、CTGF mRNA水平的研究[J].肿瘤防治研究,2015,42(4):359-362.
[3] 孙龙飞,安冬青.他汀类药物的多效性作用在抗动脉粥样硬化机制中的研究进展[J].中西医结合心脑血管病杂志,2015,13(4):453-457.
[4] Mao Q,Lin CX,Liang XL,et al.Mesenchymal stem cells overexpressing integrin-linked kinase attenuate cardiac fibroblast proliferation and collagen synthesis through paracrine actions[J].Mol Med Rep,2013,7(5):1617-1623.
[5] 李梅芳,陈平,文颂.动脉粥样硬化斑块的磁共振成像分子影像学研究进展[J].中华心血管病杂志,2015,43(4):371-373.
[6] 张白,惠品晶,国风,等.CD40及基质金属蛋白酶在颈动脉内膜剥脱术斑块中的表达及影响斑块稳定性的研究[J].中华神经外科杂志,2015,31(1):84-87.
[7] Edwards LA,Woolard K,Son MJ,et al.Effect of brain- and tumor-derived connective tissue growth factor on glioma invasion[J].J Natl Cancer Inst,2011,103(15):1162-1178.
[8] 余杨,邹书帆,马杰,等.KLF15基因对压力超负荷所致心肌纤维化的调控作用[J].中华胸心血管外科杂志,2015,31(7):415-418.
[9] 刘波,黄晓帆,李冬寒,等.环磷酸腺苷抑制结缔组织生长因子表达对小鼠心肌梗死后心肌纤维化的影响[J].中华实验外科杂志,2015,32(8):1826-1830.
[10] Cozzolino M,Biondi ML,Banfi E,et al.CCN2 (CTGF) gene polymorphism is a novel prognostic risk factor for cardiovascular outcomes in hemodialysis patients[J].Blood Purif,2010,30(4):272-276.
[11] 黄清,刘小娟,冯洁,等.TNFSF4基因多态性RS3861950与无症状颈动脉易损斑块易感性研究[J].中华流行病学杂志,2015,36(9):998-1001.
[12] 王新,王康琪,包勤文,等.瑞舒伐他汀对老年颈动脉易损斑块的干预研究[J].中华老年心脑血管病杂志,2015,17(6):586-590.
[13] McCurdy SM,Dai Q,Zhang J,et al.SPARC mediates early extracellular matrix remodeling following myocardial infarction[J].Am J Physiol Heart Circ Physiol,2011,301(2):497-505.
[14] 田晋帆,葛长江,吕树铮,等.基质交感分子1在载脂蛋白E基因敲除小鼠动脉粥样硬化斑块形成中的作用[J].中华老年心脑血管病杂志,2015,17(2):183-187.
[15] 管懋彬,赵锡海,杜芳,等.卒中相关的粥样硬化易损斑块的病理与分布特点研究进展[J].中国卒中杂志,2015,3(22):243-247.
[16] Kato T,Mizuguchi N,Ito A.Blood pressure,renal biochemical parameters and histopathology in an original rat model of essential hypertension (SHRSP/Kpo strain)[J].Biomed Res,2015,36(3):169-177.
[17] 曹亦宾.易损动脉粥样硬化斑块与缺血性卒中[J].中国卒中杂志,2015,3(16):197-204.
[18] 李凤,李淮玉.颈动脉粥样硬化斑块易损性的临床评估手段[J].中国脑血管病杂志,2015,8(24):443-448.
(本文编辑郭怀印)
2009年湖北省科技厅课题(No.791)
湖北医药学院附属东风医院(湖北十堰 442000)
朗明健,E-mail:langmingjian993@163.com
R543.5 R256.2
B
10.3969/j.issn.1672-1349.2016.19.023
1672-1349(2016)19-2281-04
2016-02-21)
引用信息:周心涛,赵黎丙,闵新文,等.CTGF介导动脉粥样硬化易损斑块的形成及机制研究[J].中西医结合心脑血管病杂志,2016,14(19):2281-2284.
