东北林蛙GSK3β基因荧光定量PCR引物筛选体系的建立
2016-11-20巩珊珊柴龙会张晶钰肖向红
张 宇 巩珊珊 柴龙会 张晶钰 肖向红
(东北林业大学野生动物资源学院,哈尔滨,150040)
东北林蛙GSK3β基因荧光定量PCR引物筛选体系的建立
张 宇 巩珊珊 柴龙会 张晶钰 肖向红*
(东北林业大学野生动物资源学院,哈尔滨,150040)
稿件运行过程
GSK3β;荧光定量PCR;引物
为探究低温条件下东北林蛙(Ranadybowskii)肝脏中GSK3β基因表达量变化,需利用荧光定量PCR(Fluorescence quantitative real-time PCR)对GSK3β基因表达量进行检测,而在此过程中PCR引物的筛选直接影响到检测结果数据的准确性与真实性。本实验以东北林蛙为实验对象,基于本研究组前期获得的东北林蛙转录组数据库,并参考其他物种GSK3β基因,利用Beacon Designer 7软件设计了6对引物,采用逆转录PCR和实时荧光定量PCR技术,筛选出1对GSK3β基因荧光定量PCR引物(F- TCCTACATCTGCTCTCGGTA,R- ACATCTATGCTGGAGGTATAATCA),其扩增效率为E=99.3%、R2=0.998,可用于东北林蛙GSK3β基因实时表达量的研究。
东北林蛙广泛分布在中国东北三省亚寒带地区和内蒙古地区[1],作为典型耐寒两栖类,其抗冻保护机制具有重要研究价值。杨翠军等研究结果显示,东北林蛙在低温状态下可通过降低糖原含量来提高血糖从而达到抗冻目的[2-3]。GSK3β作为胰岛素信号通路重要磷酸化酶,在整个糖代谢过程中起到承上启下的作用。Dieni等人通过免疫蛋白印迹法(Western blot)证实低温使美洲木蛙(Ranasylvatica)体内GSK3β基因磷酸化能力增强,与底物发生强烈反应从而抑制糖原合成酶GS(Glycogen synthetase)活性,使蛙体内血糖维持在较高水平[4]。东北林蛙体内是否存在GSK3β基因且其在蛙耐冻过程中扮演着何种角色更具研究意义。为了确保检测GSK3β基因mRNA表达量变化的数据结果真实有效[5],本实验以东北林蛙为实验对象,基于本研究组前期获得的东北林蛙转录组数据库,并参考其他物种GSK3β基因,利用Beacon Designer 7软件设计出多对引物,采用逆转录PCR和实时荧光定量PCR技术,筛选出1对或数对扩增效果好的GSK3β基因荧光定量PCR引物,旨在为测定东北林蛙mRNA实时表达量的研究奠定基础。
1 材料与方法
1.1 材料
东北林蛙,2~3龄成年雄性3只,2014年10月采于黑龙江省哈尔滨方正县地区,室温暂养1周后备用。
1.2 方法
1.2.1 东北林蛙组织取样
对东北林蛙进行双毁髓处死,并迅速分离肝脏组织,加入样品保存液(宝生物工程公司)放入液氮中待完全冰冻后移入-80℃冰箱进行保存以备后续实验。
1.2.2 GSK3β荧光定量PCR引物设计
基于本研究组前期获得的东北林蛙转录组数据库,并与NCBI Genebank数据库中非洲爪蟾(Xenopus laevis)GSK3β核酸序列进行比对得出保守序列,使用软件Beacon Designer 7设计用于实时荧光定量PCR实验的引物6对及内参引物GAPDH 1对(表1)。

表1 GSK3β基因荧光定量PCR备选引物序列
1.2.3 总RNA提取与cDNA的合成
按照TRIZOL®Reagent说明书,提取东北林蛙肝脏总RNA,琼脂糖凝胶电泳和紫外分光光度计检测其完整性和浓度。用于PCR反应的cDNA按照逆转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,日本)进行。将所得逆转录反应液即cDNA样品放置于-20℃保存备用。
1.2.4 RT-PCR检测及电泳检查引物
按照2×Taq Master Mix说明书,以反转录试验所获cDNA为模板进行PCR试验。PCR扩增获得所需片段,电泳检测其条带质量,切胶回收进行测序分析。
1.2.5 荧光定量PCR检测引物及最适退火温度
荧光定量PCR以CFX96TM Real-Time System(Bio-Rad,美国)为实验平台,使用10倍稀释的上述cDNA样品为模板进行实时荧光定量PCR反应,绘制标准曲线(Fluorescence quantitative PCR standard curve)。根据标准曲线的建立筛选机制,并根据熔解曲线(Fluorescence quantitative PCR melting curve)峰值的单一性确定引物的特异性进而确定荧光定量PCR最适引物。
2 结果
2.1 总RNA的提取
通过紫外分光光度计检测所提取的东北林蛙肝脏组织总RNA的OD值及样品浓度,结果显示各样品OD260nm/OD280nm均在1.8~2.0之间。用15 g/L琼脂糖凝胶电泳检测总RNA质量可见28S、18S、5SRNA清晰条带(图1),说明样本无蛋白质污染,RNA没有降解,质量符合试验要求,可以进行后续试验。
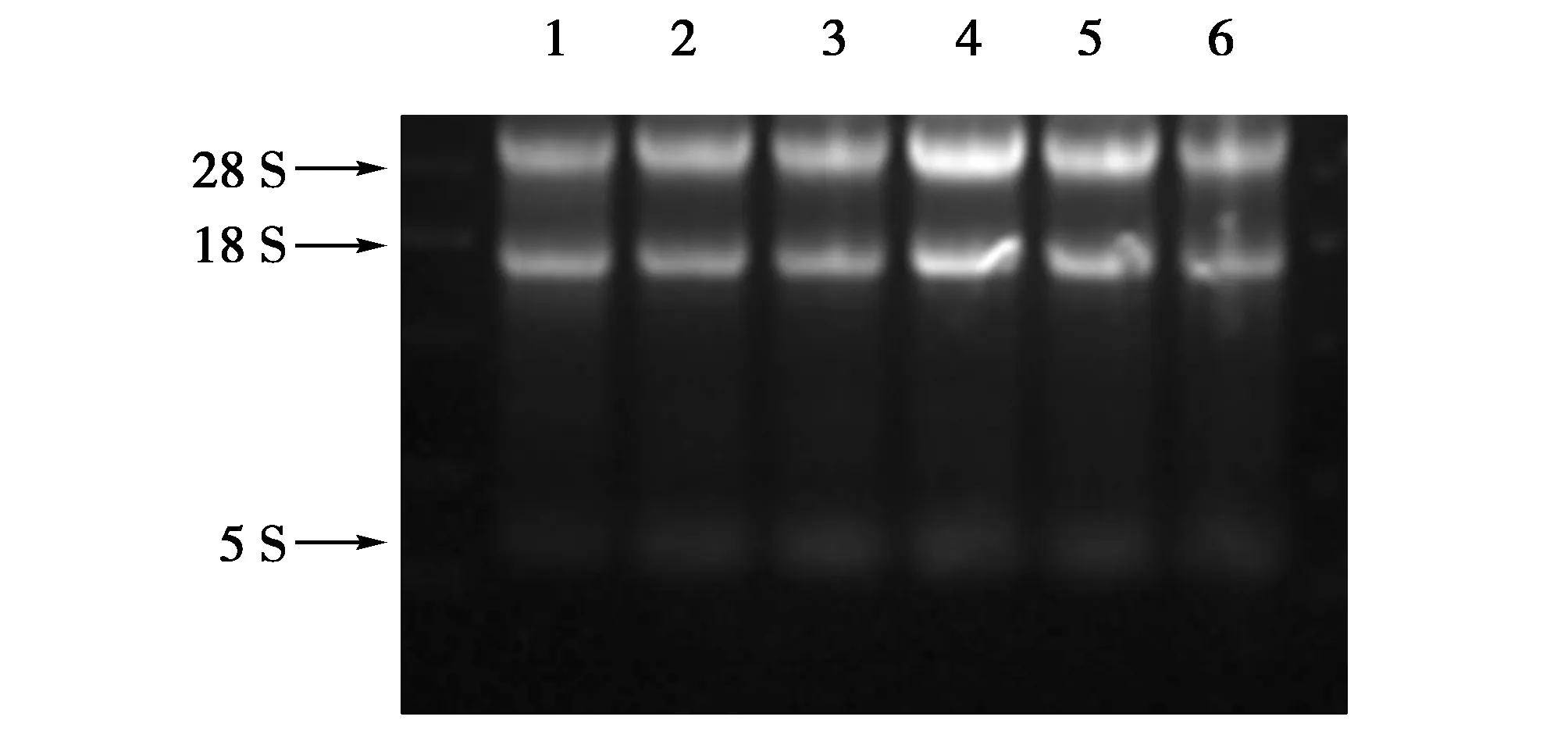
图1 东北林蛙肝脏组织总RNA电泳图Fig.1 Results of total RNA in liver of Rana dybowskii
2.2 东北林蛙肝脏GSK3β引物RT-PCR扩增结果
使用400 ng东北林蛙肝脏总RNA进行扩增实验,对实验得出的6对引物进行编码,可见6对引物(1号~6号)中有4对引物(2号、4号、5号、6号)出现明亮清晰条带,说明东北林蛙肝脏组织中存在GSK3β基因,而1号引物出现多条条带,推测引物特异性不强或存在引物二聚体;3号引物条带不明显推测引物扩增出条带浓度较低(图2)。且2号、4号、5号、6号引物得出条带长度与设计引物时片段大小相吻合,经测序得出条带的核苷酸序列与高通量测序与Genebank里的对比得出的保守序列一致。条带单一、无引物二聚体及杂带的特异性引物(2号、4号、5号、6号)均初步满足后续荧光定量PCR的条件。
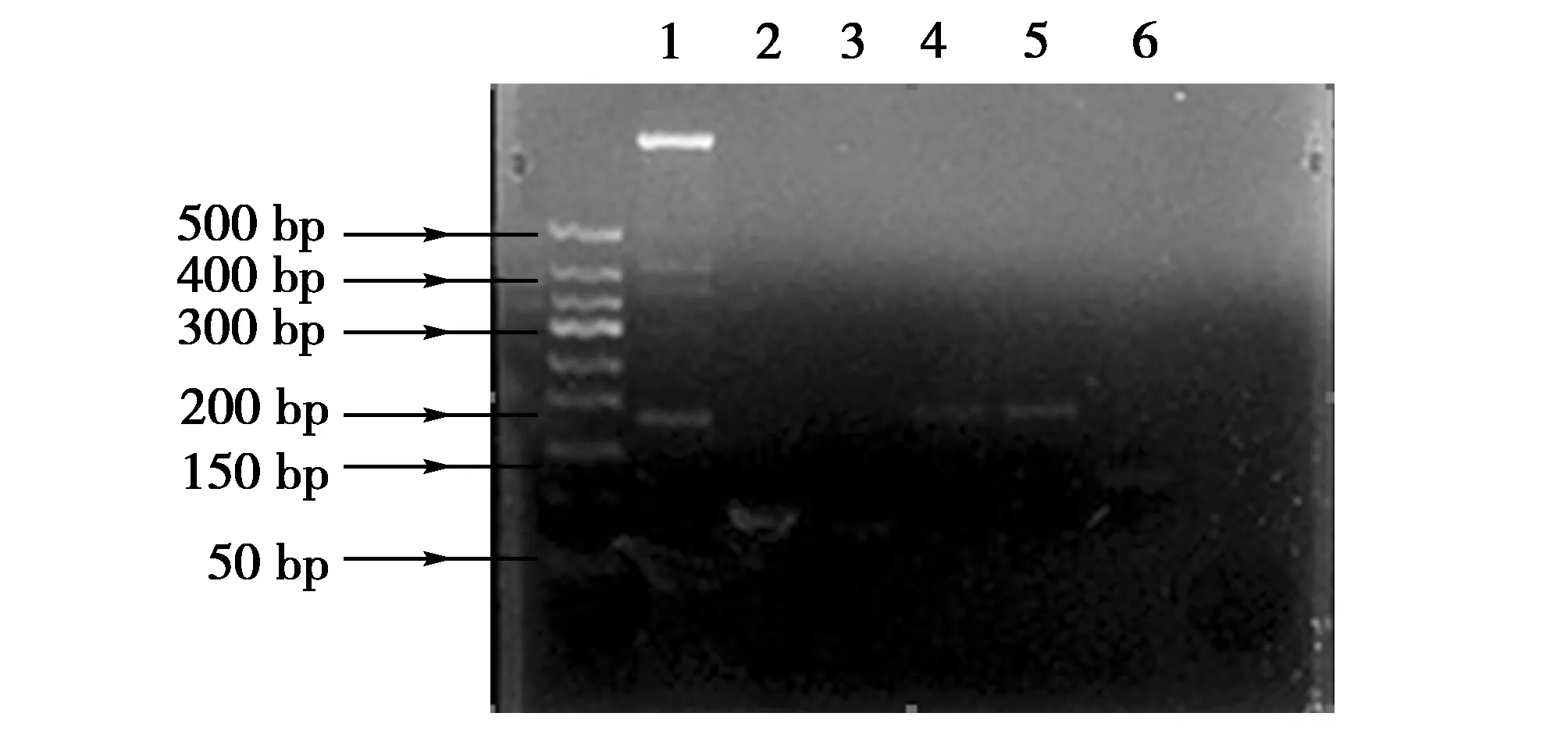
图2 RT-PCR 扩增结果Fig.2 RT-PCR results
2.3 东北林蛙肝脏GSK3β引物标准曲线建立
根据上述实验结果得知,2号、4号、5号、6号引物初步满足荧光定量PCR GSK3β基因所需特异性引物的条件,实时荧光定量PCR绘制的标准曲线由CFX Manager软件(Bio-Rad,美国)输出如下(图3)。
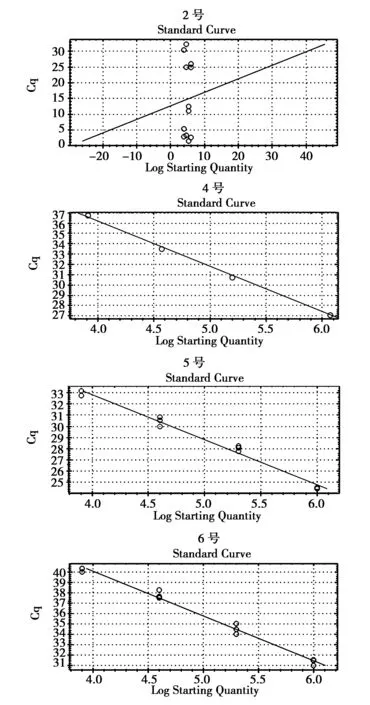
图3 东北林蛙肝脏GSK3β引物标准曲线(横坐标为初始模板量Log值,纵坐标为循环值)Fig.3 Standard curve of GSK3β in liver of Rana dybowskii
①GSK3β 2号引物标准曲线:Slope=0.429y-int=12.699(E=-99.5%,R2=0.001)
②GSK3β 4号引物标准曲线:Slope=-3.645y-int=37.841(E=99.3%,R2=0.998)
③GSK3β 5号引物标准曲线:Slope=-4.015y-int=48.894(E=77.4%,R2=0.984)
④GSK3β 6号引物标准曲线:Slope=-4.331y-int=57.448(E=70.2%,R2=0.986)
可见4号引物扩增效率为E=99.3%,且R2=0.998均满足引物扩增最佳条件。
标准曲线中扩增效率及相关系数的计算结果可看出4号引物最符合实验要求,可用于后续实验。随即观察4号引物熔解曲线,发现其峰值单一,熔解温度为81.0℃,结果表明4号引物没有产生GSK3β mRNA的非特异性扩增及引物二聚体,实验中的荧光值均来自于特异性的扩增产物。
3 讨论
自1996年荧光定量PCR被美国Applied Biosystems作为一种新定量技术推出后,因其特异性强,自动化程度高等特点被广泛利用[6-7],该技术涉及病毒细菌、动植物和人的基因筛选检测及食品安全监测等多个领域的研究[8-11]。荧光定量分子识别的高度准确性及灵密度高、数码显像的自动生成、操作简单已成为了荧光定量PCR的优点[12]。为了对东北林蛙体内GSK3β基因变化量进行动态分析,且由于该荧光体系中PCR引物的筛选直接影响实验结果,有必要建立实时荧光定量PCR引物筛选的反应体系。本实验通过逆转录PCR与荧光定量PCR相结合的方法,对实时定量PCR分析东北林蛙肝脏中GSK3β基因表达量的引物进行筛选,实验中通过逆转录PCR筛选去除在凝胶系统显示中有杂带,扩增效率低的备选引物1号和3号,将PCR条带进行胶回收并测序,对测序结果进行分析比对得出符合条件的引物2号、4号、5号与6号,通过荧光定量PCR实验建立GSK3β引物标准曲线可获得各对引物扩增效率E值与R2,且引物需满足E值在90%~110%之间,R2>0.98的条件,4号引物符合此条件;根据熔解曲线对该引物进行特异性分析,最终选取特异性强且扩增效率高的4号引物,建立了更加完善的东北林蛙GSK3β基因荧光定量PCR引物筛选体系。本实验通过逆转录PCR首先筛选得到的引物虽可扩增出目的条带,且测序结果均为GSK3β基因序列,但实验结果显示可扩增出目的条带的引物在荧光定量PCR中扩增效率不高,可见引物的筛选不能简单地通过逆转录PCR进行筛选,还需进一步通过荧光定量PCR标准曲线与熔解曲线的建立来进一步检测引物的扩增效率与实用性。本实验通过对东北林蛙肝脏GSK3β引物筛选来提高实时定量PCR中该基因表达量变化数据的准确性,为东北林蛙基因实时表达量的研究提供数据基础。
[1] 应璐,徐艳春,黄孝明,等.东北林蛙8个地理种群的形态聚类分析[J].农业科学与技术:英文版,2008,36(18):104-106.
[2] 李秀峰,肖向红,柴龙会,等.低温胁迫对东北林蛙雄性成体GP、PEPCK比活性的影响[J].经济动物学报,2012,16(2):67-70.
[3] 杨翠军.两栖类结冰耐受机制及其研究策略[J].经济动物学报,2006,10(2):121-124.
[4] Dieni C A,Bouffard M C,Storey K B.Glycogen synthase kinase-3:cryoprotection and glycogen metabolism in the freeze-tolerant wood frog[J].The Journal of Experimental Biology,2012,215(3):543-551.
[5] Sugden D,Winter P D.Quantification of mRNA using real time RT-PCR[M].Molecular Biomethods Handbook,2008:149-68.
[6] 韩惠瑛,石丽瑞,张艳红.实时荧光定量PCR技术的应用[J].中国畜禽种业,2014,10(3):37-39.
[7] 许琰,丛喆,魏强.实时荧光定量PCR的研究进展及应用[J].中国实验动物学报,2007,15(2):155-158.
[8] Simpson D A C,Feeney S,Boyle C,et al.Technical brief:retinal VEGF mRNA measured by SYBR green I fluorescence:a versatile approach to quantitative PCR[J].Molecular Vision,2000,6(22):178-183.
[9] Pfaffl M W,Horgan G W,Dempfle L.Relative expression software tool(REST©)for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J].Nucleic Acids Research,2002,30(9):e36.
[10] Li Yuehua,Zhou Wei,Yang Lan,et al.Establishment of real-time fluorescence quantitative PCR for gluconobacter using SYBR green I[J].Modern Food Science & Technology,2015,31:272-276,241.
[11] 赵森,陈永华,陈昊,等.荧光定量PCR检测淹涝胁迫下水稻Adh2基因的表达量变化[J].中国生态农业学报,2008,16(2):455-458.
[12] 袁亚男,刘文忠.实时荧光定量PCR技术的类型、特点与应用[J].中国畜牧兽医,2008,35(3):27-30.
GSK3-beta;Fluorescence quantitative real-time PCR;Primers
Selection of Primers and Development of a GSK3 BetaReaction System for Rana dybowskii
Zhang Yu Gong Shanshan Chai LonghuiZhang Jingyu Xiao Xianghong*
(College of Wildlife Resources,Northeast Forestry University,Haerbin,150040,China)
In order to further explore the condition of GSK3-beta mRNA expression volume change inRanadybowskii’sliver at low temperature,we need to use the realtime fluorescent quantitative PCR (RTQF-PCR) to test the amount of GSK3-beta gene expression,and the process of PCR primers screening directly affects the authenticity and accuracy of test results.Based on the transcriptome database ofRanadybowskii,and using GSK3 beta gene of other species as reference,we designed 6 pairs of primers using the software Beacon Designer 7.These primer-pairs were screened by RT-PCR and Real-time fluorescent quantitative PCR.One pair of fluorescence quantitative PCR primers (F-TCCTACATCTGCTCTCGGTA,R-ACATCTATGCTGGAGGTATAATCA)for the GSK3 beta gene was selected.The amplification efficiency wasE=99.3%,andR2=0.998.The pair of primers can be used for research on GSK3 beta gene expression byRanadybowskii.
2016-04-20
修回日期:2016-05-10
发表日期:2016-08-10
Q959.6
A
2310-1490(2016)03-242-04
国家级实验教学示范中心建设专项,国家自然科学基金项目(30870301),黑龙江省自然科学基金重点项目(ZJN0604-02)
张宇,女,26岁,硕士研究生;主要从事分子生物学研究。
*通讯作者:肖向红,E-mail:xiaoxh2010@sina.com
