双金属催化剂Bi-Mo/TiO2气相催化氧化2-甲基吡啶合成2-吡啶甲醛
2016-11-18张玲玲王晓钟张世界戴立言
张玲玲, 俞 杰, 王晓钟, 张世界, 戴立言
双金属催化剂Bi-Mo/TiO2气相催化氧化2-甲基吡啶合成2-吡啶甲醛
张玲玲1, 2, 俞 杰1, 王晓钟1, 张世界2, 戴立言1
(1. 浙江大学化学工程与生物工程学院, 浙江杭州 310027;2. 浙江新三和医药化工股份有限公司, 浙江上虞 312369)
制备了气相催化氧化2-甲基吡啶合成2-吡啶甲醛的双金属Bi-Mo/TiO2催化剂,采用XRD、H2-TPR、SEM和XPS对催化剂进行了表征,并考察了催化剂组成、反应温度、原料流率等因素的影响。实验研究结果表明,Bi-Mo/TiO2对2-甲基吡啶有比较高的催化活性是基于Bi2Mo3O12和MoO3的协同催化作用,Bi2Mo3O12和MoO3的较佳摩尔比率为1:1,催化剂的较佳负载量为15%(wt),低反应温度和高原料流率可以提高对2-吡啶甲醛的选择性。较佳反应条件下(反应温度290℃,10%(wt) 2-甲基吡啶水溶液的流率为0.5 mL×min-1,氧气的流率为0.1 L×min-1,空速12600 h-1),2-甲基吡啶的转化率为70.9%,2-吡啶甲醛的选择性为83.1%。
双金属催化剂;2-甲基吡啶;2-吡啶甲醛;选择性;协同催化
1 前 言
双金属催化剂近年来在许多催化反应中表现出意想不到的催化效果,主要是通过两种金属的协同作用,可以取得单金属没有的高活性和高选择性,且第二种金属的加入能改善催化剂的稳定性,因此对双金属催化剂体系的应用拓展逐渐成为催化剂领域的研究热点之一[1~3]。
Bi-Mo双金属催化体系是一个主族金属元素和一个副族金属元素的配合,由于其催化活性高而常被用于丙烯氧化合成丙烯醛,丙烯氨氧化合成丙烯腈,丁烯氧化脱氢合成丁二烯等[4~7]。其催化氧化机理分为四步:(1)原料吸附在催化剂脱氢中心;(2)脱除原料中α-H;(3)插入氧形成目标产物;(4)晶格氧移动补充消耗的氧。最新研究表明,铋钼酸催化剂活性的重要影响因素是催化剂中晶格氧的流动性,而非催化剂本身的氧容量[4],加入少量的可导电金属氧化物能促进铋钼酸催化剂中晶格氧的转移,这种铋钼酸与可导电金属氧化物的协同作用可大大提高其催化活性[5,6]。MoO3中Mo6+离子在氧化反应中有电子传递现象[5],是可导电的金属氧化物。所以作者针对含有双组份Bi2Mo3O12和MoO3的双金属催化剂,研究其在催化氧化2-甲基吡啶合成2-吡啶甲醛反应中存在上述的协同作用。
到目前为止,将Bi-Mo催化剂体系用于催化氧化甲基吡啶合成吡啶甲醛鲜有报道,基于甲基吡啶和丙烯在结构上的类似性以及我们以前的研究[8,9],在此尝试将Bi-Mo/TiO2催化体系用于2-甲基吡啶气相氧化合成2-吡啶甲醛的反应,以期望解决目前气相氧化合成2-吡啶甲醛工艺中催化剂成本高、2-甲基吡啶转化率低、2-吡啶甲醛选择性差等问题,得到选择性高、转化率高的催化氧化工艺。
载体的使用会使催化剂的机械稳定性增加,使得活性组份分散在其表面并提高催化剂的比表面积,从而使得活性增加且提高了单位质量活性组份的催化效率,本文使用化学性质稳定、廉价低毒的TiO2作为载体。
2 实验部分
2.1 催化剂制备
采用沉淀法制备Bi-Mo/TiO2催化剂。将四水合钼酸铵溶于去离子水中,加入草酸并加热至70℃搅拌,然后加入硝酸铋的硝酸水溶液(1mol×L-1Bi(NO3)·5H2O, 2 mol×L-1HNO3),有白色沉淀析出,加入二氧化钛,在70℃下继续加热搅拌3 h,减压蒸干水分后,残留物用研钵磨碎,加入适量的去离子水挤成条状,于80℃烘干,然后于550℃焙烧10 h。将所得的直径为2 mm催化剂切成长2.5 mm的细条用于催化反应。催化剂的堆积密度为1.25 g×mL-1。
2.2 催化剂表征
XRD用Rigaku D/max-2550pc X射线衍射仪测定,Cu Kα(射线波长1.54059 Å),管压40 kV,管流250 mA,扫描范围为20°~90°。H2-TPR用Micromeritics Auto Chem II 2920 型自动吸附仪测定,样品(100 mg)在氩气氛围下400℃预处理1 h,然后冷却至100℃,切换10%(体积分数)H2/Ar的混合气体(30 mL×min-1),以15℃×min-1的升温速率升至800℃还原。SEM用S-4800电镜扫描仪测定,操作电压为3.0 kV。XPS分析采用VG Escalab Mark II,以MgKα为射线源,CAE: 50 eV,Step: 0.5 eV,结合能以C1s(284.6 eV)校准。
2.3 催化剂的活性评价
催化剂的活性评价在常压固定床中进行,进料采用10%(wt)的2-甲基吡啶水溶液,流率为0.5 mL×min-1,氧气的流率为0.1 mL×min-1。将反应器加热至所需温度,泵入氧气和去离子水,1 h后,改为进2-甲基吡啶水溶液,再1 h后,收集产品。反应产物分析用安捷伦Agilent 6820气相色谱仪(外标法),FID检测器,DB-5色谱柱。
3 结果与讨论
实验中制备的不同双金属催化剂以BMxxT的形式标记,其中B、M、T分别表示Bi、Mo、Ti三种元素,xx表示Bi/Mo的摩尔比。根据文献[10~12],Bi2Mo3O12催化活性高,且Bi/Mo摩尔比率低于2/3时,催化剂活性组份由-Bi2Mo3O12及MoO3组成,实验中筛选制备了4个于550℃煅烧下,活性组份含量为15%(wt)的催化剂,其组成如表1所示。

表1 催化剂的组成
3.1 催化剂的XRD表征
催化剂的XRD表征见图1。从图中可以看出,催化剂MT中含有MoO3及锐钛矿二氧化钛,其他三个含Bi元素的双金属催化剂中含有Bi2Mo3O12及锐钛矿二氧化钛,BM12T和BM47T中没有检测到MoO3,这是因为MoO3在这二种催化剂中的质量含量太少,但用扫描电镜(SEM)检测到了MoO3的存在。
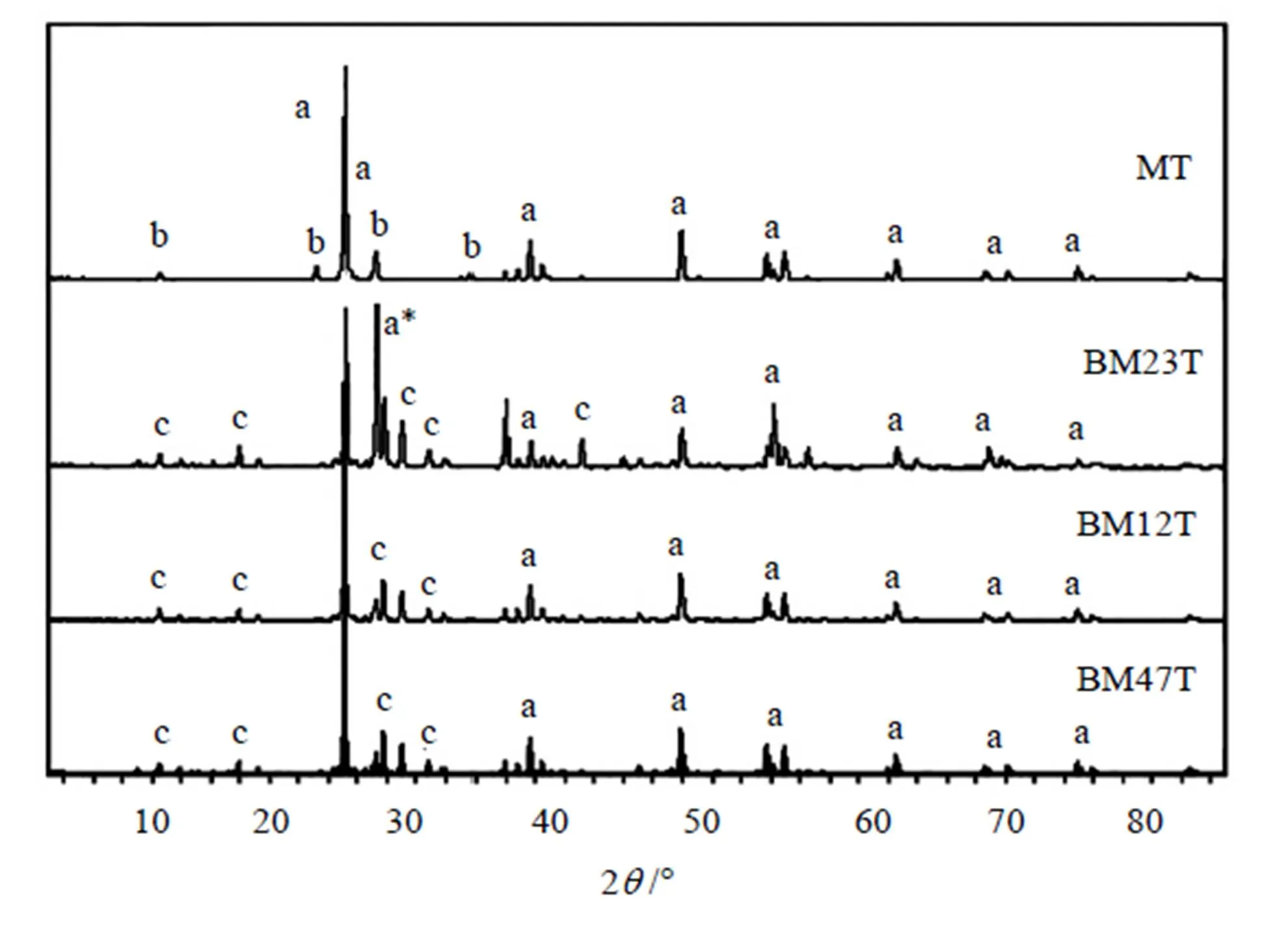
图1 催化剂的XRD 谱图
a. anatase TiO2 a*. rutile TiO2 b. MoO3 c. Bi2Mo3O12
3.2 催化剂的扫描电镜(SEM)
催化剂的外貌形态用扫描电镜(SEM)观察,如图2所示,MoO3在MT中作为单一组份负载时是类似球型,组份Bi2Mo3O12在催化剂BM23T、BM12T、BM47T中为球型,含有双组份Bi2Mo3O12和MoO3的BM12T、BM47T中出现了片状物质,且随着MoO3比例的增大片状形态更明显(BM47T中Bi2Mo3O12: MoO3=2 :1;BM12T中Bi2Mo3O12: MoO3=1 :1),而MoO3常规为片状结构,Bi/Mo摩尔比率低于2/3时,催化剂由Bi2Mo3O12及MoO3两相组成[10~12]。所以推测双组份中出现的片状形态物质为MoO3。
3.3 催化剂的XPS表征
由催化剂的XPS谱图(图3)可以看出,催化剂MT表面含有钼、钛和氧,双金属催化剂 BM23T、BM47T和 BM12T 表面含有铋、钼、钛和氧,其中Mo3d和Bi4f的结合能见表2,Mo3d在4种催化剂的结合能在误差范围内基本相同,与纯MoO3负载的TiO2上的Mo3d结合能231.9 eV(Mo3d5/2)、234.81(Mo3d3/2)接近[13],说明Mo在催化剂的中存在的价态主要以+6价为主。Bi4f在3种催化剂的结合能基本相同,与Bi3+的Bi4f7/2和Bi4f5/2结合能159.04 eV和164.87 eV接近[14],说明Bi在3种催化剂中主要以Bi3+为主。Mo和Bi的价态符合其在Bi2Mo3O12和MoO3的价态。

图2 催化剂的SEM 图

图3 催化剂的XPS 谱图

图4 催化剂的H2-TPR 谱图
3.4 催化剂的H2-TPR表征
已知具有催化氧化活性的金属氧化物中氧的主要形态及变化为[15]:
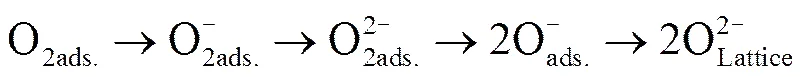
催化剂的H2-TPR表征见图4。对于催化剂MT,双峰对应于MoO3中吸附氧和晶格氧的还原,其他三个双金属催化剂的还原曲线相似。450℃左右的峰为催化剂表面吸附的分子氧(O2-和O22-)和原子氧(O-)的还原,700℃左右的峰为催化剂表层和体相的晶格氧的还原。从图中可以看出,催化剂在700℃左右的峰型更相似,且比含单个活性组份的BM23T和MT耗氢量更大(见表3),原因应该是这两种催化剂有新相MoO3生成,MoO3组份不仅是吸氧中心,而且能促使体相的晶格氧快速迁移到Bi2Mo3O12的脱氢活性点,Bi2Mo3O12和MoO3的这种协同效应提高了催化剂的氧吸附能力和晶格氧的流动性[5,6],进而提高了催化剂的氧化能力使耗氢量增大。

表2 Mo和Bi的结合能
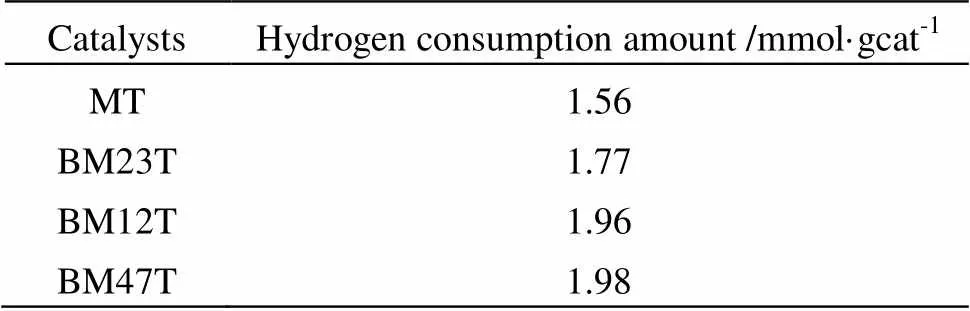
表3 催化剂的耗氢量
3.5 不同催化剂对氧化2-甲基吡啶合成吡啶甲醛的影响
从表4可以看出,MT和BM23T对2-甲基吡啶都有一定的催化效果,说明Bi2Mo3O12和MoO3都具有脱氢中心,但是只含有一个活性组份的催化剂MT和BM23T的活性要比其他含有双组份的活性低。催化剂的耗氢量代表催化剂的含氧量和氧化能力,从表3可以看出,双组份催化剂BM47T、BM12T随着MoO3含量的增加,耗氢量基本没有变化,说明双组份催化剂的含氧量已经饱和,但是表4中双组份催化剂随着MoO3含量的增加,2-甲基吡啶的转化率和2-吡啶甲醛的选择性都有上升。这可能由于Bi可以加速气相氧的解离形成活性晶格氧[15,16],这些新形成的活性晶格氧经体相中Mo6+传递到催化剂表面的活性中心上去,随着MoO3含量的增加,被Bi2Mo3O12解离的活性晶格氧更容易传递到催化剂表面的Bi2Mo3O12和MoO3的脱氢中心,与脱氢后的2-甲基吡啶中间体反应生成2-吡啶甲醛,这种由Bi2Mo3O12和MoO3产生的协同效应提高了催化剂的活性和选择性。表4中催化剂BM12T催化活性最好,2-甲基吡啶转化率达70.9%,2-吡啶甲醛选择性83.1%,因此催化剂BM12T继续用于后续优化反应研究。

表4 不同催化剂对氧化2-甲基吡啶合成2-吡啶甲醛的影响
Reaction conditions: catalyst amount 4 g, reaction temperature 290℃, flow rate of 10%(wt) 2-picoline solution 0.5 mL×min-1, oxygen flow rate 0.1 L×min-1, space velocity 12600 h-1
相比V-Mo/TiO2[8](转化率70.2%,选择性88.3%),2-吡啶甲醛选择性略下降,但相同条件下空速提高了近三倍,即2-吡啶甲醛生成速率比较快,说明Bi-Mo/TiO2催化剂的活性更高。
3.6 反应温度对催化剂活性的影响
反应温度对催化剂活性的影响见表5。从表可知,随着反应温度的升高,2-甲基吡啶的转化率逐渐提高,然后2-吡啶甲醛的选择性逐渐降低,反应温度升高提高了催化剂表面脱氢中心的活性和晶格氧的流动性,所以2-甲基吡啶的转化率升高,同时也加剧了副反应,导致副产物的增加,选择性降低。综合考虑转化率和选择性,较佳反应温度为290℃。

表5 温度对催化剂活性的影响
Reaction conditions: catalyst BM12T, catalyst amount 4 g, flow rate of 10%(wt) 2-picoline solution 0.5 mL×min-1, oxygen flow rate 0.1 L×min-1,space velocity 12600 h-1
3.7 催化剂负载含量对其催化活性的影响
负载含量对催化剂活性的影响见表6。由表可知,随着催化剂负载含量的增加,2-甲基吡啶的转化率略有提高,但总体变化很小,2-吡啶甲醛的选择性也相差不大,这可能是因为铋钼催化剂的活性很高,在负载含量较小时就表现出较高的活性。随着负载含量的升高,催化剂的机械强度逐渐提高,然而继续增加负载含量,使得制备催化剂的成本增加,综合考虑以上因素,选择负载含量为15%(wt)的催化剂为宜。

表6 催化剂负载含量对催化活性的影响
Reaction conditions: Bi2Mo3O12:MoO3=1:1(molar ratio),catalyst amount 4 g, reaction temperature 290℃, flow rate of 10%(wt) 2-picoline solution 0.5 mL×min-1, oxygen flow rate 0.1 mL×min-1, space velocity 12600 h-1
3.8 进料流率对反应的影响
进料流率对反应的影响见表7。由表可知,Bi-Mo/TiO2催化剂氧化2-甲基吡啶合成2-吡啶甲醛时,除了吡啶以外,吡啶偶姻也是其中一个主要副产物。随着2-甲基吡啶水溶液的流率降低,2-甲基吡啶的转化率升高,2-吡啶甲醛的选择性降低,副产物2-吡啶偶姻和吡啶的选择性增加,这是因为流率较低时,停留时间增加,导致了更多副反应的发生,致使2-吡啶甲醛的选择性降低。综合考虑2-甲基吡啶的转化率和2-吡啶甲醛的选择性以及副产物的选择性等因素,进料流率选0.5 mL×min-1为宜。

表7 进料流率对反应的影响
Reaction conditions: catalyst BM12T, catalyst amount 4 g, reaction temperature 290℃, 10%(wt) 2-picoline solution, oxygen flow rate 0.1 L×min-1,space velocity 12600 h-1
4 结 论
证明了Bi2Mo3O12和MoO3协同效应提高了双金属催化剂Bi-Mo/TiO2催化氧化2-甲基吡啶合成2-吡啶甲醛的催化活性,并研究了该催化氧化反应的影响因素,优化后的反应条件为:Bi2Mo3O12和MoO3的摩尔比为1:1,催化剂负载量为15%(wt),反应温度为290℃,10%(wt)的2-甲基吡啶水溶液的流率为0.5 mL×min-1,空速为12600 h-1,2-甲基吡啶转化率为70.9%,2-吡啶甲醛选择性为83.1%,具有较好的工业化应用前景。
参考文献:
[1] ZHANG Jun (张俊), LI Yun-ping (李云平), WANG Bao-yu (王保玉). Decomposition reaction of hydrogen peroxide catalyzed by dual-metal catalyst systems (双金属催化剂体系催化过氧化氢分解反应) [J]. Chemical Research (化学研究), 2011, 22(1): 58-60.
[2] Jia A P, Hu G S, Meng L,CO oxidation over CuO/Ce1-xCuxO2-δandCe1-xCuxO2-δcatalysts: Synergetic effects and kinetic study [J]. Journal of Catalysis, 2012, 289: 199-209.
[3] Zhang G Q, Zhang X, Lin T,Synergetic effect of FeVO4and α-Fe2O3in Fe-V-O catalysts for liquid phase oxidation of toluene to benzaldehyde [J]. Chinese Chemical Letters, 2012, 23(2): 145-148.
[4] Jung J C, Lee H, Kim H.Effect of oxygen capacity and oxygen mobility of pure bismuth molybdate and multicomponent bismuth molybdate on their catalytic performance in the oxidative dehydrogenation of-Butene to 1,3-Butadiene [J]. Catalysis Letters, 2008, 124(3): 262-267.
[5] Le M T, Luong H B, Isabel V D,The synergy effect between gamma and beta phase of bismuth molybdate catalysts: Is there any relation between conductivity and catalytic activity? [J]. Catalysis Today, 2008, 131(s1-4): 566-571.
[6] Le M T, Do V H, Truong D D,Synergy effects of the mixture of bismuth molybdate catalysts with SnO2/ZrO2/MgO in selective propene pxidation and the connection between conductivity and catalytic activity [J]. Industrial & Engineering Chemistry Research, 2016, 55(17): 4846-4855.
[7] Grasselli R K, Burrington J D. Selective oxidation and ammoxidation of propylene by heterogeneous catalysis [J]. Advances in Catalysis, 1981, 30: 133-163.
[8] YU Jie (俞杰), DAI Li-yan (戴立言), WANG Xiao-zhong (王晓钟),. Gas-phase oxidation of 2-picoline to 2-pyridylaldehyde over Mo modified V/TiO2catalysts (Mo掺杂V/TiO2催化2-甲基吡啶气相氧化合成2-吡啶甲醛) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2013, 27(4): 604-609.
[9] CHEN Ying-qi (陈英奇), DAI Li-yan (戴立言), YANG Neng-wei (杨能渭). Synthesis of 2-pyridinealdehyde by catalytic oxidation of 2-methylpyridine in gaseous phase (2-甲基吡啶气相催化氧化合成2-吡啶甲醛的研究) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2002, 16(4): 436-440.
[10] Carson D, Coudurier G, Forissier M,Synergy effects in the catalytic properties of bismuth molybdates [J]. Journal of the Chemical Society, Faraday Transactions 1, 1983, 79(8): 1921-1929.
[11] Burrington J D, Grasselli R K. Aspects of selective oxidation and ammoxidation mechanisms over bismuth molybdate catalysts [J]. Journal of Catalysis, 1979, 59(1): 79-99.
[12] Egashira M, Matsuo K, Kagawa S,Phase diagram of the system Bi2O3-MoO3[J]. Journal of Catalysis, 1979, 58(3): 409-418.
[13] Caceres C V, Fierro J L G, Lazaro J,. Effect of support on the surface characteristics of supported molybdena catalysts [J]. Journal of Catalysis, 1990, 122(1): 113-125.
[14] TuerdiAilijiang (艾力江•吐尔地), Chen Pei (陈沛), AbdukayumAbdukader (阿不都卡德尔•阿不都克尤木),Preparation and photocatalytic kinetic of bismuth doped mesoporous titanium dioxide (铋掺杂介孔二氧化钛的制备及光催化动力学) [J]. Chinese Journal of Applied Chemistry (应用化学), 2016, 33(2): 213-220.
[15] Chen Yan-xin (陈燕馨), Li Can (李灿), Li Wen-zhao (李文钊),The characteristic behavior of H2and O2over CeO2and Pt/CeO2catalysis (CeO2及Pt/CeO2及催化剂上H2、O2的作用特性) [J]. ActaPhysico-ChimicaSinica (物理化学学报), 1992, 8(4): 452-458.
[16] Grasselli R K, Burrington J D, Brazdil J F. Mechanistic features of selective oxidation and ammoxidation catalysis [J]. Faraday Discussions of the Chemical Society, 1981, 72: 203-223.
[17] Jiang Z C, An L D, Chen Z S,The redox behavior of bismuth molybdates [J]. Science in China Series B-Chemistry, 1992, 35(1): 28-38.
Gas-Phase Oxidation of 2-Picoline to Synthesize 2-Pyridylaldehyde Using Bi-Mo/TiO2 Dual-Metal Catalysts
ZHANG Ling-ling1,2, YU Jie1, WANG Xiao-zhong1, ZHANG Shi-jie2, DAI Li-yan1
(1. College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China; 2. Zhejiang Sanhe Pharmachem Co., Ltd., Shangyu 312369, China)
Dual-metal catalysts Bi-Mo/TiO2were prepared for gas-phase oxidation of 2-picoline to synthesize 2-pyridylaldehyde, which was characterized by XRD, H2-TPR, SEM and XPS. The effects of experimental parameters, such as catalyst composition, reaction temperature and material flow rate were investigated in detail. The results show that the high catalytic activity of Bi-Mo/TiO2is based on the cooperative catalysis of Bi2Mo3O12and MoO3. The optimized Bi2Mo3O12/ MoO3molar ratio and loading amount of the catalyst are 1:1 and 15%(wt) respectively. Meanwhile, low reaction temperature and high material flow rate can remarkably increase the selectivity. Under the optimal conditions (reaction temperature 290℃, flow rate 0.5 mL×min-1of 10%(wt) 2-picoline solution, oxygen flow rate 0.1 L×min-1, space velocity 12600 h-1), 2-picoline conversion of 70.9% can be achieved with high 2-pyridylaldehyde selectivity of 83.1% using the prepared Bi-Mo/TiO2catalyst.
dual-metal catalyst; 2-picoline; 2-pyridylaldehyde; selectivity; cooperative catalysis
1003-9015(2016)05-1082-06
O626.32;O643.36
A
10.3969/j.issn.1003-9015.2016.05.014
2016-01-22;
2016-06-15。
张玲玲(1980-),女,河南周口人,工程师,硕士。通讯联系人:戴立言,E-mail:dailiyan@zju.edu.cn
