308.15 K下MgB4O7-H2O体系热力学性质研究
2016-11-18戈海文邓天龙
戈海文, 邓天龙, 姚 燕
308.15 K下MgB4O7-H2O体系热力学性质研究
戈海文1,2, 邓天龙1,2, 姚 燕1
(1. 中国科学院青海盐湖研究所, 青海西宁810008;2. 天津市海洋资源与化学重点实验室(天津科技大学), 天津300457)
采用等温溶解法对章氏硼镁石(MgB4O7·9H2O)在纯水中溶解及转化进行研究,结果表明章氏硼镁石在308.15 K下稳定存在12 h,溶解度为0.04813 mol×kg-1;12 h后,平衡固相向多水硼镁石(Mg2B6O11·15H2O)转化。根据文献的化学平衡常数以及实验pH值,计算液相中硼酸根离子摩尔分数在溶解转化过程中变化规律,并给出溶液中可能存在的反应及其相应的机理。采用等压法研究了308.15 K下MgB4O7-H2O体系离子强度为0.1066~0.2680 mol×kg-1的等压平衡浓度和水活度,计算了渗透系数及饱和蒸汽压,获得了该体系渗透系数和饱和蒸汽压随离子强度的变化规律;应用Pitzer离子相互作用模型,对实验数据进行多元线性回归,得到308.15 K下MgB4O7-H2O体系的纯盐参数(0)、(1)、(2)和φ分别为39.3990、−61.5421、655.1369、−86.0430,标准偏差为0.00723。Pitzer离子相互作用模型计算的渗透系数值与实验结果一致,这对完善含镁、硼盐湖卤水体系的热力学模型具有重要意义。
MgB4O7-H2O体系;相转变;等压法;渗透系数;Pitzer模型
1 引 言
目前,我国固体硼资源日益枯竭,面临硼资源高效开发和硼资源即将枯竭的双重挑战,发展以减量、再利用、再循环为基本特征的硼循环经济已经迫在眉睫。青藏高原硼资源非常丰富,目前已查明资源储量1658 万吨,占全国24.8%,居第二位,是我国著名的硼酸盐盐湖沉积区。其中液体硼矿占总量61%,并与钾镁盐共生。我国氯化物型和硫酸盐型盐湖卤水蒸发到后期,大多属于硼酸盐体系。绝大多数盐湖卤水可以认为是Li+、Mg2+//Cl−、SO42−和Borate-H2O体系[1]。因此,开展硼酸镁水溶液体系热力学性质研究和建立盐湖卤水体系多温热力学模型,不仅是开拓盐湖资源化学和地球化学的迫切要求,而且为开发含硼和镁的盐湖资源提供了重要理论依据。
高世扬等[2]采用盐酸滴定浓缩盐湖卤水并测定其pH,对卤水的盐酸-pH滴定曲线进行定量计算,得出浓缩盐卤水的硼酸盐是以四硼酸镁的“综合形式”存在的论断。硼酸盐水溶液是电解质溶液结构研究的制高点之一,镁硼酸盐溶液化学是盐湖成盐地球化学中极具特色的研究热点。孙柏等[3]对25℃下章氏硼镁石和三方硼镁石在纯水和不同盐溶液中转化行为进行研究,给出了相应的转化过程。近年来课题组[4~9]先后用电势法、等压法和量热法研究298.15 K下Li2B4O7-H2O、Li2B4O7-MgCl2-H2O、LiCl-Li2B4O7-H2O和Li2SO4-Li2B4O7-H2O含锂、硼体系的热力学性质。尹松涛等[10]对MgB4O7-H2O体系进行等压研究,测定298.15 K下MgB4O7-H2O体系溶液的渗透系数和水活度,获得相应的Pitzer参数。然而,镁硼酸盐基础热力学数据的相对匮乏,严重制约青藏高原盐湖卤水体系多温热力学模型建立与镁、硼资源的精细化综合利用。本文采用等温溶解法对章氏硼镁石(MgB4O7·9H2O)在纯水中溶解平衡及转化进行研究,测定了308.15 K下溶解度,得到稳定存在时间以及溶解转化过程中多聚硼酸根离子相互转化规律;采用改进的自组装等压设备测定了MgB4O7-H2O体系在308.15 K下的等压平衡浓度、水活度,计算了体系的渗透系数和饱和蒸汽压。根据Pitzer渗透系数方程,获得了MgB4O7-H2O体系308.15 K Pitzer纯盐热力学参数,为含硼和镁体系的溶液模型建立提供了重要基础数据,为开发含硼和镁的盐湖资源提供理论依据。
2 实验部分
2.1 试剂和溶液
实验所用水皆为去离子水经二次蒸馏纯化所得,电导率为 1.0×10-4S×m-1。MgB4O7·9H2O采用自行合成,将碱式碳酸镁置于马弗炉中600℃ 煅烧3 h,降温至250℃ 取出置于干燥器中冷却至室温得到活性氧化镁,将H3BO3(G.R)经二次重结晶,杂质含量低于100 mg·kg−1。按MgO:H3BO3:H2O质量比1:8:66混合,25℃搅拌3.5 h,静置、过滤得到清亮滤液。滤液静置12 h后,继续搅拌45 min,得到沉淀,过滤、洗涤、自然风干,备用。将合成的MgB4O7·9H2O进行化学分析、X−ray粉晶衍射分析和主要杂质离子ICP分析等多手段表征,化学分析结果为MgO:B2O3= 1:2.02,XRD分析结果表明样品的光谱图与MgB4O7·9H2O的标准谱图吻合,经ICP-AES检测合成产品中主要杂质含量低于200 mg·kg−1,结果表明所得样品为较纯净的MgB4O7·9H2O。

图1 合成章氏硼镁石(MgB4O7·9H2O) XRD图
A. XRD of reference B. XRD of sample
溶解转化实验与等压实验储备液配制均使用合成MgB4O7·9H2O,等压实验NaCl参考溶液使用纯度99.99% 的NaCl高纯试剂。
2.2 仪器设备与实验方法
采用等温溶解平衡法对MgB4O7·9H2O进行溶解转化实验研究,实验装置如图2所示。实验采用双重控温装置(高精度低温恒温槽和自制恒温箱),控温精度为0.02 K,测温装置经国家计量标准研究院标定的精密数显热敏电阻温度计,测温精度为±0.005 K。采用带有4#砂芯取样管对液相进行取样,并对Mg2+和B2O3浓度进行连续测定,对固相进行XRD鉴定。
实验使用改进的等压装置及方法在文献[7]中已有较详细描述。实验装置主要由等压箱(用镀有防腐层的不锈钢材制成,带有螺旋加盖装置,箱内放置有8个带螺纹凹槽的镀铬紫铜传热板,可在同一组等压实验中放置8个镍铬合金等压杯)、恒温系统、自动传动装置、抽真空和通洁净干燥空气系统五部分组成。在等压实验中,等压箱放入精确控温为(308.15±0.005) K的恒温水浴中。
等压箱内共有8个等压杯,其中3个等压杯装NaCl参考溶液;2个KCl(aq)做次级参考;另3个等压杯装MgB4O7(aq) 待测溶液。当平行样品平衡浓度偏差小于0.5% 时,作为等压平衡的标志,等压平衡时间一般在15 d以内。
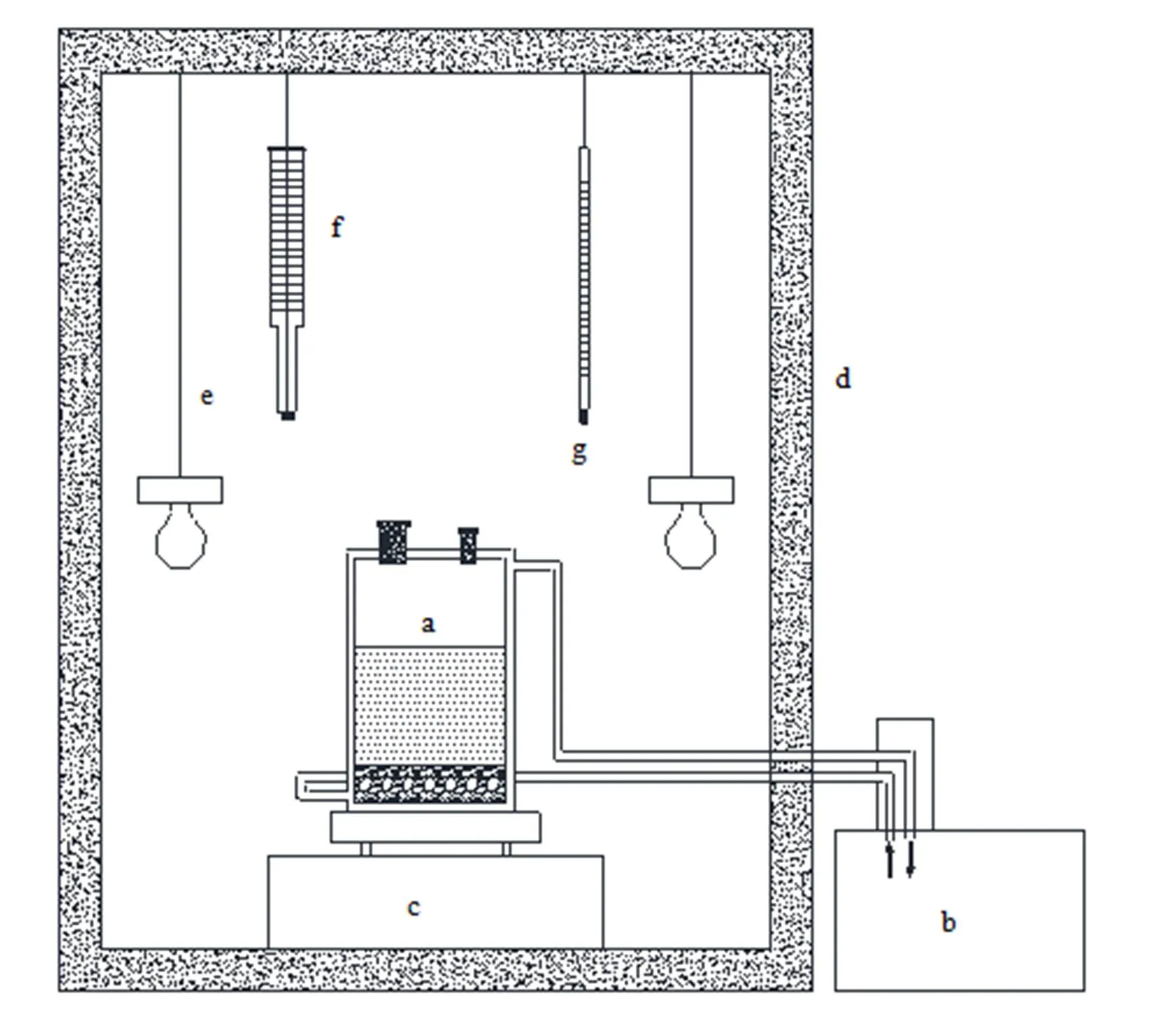
图2 等温溶解转化实验装置示意图
a. balance tank b. high precision low−temperature thermostat bath c. magnetic stirring apparatus d. thermostat container e. electric bulb f. electric contact thermometer g. microthermometer
2.3 分析方法
Mg2+离子采用EDTA质量法滴定;B2O3采用甘露醇碱量法质量滴定;Cl−采用AgCl沉淀法[11,12]。
MgB4O7储备液浓度由EDTA质量法测定Mg2+浓度和改进的甘露醇碱量法测定B2O3浓度,平行样分析结果相对偏差小于0.1%。NaCl (分析纯,天津科密欧化学试剂厂)经三次重结晶,在873.15 K下灼烧恒重后配实验储备液,采用AgCl重量法分析其浓度,相对偏差小于0.05%。
3 结果与讨论
3.1 溶解度测定与转化实验
对MgB4O7·9H2O在308.15 K下进行等温溶解,并对液相离子浓度以及物化性质进行测定,固相进行XRD鉴定,实验结果列于表1。
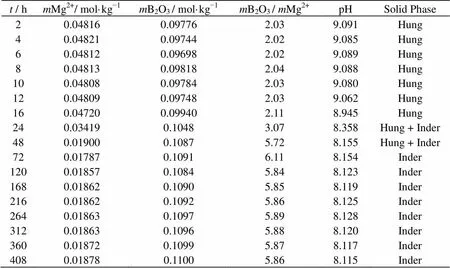
表1 MgB4O7-H2O体系308.15 K平衡浓度及物化性质
Hung: Hungtsaoite (MgB4O7·9H2O); Inder: Inderite (Mg2B6O11·15H2O)
由表1可知,MgB4O7·9H2O在308.15 K下2 h即可达到溶解平衡,取2~12 h之内液相Mg2+离子浓度均值,即MgB4O7·9H2O溶解度0.04812 mol·kg−1。在平衡时间12 h之后,液相Mg2+离子浓度出现下降,而液相B2O3浓度开始增加,液相B2O3/Mg2+不再与初始固相(MgB4O7·9H2O)一致,B2O3含量增加而Mg2+含量降低。平衡固相XRD鉴定表明出现新的固相(Mg2B6O11·15H2O)。平衡固相MgB4O7·9H2O开始出现向多水硼镁石转化。
硼酸盐溶液pH变化为溶液中多聚硼酸根阴离子相互转化的综合表现。硼酸盐溶液中,硼酸根阴离子间发生电离、水解、聚合以及解聚等复杂竞争反应,均涉及到H+与OH−,从而引起溶液pH变化。所有硼酸根离子均以B(OH)3为反应物,可用式1表示:
B(OH)3+H2O=B(OH)3p+q(H2O)−q−+H+(1)
平衡常数记为qp。由实验所测pH值和文献报道的平衡常数[13,14],得到硼原子物料平衡方程式(2),采用牛顿迭代法计算得到MgB4O7-H2O体系在308.15 K下溶解转化过程中多聚硼酸根阴离子的摩尔分数及变化规律[15],如图3所示。
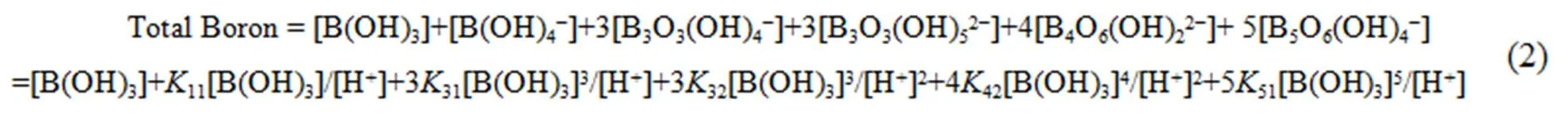
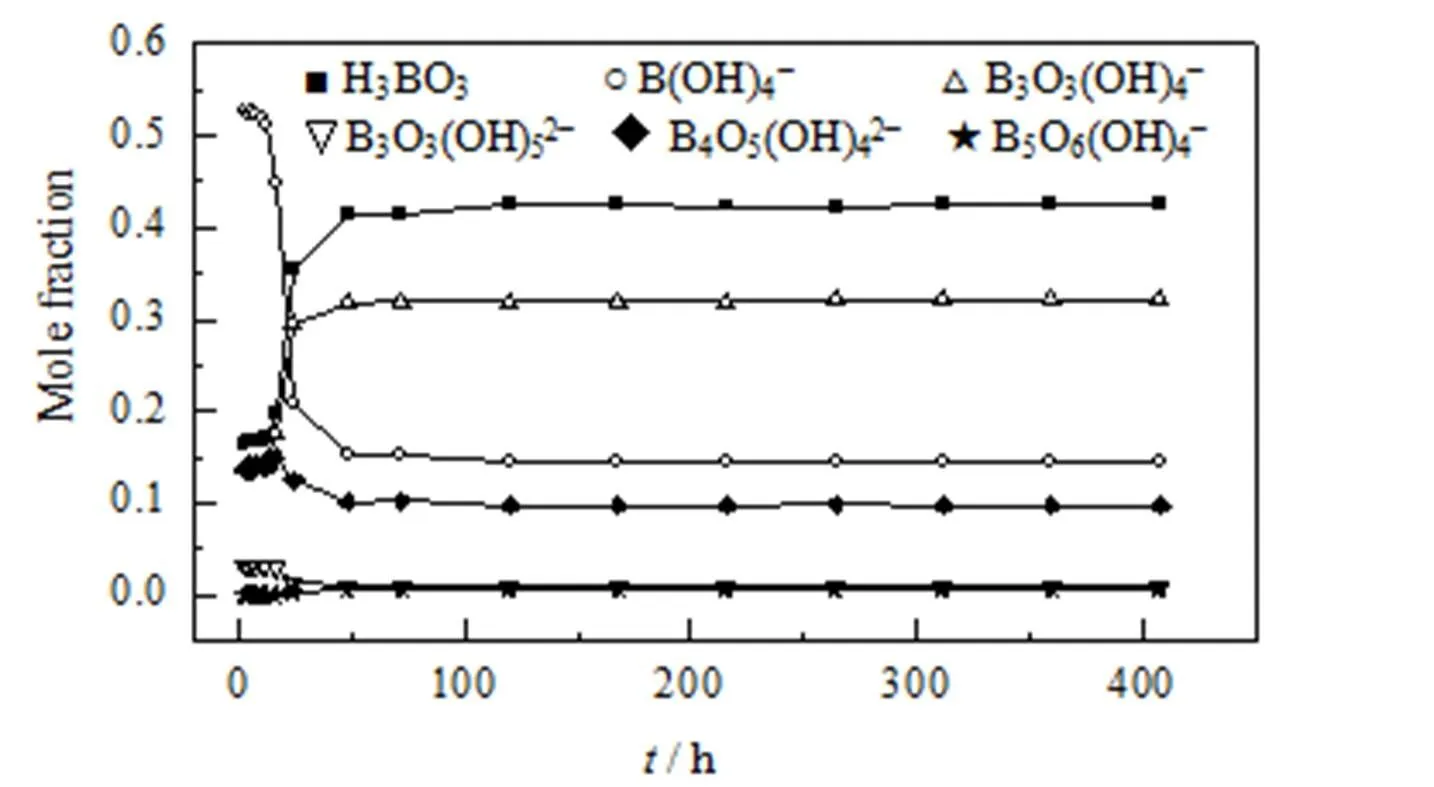
图3 硼酸根离子随时间变化图
由图3可知,MgB4O7·9H2O溶解过程中液相主要存在B(OH)4−,其次是H3BO3、B3O3(OH)4−和B4O5(OH)42−。硼酸根离子分布情况表明,B4O5(OH)42−在MgB4O7·9H2O溶解过程中发生解聚反应,液相中B4O5(OH)42−离子三配位的硼原子受到水分子攻击,六元环的B−O键发生断裂,形成B(OH)4−和B3O3(OH)4−离子,液相存在主要反应有:
B4O5(OH)42−+ 2H2OB3O3(OH)4−+ B(OH)4−B3O3(OH)4−+ 3H2OB(OH)4−+ 2B(OH)3B(OH)4−B(OH)3+ OH−
当固相向多水硼镁石转化时,由于多水硼镁石溶解度比章氏硼镁石小,所以表现为液相Mg2+离子浓度下降;生成H3BO3,液相B2O3含量上升,pH值下降。液相中B(OH)4−和B4O5(OH)42−开始减少,而H3BO3和B3O3(OH)4−摩尔分数增加,表明液相中B4O5(OH)42−继续解聚为B3O3(OH)4−和B(OH)3,而B(OH)4−继续向B(OH)3转化。
在平衡时间为48 h时,转化基本完全,液相Mg2+离子和B2O3浓度维持不变,平衡固相XRD鉴定结果显示多水硼镁石,平衡时间408 h(17 d)之内未发生新的转化,表明多水硼镁石在水溶液中可以稳定存在。
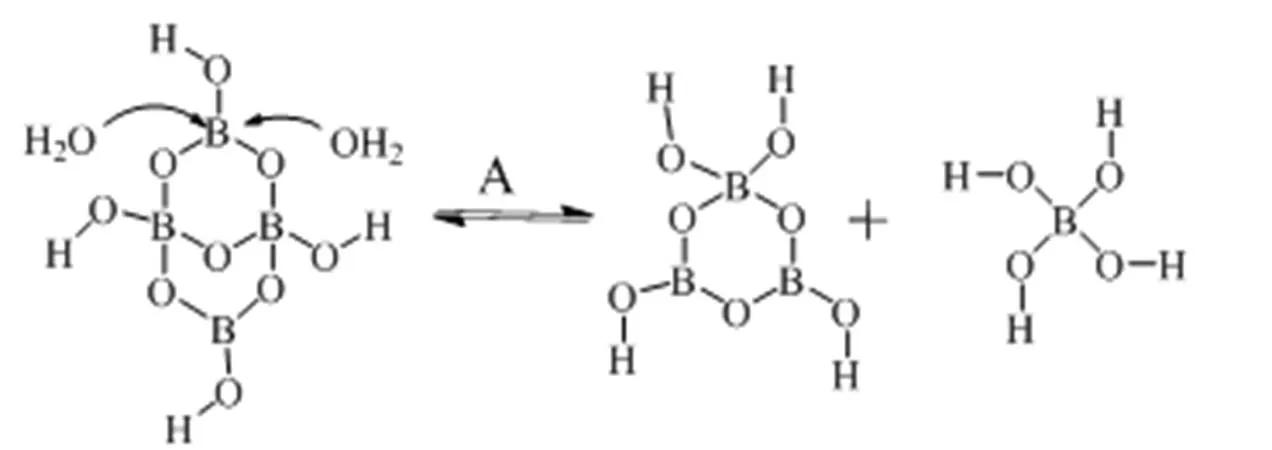
图4 硼酸根离子转化示意图
3.2 等压平衡浓度与水活度
308.15 K下NaCl在质量摩尔浓度为0.05~0.5 mol·kg−1的数据不全[16],为此我们采用最小二乘法分别拟合质量摩尔浓度0.05、0.1、0.2、0.3、0.4和0.5 mol·kg−1,温度273.15~323.15 K的渗透系数与温度的关系式:
=0+1×1/2+2×+3×3/2+4×2(3)
将温度308.15 K代入公式(3)中计算出各质量摩尔浓度在308.15 K下的渗透系数,数据列于表2。
NaCl溶液的浓度和相应的渗透系数来自表2,用最小二乘法拟合文献渗透系数和浓度的关系式,拟合偏差为SD. = 1.56×10−4,拟合方程为:
*= 0.9915 − 0.3102×1/2+ 0.4286×− 0.2348×3/2+ 0.05785×2(4)
根据等压法的实验原理,同一组实验样品达到等压平衡后,待测溶液与参考溶液具有相同的水活度。同一组实验中不同MgB4O7待测液等压平衡浓度相对偏差小于0.5%,视为达到平衡。
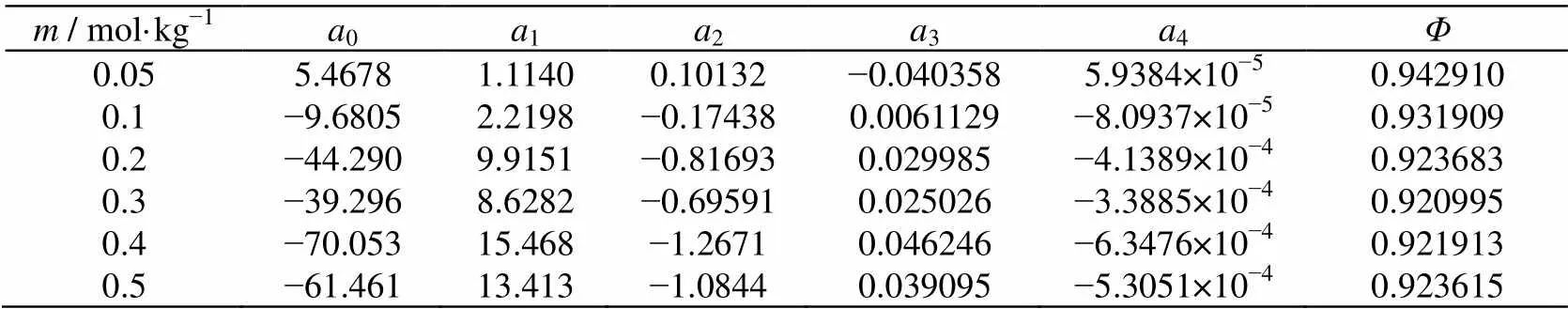
表2 NaCl各浓度在308.15 K下渗透系数
在 MgB4O7-H2O 与参考溶液NaCl(aq) 达到等压平衡时,体系的水活度按式(5)计算:
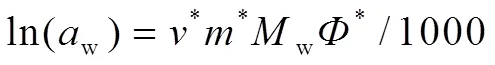
其中,*表示等压参考 NaCl,*是等压参考溶液平衡浓度,w为水的分子量,*为参考溶液分子完全离解的离子数(NaCl为2),*表示参考溶液渗透系数。MgB4O7-H2O体系的平衡浓度、水活度、渗透系数和蒸汽压列于表3。

表3 308.15 K下MgB4O7-H2O体系等压平衡浓度、渗透系数及水活度
NaCl-H2O和MgB4O7-H2O体系分别在0.05773~0.11554 mol kg−1、0.02664~0.06700 mol kg−1范围的等压平衡浓度及水活度见表3。由图5可见,MgB4O7和NaCl溶液的水活度都随质量摩尔浓度增加而减小,在相同质量摩尔浓度下,NaCl溶液的水活度高于MgB4O7溶液,由于MgB4O7为2-2电解质,离子水合能力强,且B4O72−离子在水溶液中存在水解反应消耗部分溶剂水。
3.3 平衡气相饱和蒸汽压的计算
根据实验计算MgB4O7水活度,通过牛顿迭代法解式(6、7)方程组[17],得到308.15 K下MgB4O7−H2O 体系的饱和蒸汽压。
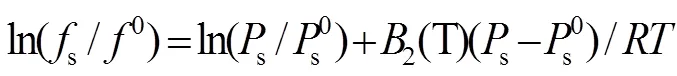
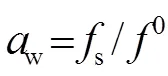
其中,为绝对温度(K),w为溶液的水活度,s和s0分别为308.15 K下体系和纯水的平衡气相中水的逸度(Pa);s和s0分别为体系和纯水在308.15 K 的平衡气相蒸汽压(Pa),为普适气体常数;2(T)是维里系数(m3·mol−1)。
图6为MgB4O7-H2O 和NaCl-H2O体系平衡气相饱和蒸汽压与离子强度的关系图。由图可知,溶液的饱和蒸汽压随溶液离子强度的增大而减小,且NaCl溶液饱和蒸汽压随离子强度的变化较为显著。

图5 NaCl-H2O和MgB4O7-H2O体系在308.15 K下水活度与质量摩尔浓度关系
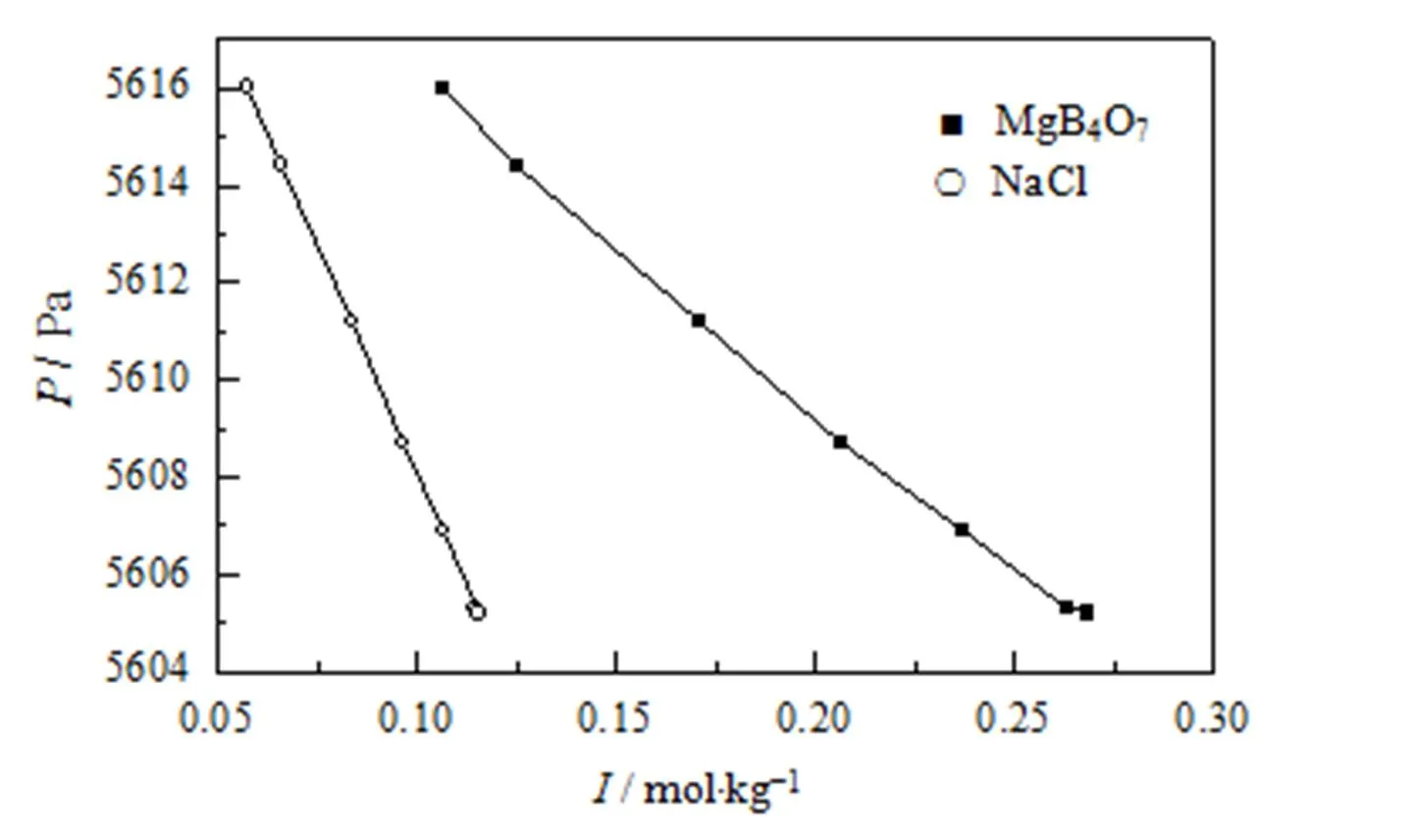
图6 308.15 K 下MgB4O7和NaCl 纯盐体系水蒸汽压与离子强度的关系
3.4 溶液渗透系数与质量摩尔浓度的关系
当待测溶液MgB4O7-H2O与参考溶液NaCl(aq)达到等压平衡时,待测溶液渗透系数计算如式8:
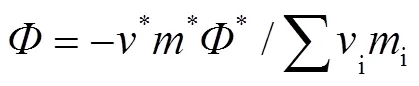
其中,*表示等压参考NaCl溶液,*是NaCl平衡浓度,*为NaCl完全离解的离子数(NaCl为2),*为NaCl溶液渗透系数,m代表等压平衡时待测溶液中各物种的浓度,表示MgB4O7-H2O体系的渗透系数。在308.15 K下,NaCl的渗透系数*由式(5)计算得到。
按式8计算的MgB4O7-H2O体系的实验渗透系数与参考溶液NaCl的渗透系数列于表3,MgB4O7-H2O体系渗透系数与溶液离子强度的关系见图7。由图7可知,MgB4O7-H2O体系的渗透系数随离子强度的增加而减小。

图7 MgB4O7-H2O体系在308.15 K下渗透系数与质量摩尔浓度关系
3.5 Pitzer离子相互作用模型的应用
在溶解转化过程中,计算出MgB4O7·9H2O在溶解过程中存在多种硼酸根离子,然而根据高世扬的结论在实际盐卤中硼酸根离子以四硼酸盐“综合形式”存在,为了建立更好适用于实际卤水的热力学模型,本文在计算Pitzer模型热力学参数时仍以B4O72−离子处理。
Pitzer离子相互作用模型广泛应用于强电解质水盐体系热力学性质研究[16]。对于纯盐2-2电解质溶液,Pitzer 渗透系数方程表达式为:
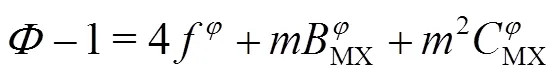
为了获得合理的参数和较小的偏差对公式9中的2进行调节,在1=1.4 kg1/2·mol−1/2,2= 7.59 kg1/2·mol−1/2,b = 1.2 kg1/2·mol−1/2条件下。
根据Pitzer渗透系数方程,采用多元线性回归法,分别拟合308.15 K 下实验测定的7组MgB4O7-H2O纯盐体系的渗透系数数据,离子强度为0.1066~0.2680 mol·kg−1,获得MgB4O7纯盐参数(0)MX、(1)MX、(2)MX和φMX,其结果列于表4;MgB4O7渗透系数拟合的标准偏差为0.00723。在图8给出了各个浓度点的渗透系数实验值与计算值的相对误差,实验点的渗透系数实验值与模型计算值的偏差小于0.008,表明Pitzer 电解质溶液模型可成功地描述了308.15 K下MgB4O7-H2O体系的热力学性质,为含硼体系溶液模型建立提供了重要的基础数据。

表4 308.15 K下的MgB4O7-H2O的Pitzer纯盐离子作用参数
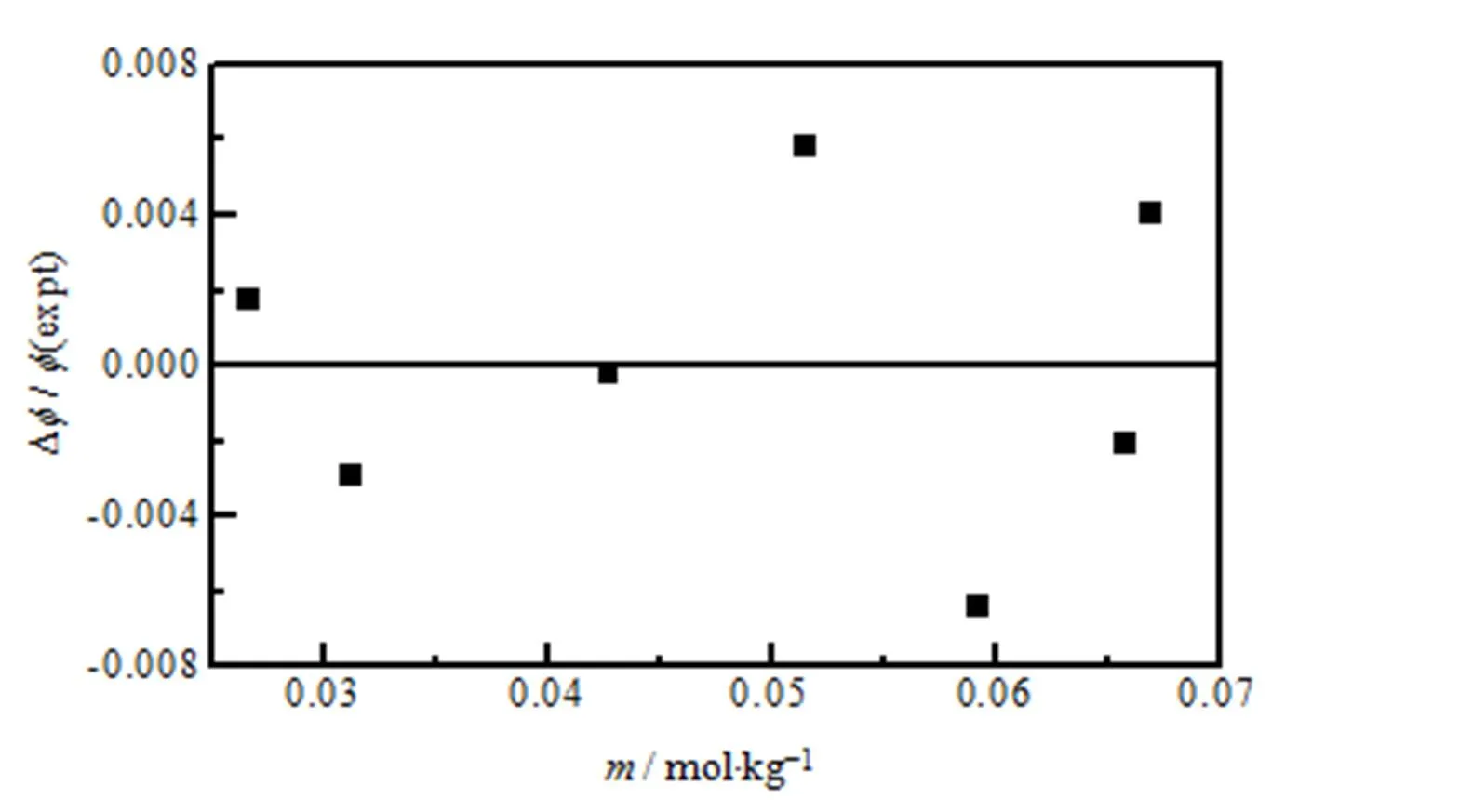
图8 308.15 K下MgB4O7溶液渗透系数计算值和实验值的相对偏差
4 结 论
本文首次报道采用等温溶解平衡法研究308.15 K下章氏硼镁石在纯水中溶解转化规律,确定MgB4O7·9H2O溶解度为0.04813 mol·kg−1,纯水中稳定存在12 h,之后向多水硼镁石转化,多水硼镁石在水溶液中稳定存在,并计算章氏硼镁石在溶解和转化过程中硼酸根离子物种分布变化。
采用等压法测定308.15 K下MgB4O7-H2O纯盐体系的等压平衡浓度和水活度,计算了渗透系数及饱和蒸汽压,获得了该体系渗透系数和饱和蒸汽压随离子强度的变化规律。应用Pitzer 离子相互作用模型,多元线性回归拟合获取308.15 K下MgB4O7的Pitzer单盐参数(0)、(1)、(2)和φ分别为39.3990、−61.5421、655.1369、−86.0430,计算值与实验值吻合较好,为建立含硼、镁的复杂盐湖卤水体系的热力学动态模型奠定了基础。
参考文献:
[1] ZHEN Mian-ping (郑绵平), XIANG Jun (向军). The salt lake of the qinghai-tibet Plateau (青藏高原盐湖) [M]. Beijing (北京): Science &Technology Press (科学技术出版社), 1989.
[2] GAO Shi-yang (高世扬), WANG Jian-zhong (王建中), XIA Shu-ping (夏树屏),. Chemistry of borate in salt lake brine VIII: the form of borate existing in concentrated brine and its expression (盐卤硼酸盐化学VIII −盐卤中硼酸盐的存在形式和表示方式) [J]. Oceanologia et Limnologia Sinica (海洋与湖泊). 1989, 20(5): 429-437.
[3] SUN Bai (孙柏), SONG Peng-sheng (宋彭生). Study on solution and phase transformation of some magnesium borates (某些镁硼酸盐溶解及相转化的研究) [J]. Journal Salt Lake Research (盐湖研究). 1999, 7(2): 16-22.
[4] TIAN Hai-bin (田海滨), YAO Yan (姚燕), SONG Peng-sheng (宋彭生). Studies of activity coefficients of LiCl and association equilibrium LiCl-Li2B4O7-H2O system at 298.15 K (298.15 K下LiCl-Li2B4O7-H`O体系中LiCl的活度系数和缔合平衡研究) [J]. Chemical Research and Application (化学研究与应用). 2000, 12(4): 403-408.
[5] ZHANG A Y, YAO Y, SONG P S. Isopiestic determination of the osmotic coeffcients and pitzer model representation for Li2B4O7(aq) at 298.15K [J]. Journal of Chemical Thermeaynamics, 2005, 37(2):101-109.
[6] ZHANG Ai-yun (张爱云), YAO Yan (姚燕), YANG Ji-ming (杨吉民),. Isopiestic studies of thermodynamic properties and representation with ion-interaction model for Li2B4O7−MgCl2(B)-H2O system at 298.15K (Li2B4O7−MgCl2(B)-H2O体系热力学性质的等压研究及离子相互作用模型) [J]. Acta Chimica Sinica (化学学报), 2004, 62(12): 1089-1093.
[7] YANG Ji-ming (杨吉民), YAO Yan (姚燕), ZHANG Ai-yun (张爱云),. Isopiestic studies on thermodynamic properties for L iCl−Li2B4O7-H2O system at 298. 15 K (298.15 K下LiCl-Li2B4O7-H2O体系热力学性质的等压研究) [J]. Journal of Salt Lake Research (盐湖研究), 2004, 12(3): 31-38.
[8] YIN G Y, YAO Y, JIAO B J,. Enthalpies of dilution of aqueous Li2B4O7solutions at 298.15 K and application of ion−interaction model [J]. Thermochimica Acta, 2005, 435(2):125-128.
[9] YUAN Wen-ping (元文萍), YAO Yan (姚燕), SONG Peng-sheng (宋彭生). Isopiestic studies on the thermodynamic properties for Li2B4O7-Li2SO4-H2O system at 298.15 K (298.15 K下Li2SO4-Li2B4O7-H2O体系热力学性质的等压研究) [J]. Journal of Salt Lake Research (盐湖研究), 2005, 12(4): 29-34.
[10] YIN S T, YAO Y, LI B,. Isopiestic studies of aqueous MgB4O7and MgSO4+MgB4O7at 298.15 K and representationwith pitzer’s ion-interaction model [J]. Journal of Solution Chemistry, 2007, 36(11-12): 1745-1761.
[11] Qinghai Institute of Salt Lakes, Chinese Academy of Sciences (中国科学院青海盐湖研究所). Analysis methods for brines and salts (卤水和盐的分析方法) [M]. 2nd ed (第2版). Beijing (北京): Science Press (科学出版社), 1988.
[12] LI Hong-xia (李红霞), DONG Ou-yang (董欧阳), YAO Yan (姚燕),. The mass titration analytical method and its application (质量滴定分析方法及其应用) [J]. Journal of Salt Lake Research (盐湖研究), 2011, 19(3): 31-36.
[13] Spessard J E. Investigations of borate equilibria in neutral salt solutions [J]. Journal of Inorgamic and NucIear Chemistry, 1970, 32: 2607-2613.
[14] Weres Oleh. Vapor pressure, speciation, and chemical activities in highly concentrated sodium borate solutions at 277 and 317℃[J], Journal of Solution Chemistry, 1995, 24(5): 409-438.
[15] ZHOU Y Q, FANG C H, FANG Y,. Polyborates in aqueous borate solution: a Raman and DFT theory investigation [J]. Journal Spectrochimica Acta Part A, 2011, 83(1): 82-87.
[16] Pitzer K S. Activity cofficients in electrolyte solutions [M].2nd ed. Boca Raton, Florida: CRC Press, 1991.
[17] DENG Tian-long (邓天龙), YAO Yan (姚燕), ZHANG Zhen-ying (张振英),. Thermodynamics properties for the aqueous system (NaCl-CaCl2-H2O) at 308.15 K by using isopiestic method (308.15 K下NaCl-CaCl2-H2O体系热力学性质的等压研究) [J]. Science.China Chemistry, 2010, 40(9): 1371-1377.
Thermodynamic Properties of the MgB4O7-H2O System at 308.15 K
GE Hai-wen1,2, DENG Tian-long1,2, YAO Yan1
(1. Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, Xining 810008, China;2. Tianjin Key Laboratory of Marine Resources and Chemistry (Tianjin University of Science & Technology), Tianjin 300457, China)
The solubility and transforming behavior of hungtsaoite (MgB4O7·9H2O) at 308.15 K were studied using an isothermal dissolution equilibrium method. The results show that hungtsaoite is stable for 12 h in water, and then the solid phase transforms into inderite. Mole fractions of polyborates were calculated following equilibrium constants of borates and experimental pH in the literature, and related chemical reactions and mechanism were suggested for the dissolution and transformation processes. The solubility of hungtsaoite at 308.15 K is 0.04813 mol·kg−1. The isopiestic molalities and water activities of the MgB4O7-H2O system at 308.15 K were measured by an isopiestic method with ion strength of 0.1066~0.2680 mol·kg−1. The osmotic coefficients and the saturated vapor pressures of the system were calculated. The profiles of how osmotic coefficient and saturated vapor pressure change with ion strength for the ternary system were demonstrated. Pitzer’s single electrolyte parameter of(0),(1),(2),φfor MgB4O7is 39.3990, −61.5421, −655.1369 and −86.0430, respectively, with standard deviations of 0.00723, which are obtained using a multivariant linear regression method. The experimental and calculated osmotic coefficient values are in good agreement with the Pitzer model. The thermodynamic data obtained is essential to construct complex thermodynamic models for magnesium and borate brine containing systems.
MgB4O7-H2O system; phase transformation; isopiestic method; osmotic coefficient; pitzer model
1003-9015(2016)05-1007-07
O645.16
A
10.3969/j.issn.1003-9015.2016.05.004
2015-11-18;
2016-02-29。
国家自然科学基金(41503061,20836009);天津市海洋资源与化学重点实验室(天津科技大学)开放基金(201406)。
戈海文(1984-),男,中国科学院青海盐湖研究所助理研究员,硕士。通讯联系人:邓天龙,E−mail:tldeng@tust.edu.cn
