紫茉莉提取物对乙醇诱导L-02肝细胞损伤的影响
2016-11-18罗爱莲程胜邦陈俊雅郭美仙
罗爱莲,程胜邦,沈 磊,陈俊雅,郭美仙
(云南省昆虫生物医药研发重点实验室,云南大理671000)
紫茉莉提取物对乙醇诱导L-02肝细胞损伤的影响
罗爱莲,程胜邦,沈磊,陈俊雅,郭美仙*
(云南省昆虫生物医药研发重点实验室,云南大理671000)
目的:研究紫茉莉提取物对乙醇体外诱导L-02肝细胞损伤的作用。方法:选取处于对数生长期的L-02肝细胞,以终浓度为100 mmol/L的乙醇诱导损伤8 h后,加入不同浓度的紫茉莉提取物,继续培养16 h后,MTT法检测乙醇对肝细胞的抑制率,酶标法检测培养液中谷丙转氨酶(ALT)、谷草转氨酶(AST)及超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。结果:8 mg/mL或更高生药浓度的紫茉莉能减小乙醇对L-02肝细胞的抑制率,降低受损细胞培养液中的ALT和AST活性,增强SOD活性,减少MDA含量。结论:紫茉莉提取物对乙醇诱导L-02肝细胞损伤有一定的保护作用。
紫茉莉;乙醇;L-02肝细胞;保护作用
[DOI]10.3969/j.issn.2096-2266.2016.10.002
长期大量饮酒或饮用含酒精饮料易造成酒精性肝损害,通常表现为酒精性肝炎、脂肪肝、肝硬化等〔1〕。酒精性肝损害已成为危害全球的公共卫生问题,其发病率呈明显上升趋势,但至今为止,仍未找到对其有效的防治药物〔2〕。过氧化损伤是酒精性肝损害的公认发病机制之一〔3〕。紫茉莉俗名地雷花、胭脂花等〔4〕,全草均可入药,药用价值高,收载于《本草纲目拾遗》。现代研究表明紫茉莉具有抗氧化、抗癌、抗菌、收缩子宫平滑肌等多种药理作用〔5-8〕。李凌智等〔9〕研究表明紫茉莉中含有抗氧化物质——黄酮,黄酮对实验性肝损伤有一定的保护作用。因此,本实验就紫茉莉提取物对乙醇诱导损伤的L-02肝细胞的影响进行了研究。
1 材料
1.1样品紫茉莉采于云南省大理市,由大理大学药学与化学学院张德全副教授鉴定为紫茉莉科紫茉莉属植物紫茉莉(Mirabilis jalapa L.)。将紫茉莉洗净,晾干,粉碎。称取5 kg用无水乙醇冷浸提取3次,混合并浓缩冷浸液,得浸膏294.56 g(1 g浸膏约相当于17 g生药),冰箱保存备用〔10〕。无菌条件下∶加药前24 h配制母液,密封冰箱保存过夜;加药前,用PBS(磷酸盐缓冲液)稀释母液,得81、27、9、3、1 mg/mL药液〔10〕。
1.2药品与试剂RPMI-1640培养基(Gibco公司);MTT(噻唑蓝,Sigma公司),胰蛋白酶(Sigma公司),DMSO(二甲基亚砜,Sigma公司);胎牛血清(杭州四季青生物工程材料有限公司);0.25%胰蛋白酶和1%双抗(Amresc公司生产);谷丙转氨酶试剂盒、谷草转氨酶试剂盒、超氧化物岐化酶测定试剂盒及丙二醛试剂盒(南京建成生物工程研究所)。
1.3仪器ES-315型高压灭菌锅(TOMY公司);3-111型培养箱(Thermo公司);AE-21型倒置生物数码显微镜(MOTIC公司);0408-2型台式低速离心机(上海医疗器械集团有限公司手术器械厂);多功能酶标仪(BioTek公司)。
2 方法
2.1肝细胞(L-02)培养用含20%胎牛血清和1%双抗的RPMI-1640培养基(完全培养基),置37℃、5%CO2、饱和湿度的培养箱中培养,每隔1~2 d更换新鲜完全培养基继续培养。当细胞长满培养瓶底部80%以上时,以1∶2或1∶3进行传代,继续置培养箱中培养。
2.2肝细胞损伤模型的建立以1×105个/mL的细胞悬液种板(96孔板,90 μL/孔)。设正常组和3个浓度乙醇组,每组重复8孔,另设空白组8孔,加入完全培养基(90 μL/孔)。继续培养48 h后,空白组和正常组加入完全培养基(10 μL/孔),乙醇低浓度组、乙醇中浓度组、乙醇高浓度组分别加入对应浓度(500、1 000、2 000 mmol/L)的乙醇(10 μL/孔)。继续培养24 h后,去培养液,各孔加入5 mg/mL MTT(100 μL/孔),继续培养4 h后,去上清液,各孔加入DMSO(200 μL/孔),570 nm处检测吸光度(A值),实验重复3次,计算不同乙醇浓度下肝细胞抑制率。选择能使肝细胞抑制率达到50%的乙醇浓度进行实验〔10-13〕。
2.3紫茉莉提取物对乙醇损伤的L-02肝细胞的影响以1×105个/mL的细胞悬液种板(96孔板,90 μL/孔)。设正常组、模型组、溶媒组和紫茉莉5个剂量组(A组、B组、C组、D组、E组),每组重复6孔,另设空白组6孔,加入完全培养基(90 μL/孔)。继续培养48 h后,空白组和正常组各孔加入完全培养基(10 μL/孔),其余各组各孔加入1 000 mmol/L乙醇(10 μL/孔)。继续培养8 h后,空白组、正常组和模型组各孔加入完全培养基(10 μL/孔),溶媒组各孔加入1%DMSO(10 μL/孔),紫茉莉A组、B组、C组、D组、E组分别依次加入对应浓度(1、3、9、27、81 mg/mL)的紫茉莉提取物(10 μL/孔)。继续培养16 h后,吸取培养液检测ALT活性(波长510 nm)、AST活性(波长510 nm)及SOD活性(波长450 nm)和MDA含量(波长530 nm)。各孔加入5 mg/mL MTT(100 μL/孔),继续培养4 h后,去上清液,各孔加入DMSO(200 μL/孔),酶标仪检测A值(波长570 nm),计算各组肝细胞抑制率〔10-13〕。实验重复3次。
2.4数据处理所得数据用均数±标准差(x¯±s)表示,用SPSS17.0统计软件对数据进行单因素方差分析和组间t检验。
3 结果与分析
3.1不同浓度乙醇对L-02肝细胞抑制率的影响乙醇终浓度为50 mmol/L时,肝细胞抑制率为32.22%,与正常组比较吸光度值明显减小,差异有统计学意义(P<0.01);乙醇终浓度为100 mmol/L和200 mmol/L时,肝细胞抑制率分别为51.79%、71.95%,与正常组比较吸光度值均明显减小,差异有统计学意义(P<0.01)。因此,选择中浓度乙醇(1 000 mmol/L)进行实验。见表1。
表1 不同浓度乙醇对L-02肝细胞抑制率的影响

表1 不同浓度乙醇对L-02肝细胞抑制率的影响
注:与正常组比较△△P<0.01。
分组正常组乙醇低浓度组乙醇中浓度组乙醇高浓度组终浓度/(mmol/L)—50 100 200 A值0.435±0.056 0.312±0.030△△0.220±0.055△△0.167±0.034△△细胞抑制率/%—32.22±6.04 51.79±7.93 71.95±4.63
3.2紫茉莉对乙醇损伤的L-02肝细胞抑制率的影响模型组肝细胞抑制率为53.38%,与正常组比较吸光度值明显减小,差异有统计学意义(P<0.01),表明造模成功。紫茉莉生药终浓度为45.9 mg/mL时肝细胞抑制率为36.03%,与模型组比较明显减小,差异有统计学意义(P<0.05);紫茉莉生药终浓度为137.7 mg/mL时肝细胞抑制率为27.21%,与模型组比较明显减小,差异有统计学意义(P<0.01)。见表2。
表2 紫茉莉对乙醇损伤的L-02肝细胞抑制率的影响(
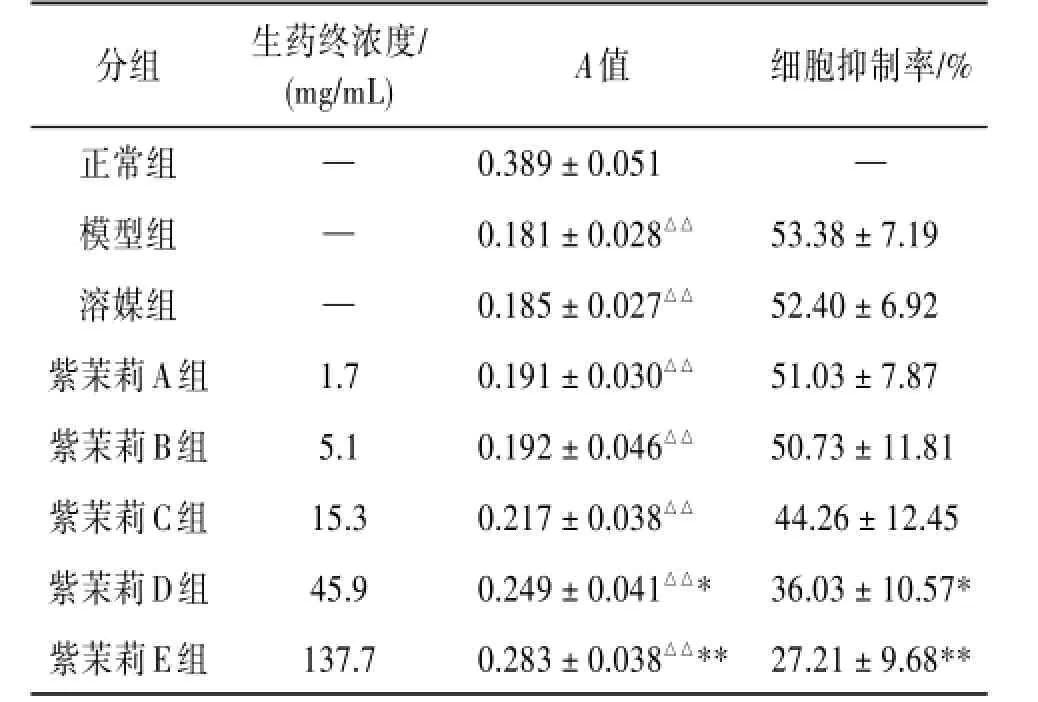
表2 紫茉莉对乙醇损伤的L-02肝细胞抑制率的影响(
注:与正常组比较△△P<0.01;与模型组比较*P<0.05,**P<0.01。
分组正常组模型组溶媒组紫茉莉A组紫茉莉B组紫茉莉C组紫茉莉D组紫茉莉E组生药终浓度/(mg/mL)——1.7 5.1 15.3 45.9 137.7 A值0.389±0.051 0.181±0.028△△0.185±0.027△△0.191±0.030△△0.192±0.046△△0.217±0.038△△0.249±0.041△△* 0.283±0.038△△**细胞抑制率/%—53.38±7.19 52.40±6.92 51.03±7.87 50.73±11.81 44.26±12.45 36.03±10.57* 27.21±9.68**
3.3紫茉莉对乙醇损伤的L-02肝细胞培养液中ALT和AST活性的影响与正常组比较,模型组肝细胞ALT和AST活性均明显增强,差异有统计学意义(P<0.01),表明造模成功。紫茉莉生药终浓度为15.3 mg/mL时肝细胞ALT和AST活性明显减弱,与模型组比较差异均有统计学意义(P<0.05)。紫茉莉生药终浓度为45.9 mg/mL和137.7 mg/mL时肝细胞ALT和AST活性均明显减弱,与模型组比较差异均有统计学意义(P<0.01)。见表3。
表3 紫茉莉对乙醇损伤的L-02肝细胞培养液中ALT和AST活性的影响
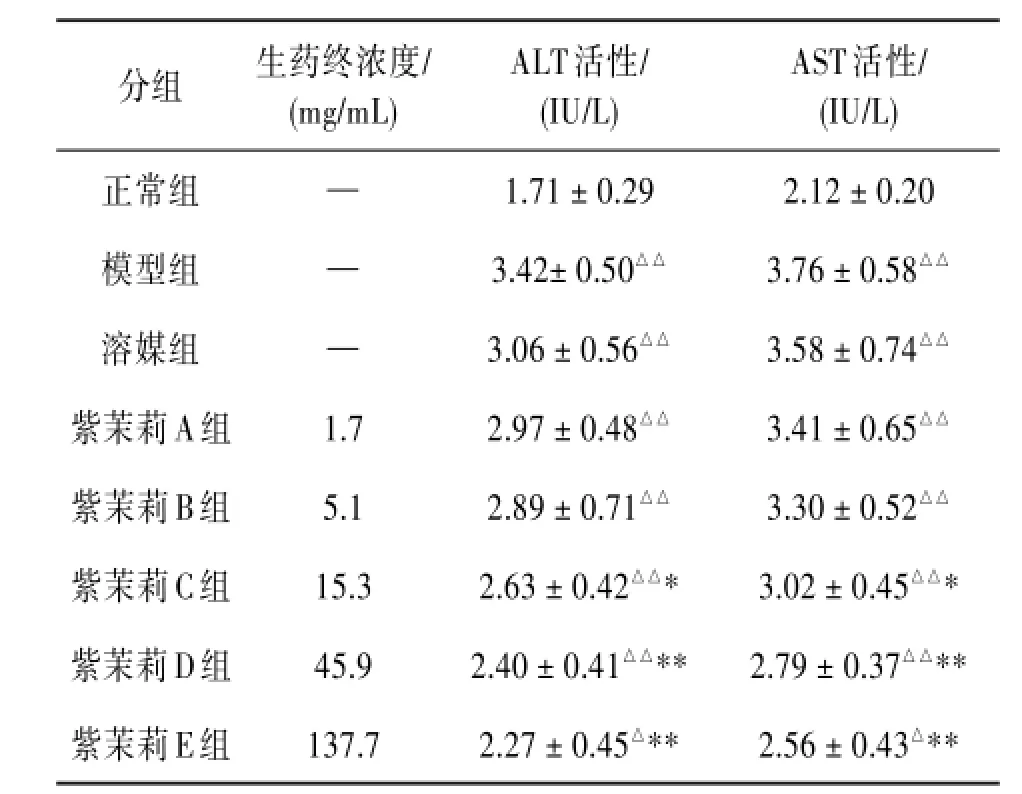
表3 紫茉莉对乙醇损伤的L-02肝细胞培养液中ALT和AST活性的影响
注:与正常组比较△P<0.05,△△P<0.01;与模型组比较*P<0.05,**P<0.01。
分组正常组模型组溶媒组紫茉莉A组紫茉莉B组紫茉莉C组紫茉莉D组紫茉莉E组生药终浓度/(mg/mL)——1.7 5.1 15.3 45.9 137.7 ALT活性/(IU/L)1.71±0.29 3.42±0.50△△3.06±0.56△△2.97±0.48△△2.89±0.71△△2.63±0.42△△* 2.40±0.41△△** 2.27±0.45△** AST活性/(IU/L)2.12±0.20 3.76±0.58△△3.58±0.74△△3.41±0.65△△3.30±0.52△△3.02±0.45△△* 2.79±0.37△△** 2.56±0.43△**
3.4紫茉莉对乙醇损伤的L-02肝细胞培养液中SOD活性及MDA含量的影响与正常组比较,模型组肝细胞SOD活性明显减弱,MDA含量明显升高,差异有统计学意义(P<0.01),表明造模成功。紫茉莉生药终浓度为15.3 mg/mL时肝细胞SOD活性增强,与模型组比较差异有统计学意义(P<0.05);紫茉莉生药终浓度为45.9 mg/mL和137.7 mg/mL时肝细胞SOD活性均明显增强,与模型组比较差异有统计学意义(P<0.01)。紫茉莉生药终浓度为5.1 mg/mL时肝细胞MDA含量降低,与模型组比较差异均有统计学意义(P<0.05);紫茉莉生药终浓度为15.3 mg/mL、45.9 mg/mL和137.7 mg/mL时肝细胞MDA含量均明显降低,与模型组比较差异均有统计学意义(P<0.01)。见表4。
表4 紫茉莉对乙醇损伤的L-02肝细胞培养液中SOD活性及MDA含量的影响

表4 紫茉莉对乙醇损伤的L-02肝细胞培养液中SOD活性及MDA含量的影响
注:与正常组比较△△P<0.01;与模型组比较*P<0.05,**P<0.01。
分组正常组模型组溶媒组紫茉莉A组紫茉莉B组紫茉莉C组紫茉莉D组紫茉莉E组生药终浓度/(mg/mL)——1.7 5.1 15.3 45.9 137.7 SOD活性/(U/mL)44.08±7.46 17.32±4.15△△17.61±3.79△△18.54±3.69△△20.90±4.31△△22.65±3.47△△* 25.16±2.39△△** 31.80±5.60△△** MDA含量/(nmol/mL)52.37±9.94 121.80±17.34△△118.31±12.50△△111.27±8.49△△104.23±11.98△△* 97.35±12.64△△** 82.06±8.35△△** 70.81±9.53△△**
4 讨论
乙醇经肝脏代谢,转化为乙醛和多种氧自由基,氧自由基攻击肝细胞膜,导致肝细胞脂质过氧化损伤,产生过氧化物(MDA等)。肝细胞过氧化损伤时,细胞膜通透性增加,ALT和AST由肝细胞内释放,细胞培养液中的ALT和AST活性增强。因此,检测肝细胞培养液中MDA含量、ALT和AST活性,可以判断肝细胞被乙醇氧化损伤的程度和药物治疗肝脏损伤的效果。抗氧化酶SOD活性的大小,可以反应肝细胞抗氧化能力的强弱,肝细胞代谢乙醇的过程中需要消耗大量的SOD。因此,检测肝细胞培养液中SOD活性,可以反映细胞抗氧化能力的增强和药物治疗肝脏损伤的效果。
实验表明,当紫茉莉生药终浓度达到或高于45.9 mg/mL时,可以使乙醇对L-02肝细胞的抑制率减小;当紫茉莉生药终浓度达到或高于15.3 mg/mL时,可以使受损的L-02肝细胞培养液中ALT和AST活性减弱,SOD活性增强,MDA含量减少。表明紫茉莉提取物可以减少乙醇对L-02肝细胞的损害,即紫茉莉提取物对乙醇损伤的L-02肝细胞有一定保护作用,提示紫茉莉在治疗酒精性肝损伤方面具有一定的价值。其机制可能与抗氧化有关,有待进一步研究。
〔1〕陈成伟.药物与中毒性肝病〔M〕.上海:上海科学技术出版社,2002:500-505.
〔2〕曾民德.防治酒精性肝病最有效的措施:戒酒〔J〕.中华肝脏病杂志,2003,11(11):645-646.
〔3〕JUNI P,ALTMAN D G,EGER M.Assessing the quality of controlled clinical trails〔J〕.BMJ,2001,323:42-46.
〔4〕中国科学院中国植物志编辑委员会.中国植物志:第40卷〔M〕.北京:科学出版社,1990.
〔5〕周金花,何燕平,梁绍兰,等.广西茉莉花叶总黄酮的抗氧化作用研究〔J〕.时珍国医国药,2014,25(9):2074-2076.
〔6〕陈业高,徐俊驹,吕瑜平,等.紫茉莉抗癌活性成分研究〔C〕//武汉:第八届全国中药和天然药物学术研讨会与第五届全国药用植物和植物药学学术研讨会论文集,2005.
〔7〕彭跃峰,鲁红学,李娜.紫茉莉提取物的抑菌活性〔J〕.农药,2009,48(2):147-149.
〔8〕李程瑶,程胜邦,罗爱莲,等.紫茉莉总提物对大鼠离体子宫平滑肌收缩活动的影响〔J〕.大理学院学报,2013,12(9):7-10.
〔9〕李凌智,吐尔逊娜依,阿不都拉·阿巴斯.紫茉莉花和叶中有效成分分析〔J〕.食品科学,2009,30(4):233-235.
〔10〕郭美仙,施贵荣,陈俊雅,等.紫茉莉含药血清对乙醇诱导L-02肝细胞损伤的防治作用〔J〕.中成药,2015,37(9):2035-2037.
〔11〕廖于,李龙辉,左国庆,等.体外诱导的酒精性脂肪肝细胞模型的建立、鉴定及机制探讨〔J〕.重庆医学,2010,39(8):902-904.
〔12〕叶红球.枳椇子水提取液对乙醇体外诱导肝细胞株L-02细胞损伤的影响〔D〕.长沙:中南大学,2012.
〔13〕朱慧玲,刘合生,戚向阳,等.罗汉果皂甙提取物对乙醇诱导L-02损伤的保护作用〔J〕.中国食品学报,2015,15(1):13-18.
Effect of Extracts form Mirabilis jalapa on the Damaged L-02 Human Embryo Hepatocytes Induced by Ethanol
Luo Ailian,Cheng Shengbang,Shen Lei,Chen Junya,Guo Meixian*
(Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D,Dali,Yunnan 671000,China)
Objective:To study the effect of extracts form Mirabilis jalapa on the damaged L-02 human embryo hepatocytes induced by ethanol.Methods:L-02 human embryo hepatocytes in logarithmic phase were chosen and damaged by ethanol at a final concentration of 100 mmol/L.After 8 hours,different concentrations of the extracts form Mirabilis jalapa were added in.After 16 hours of cultivation,MTT method was used to observe inhibition rate of L-02 human embryo hepatocytes damaged by ethanol,and Elisa method was used to detect the activity of glutamic-pyruvic transaminase(ALT),glutamic-oxalacetic transaminase(AST)and superoxide dismutase(SOD),and the content of malonaldehyde(MDA)in nutrient solution.Results:8 mg/mL or higher crude herbal concentrations of Mirabilis jalapa can significantly decrease inhibition rate of ethanol-induced damaged L-02 cells,obviously reduce ALT and AST activity,increase SOD activity and decrease MDA content in the culture for damaged cells.Conclusion:Extracts form Mirabilis jalapa has protective effect on the damaged L-02 cells induced by ethanol.
Mirabilis jalapa;ethanol;L-02 human embryo hepatocytes;protective effect
R285
A
2096-2266(2016)10-0005-04
(责任编辑李杨)
大理大学大学生科研基金资助项目(YHXSKY201310)
2016-01-13
2016-03-08
罗爱莲,2011级药学专业本科生.
*通信作者:郭美仙,实验师.
