HAV RT-PCR检测方法的建立及其在猪群中的流行调查
2016-11-18艾志琼李丽娟王云红申元英
艾志琼,张 玲,2,李丽娟,李 泽,王云红,申元英*
(1.大理大学公共卫生学院,云南大理671000;2.自贡市疾病预防控制中心,四川自贡643000;3.大理大学基础医学院,云南大理671000)
HAV RT-PCR检测方法的建立及其在猪群中的流行调查
艾志琼1,张玲1,2,李丽娟3,李泽1,王云红1,申元英1*
(1.大理大学公共卫生学院,云南大理671000;2.自贡市疾病预防控制中心,四川自贡643000;3.大理大学基础医学院,云南大理671000)
目的:了解屠宰生猪中甲型肝炎的流行情况,探讨猪作为HAV另一宿主和携带者的可能性,以期为人类甲肝的防治提供一定的理论依据。方法:采用酶联免疫吸附试验(ELISA)法对大理地区屠宰生猪血清中HAV IgG检测,逆转录-聚合酶链反应(RT-PCR)对屠宰生猪的全血和胆汁标本进行HAV RNA检测,以甲型肝炎患者的血液和胆汁为阳性对照标本。结果:①屠宰猪血清样本中检测出HAV的抗体阳性率为73.3%(374/510);②建立了甲型肝炎病毒的RT-PCR检测方法;③用RT-PCR在阳性对照标本中检出HAV RNA;④用RT-PCR在屠宰猪的全血和胆汁样本中未检出HAV RNA。结论:成功建立起RTPCR检测待测样本中的HAV RNA的方法;屠宰猪血清样本中检测出HAV的抗体阳性率较高;猪是否可以感染人的HAV还有待于进一步研究。
HAV;屠宰生猪;酶联免疫吸附试验;逆转录-聚合酶链反应;大理地区
[DOI]10.3969/j.issn.2096-2266.2016.10.022
甲型肝炎(Hepatitis A,HA)是由甲型肝炎病毒(Hepatitis A virus,HAV)引起的一种急性病毒性肝炎,是急性病毒性肝炎中感染率和发病率最高的一种〔1-2〕,是一种世界范围流行的常见肠道传染病。我国是甲型肝炎的高发地区之一,甲型肝炎已成为我国的一个重要公共卫生问题,越来越受到人们的重视〔3-4〕。1981年,詹美云等报道,HAV感染树鼩后在其体内检测出相关抗原抗体,近年来,屠宰猪血清中检出抗-HAV亦有报道〔5-6〕。这些研究表明,HAV除了能感染黑猩猩、恒河猴等灵长类动物,HAV也可能感染非灵长类动物。本研究用医用HAV诊断试剂盒检测屠宰猪血清中HAV标志物,以了解HAV在屠宰猪中的血清流行状况;用人HAV基因序列扩增屠宰猪HAV核苷酸序列以确定猪体内是否存在HAV的感染,由此探讨猪作为HAV另一宿主和携带者的可能性,以期为人类甲肝的防治提供一定的理论依据。
1 材料与方法
1.1样本收集大理地区屠宰场屠宰生猪血清、全血各510份(每头猪采血6 mL×2管,统一编号,其中1管用于分离血清,1管抗凝用于收集全血),收集胆囊176个,获取胆汁176份;收集大理州各医院甲肝患者的血液27份和胆汁32份,将扩增出目的条带的标本作为阳性对照。
1.2主要实验材料
1.2.1甲肝病毒来自冻干甲型肝炎减毒活疫苗。该疫苗是将甲型肝炎病毒H2减毒株接种于人倍体细胞KMB17株,经培养、收获病毒液、提取病毒,加稳定冻干剂制成。由大理市疾病预防控制中心提供。
1.2.2引物选取保守的VP3-VP1区的核苷酸序列设计引物,序列如下,上游引物P1∶5’-CCTT-GAGATTTCGTGTTC-3’,下游引物P2∶5’-CCTATTGGCTTTCCCTTT-3’,由上海生工生物技术有限公司合成。扩增的目的片段长度为347 bp。
1.2.3试剂盒TRNzol-A+总RNA提取试剂,北京TIANGEN公司。RevertAidFirstStrandcDNAsynthsis Kit、RT-PCR试剂盒、PCR Master Mix试剂盒均购自Thermo公司。
1.3方法
1.3.1血清学检测采用酶联免疫吸附试验(ELISA)法对血清中HAV IgG检测,严格按照试剂盒说明书进行操作。
1.3.2HAV疫苗复活备用将疫苗稀释剂加入冻干粉剂后,可见澄明液体,1.0 mL中含甲型肝炎活病毒不低于6.5l g CCID50。
1.3.3核酸提取直接取病毒悬液(新鲜血液或胆汁上清)0.25 mL,加入0.75 mL TRNzol-A+,充分振荡混匀,将样品在室温放置5 min;加入0.15 mL氯仿,盖好管盖,剧烈振荡15 s,室温放置3 min,4℃条件下12 000 r/min离心10 min,样品分为3层∶黄色有机相,中间层和上层无水相,RNA主要溶于水相中,把水相转移到新管中,在得到的水相溶液中加入等体积异丙醇,混匀,室温放置30 min;4℃条件下12 000 r/min离心10 min,去上清,加入0.75 mL 75%乙醇对沉淀进行洗涤;4℃条件下12 000 r/min离心5 min,去上清。室温放置晾干,加入100 μL RNase-free dd H2O,反复吹打、混匀,充分溶解RNA。随即进行RT或-70℃保存备用。
1.3.4RT-PCR扩增条件的摸索RT反应的摸索∶使用MMLV和AMV反转录酶分别进行实验;PCR扩增条件的摸索∶退火温度42~55℃,引物浓度从10~30 μmol/L,循环参数25~35。
1.3.5PCR产物的检测PCR产物用1.0%的琼脂糖,TAE电泳缓冲液,100 V 60 min电泳后用凝胶电泳成像分析系统观察结果,以产物中出现347 bp条带的样品为阳性。
2 结果
2.1血清学检测结果收集屠宰生猪血清510份,HAV-lgG阳性374份,阳性率73.3%。
2.2建立了甲型肝炎病毒的RT-PCR检测方法反转录∶RT反应采用20 μL体系,其组成如下∶模板RNA 7 μL,引物P2(10 μmol/L)2 μL,RNase-free ddH2O 3 μL,65℃5 min后立即冰上冷却;后继续添加5×Reaction Buffer 4 μL,Ribolock RNase抑制剂(20 U/μL)1 μL,dNTP mix(10 mm)2 μL,Revert Aid M-Mulv-RT(200 U/μL)1 μL。RT反应条件42℃60 min后70℃5 min。
PCR反应∶PCR反应体系采用50 μL体系,其组成如下∶10×PCR Buffer 5 μL、dNTP mix(10mM)1 μL、引物P1(10 μmol/L)1.5 μL、引物P2(10 μmol/L)1.5 μL、Taq酶0.25 μL、模板(cDNA)4 μL,ddH2O 36.5 μL。反应条件为∶95℃预变性,5 min;进入循环94℃30 s→47℃30 s→70℃,30 s,30个循环,72℃延伸7 min,最后4℃保存。用甲型肝炎减毒疫苗作为实验样本,经上述RT-PCR反应后电泳图。见图1。
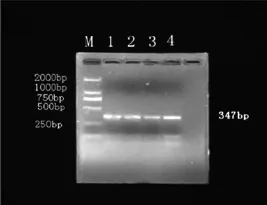
图1 甲型肝炎减毒疫苗RT-PCR电泳结果
2.3阳性对照RT-PCR结果运用建立的RT-PCR方法对收集的甲肝患者的27份血液和32份胆汁标本进行HAV RNA检测,有2份血液标本和1份胆汁标本成功扩增出目的条带,见图2。将此两份血液标本和1份胆汁标本作为阳性对照。
2.4猪血液和胆汁中HAV RNA检测结果运用建立的甲型肝炎病毒的RT-PCR方法对屠宰生猪的血液和胆汁标本,经RT-PCR扩增后电泳结果未见任何条带。见图2。

图2 屠宰生猪甲肝病毒PCR产物电泳图
3 讨论
在甲肝血清标志物中抗HAV-IgM是新近感染的标志,一般在发病后3~6个月转阴,是早期诊断甲型肝炎最简便和最可靠的血清学标志。抗HAVIgG属于保护性抗体,是机体具有免疫力的标志,一般在体内可持续多年或终身,HAV-IgG抗体阳性,提示接种过甲肝疫苗或以往感染过甲肝病毒,具有流行病学意义,可为制定有效、合理的预防措施提供科学依据〔7-10〕。本次调查发现大理地区屠宰生猪的HAV-lgG阳性率为73.3%,提示大多数屠宰猪通过自然感染获得了自身免疫,说明HAV在屠宰生猪中有较高的流行率。
PCR是具有高特异性和敏感性,是检测病毒常用的一种方法〔11-12〕。本研究用甲肝减毒活疫苗作为研究样本,成功建立起RT-PCR来检测方法,已分别从样人血液和胆汁标本中提取HAV RNA,并通过RT-PCR扩增出HAV目的基因片段,说明以血液和胆汁作为HAV RNA检测的标本是可行可靠的。但本研究未能在屠宰生猪血液和胆汁标本中扩增出目的基因,可能原因有∶一是猪源HAV与人类HAV基因序列差异较大,用人类HAV的引物无法扩增出目的基因。诸多研究已表明人类HAV具有一定程度的核苷酸和氨基酸异质性〔13-15〕。这些研究表明甲肝病毒如同其它RNA病毒一样,在生物体内存在密切相关的变异株分布。王昊〔16〕通过对不同甲型肝炎患者进行比较,发现不同患者各基因片段核苷酸变异率相差较大。可见,HAV在同物种不同个体间核苷酸变异较大,在不同物种间的基因序列差异较大也是可能的。另一种可能原因是甲型病毒性肝炎不是一种人畜共患病,猪不会感染人类甲型肝炎病毒。猪的血清中HAV-lgG阳性的出现可能是因为猪的细胞上有类似甲型肝炎病毒的抗原决定簇,导致HAV-lgG检测出现假阳性〔16〕。
目前,对HAV在不同物种间的研究甚少。本研究HAV血清学检测结果显示猪源HAV-lgG阳性率虽较高,但缺少分子生物学相关证据,因此,对于猪是否可以感染人类甲型肝炎病毒还有待于进一步的研究,甲型病毒性肝炎是否像戊型病毒性肝炎一样〔17〕,是一种人畜共患疾病,也有待于不同物种间HAV的深入研究。
〔1〕温群文,陈辉,段永,等.深圳市南山区健康人群HAVIgG抗体水平调查〔J〕.预防医学情报杂志,2005,21(4):447-448.
〔2〕雷明玉,周敬祝,蒋家立,等.一起甲肝暴发疫情的流行病学调查〔J〕.医学动物防制,2015,31(6):659-664.
〔3〕宁桂军,程萱芹,陈园生,等.贵州省旱灾期间一起甲型病毒性肝炎爆发的流行病学调查〔J〕.中国疫苗和免疫,2013,10(5):435-438.
〔4〕陈静,程慧健,张丽杰,等.江西省一起因饮用受污染的井水导致甲型肝炎暴发调查〔J〕.中华流行病学杂志,2011,32(10):1014-1017.
〔5〕张玲.甲型肝炎病毒在屠宰猪中感染情况调查〔D〕.大理:大理大学,2013.
〔6〕李丽娟,申元英,艾志琼,等.猪源甲、乙、戊型肝炎病毒血清流行病学调查〔J〕.四川生理科学杂志,2012,34(3):103-105.
〔7〕安婧,李慧,张晓曙,等.甘肃省重点地区15岁以下儿童甲型病毒性肝炎流行情况〔J〕.中国社会医学杂志,2015,32(5):327-359.
〔8〕刘重程,唐雅清,隋吉林,等.北京市昌平区自然人群甲型肝炎血清流行病学调查结果分析〔J〕.中国预防医学杂志,2013,14(7):557-558.
〔9〕路滟,廖玉学,董书贤,等.深圳市甲型病毒性肝炎血清流行病学调查〔J〕.中华疾病控制杂志,2015,19(6):631-634.
〔10〕赵晓敏,樊向云,周文亭,等.乌拉特前旗11-20岁人群甲型病毒性肝炎血清流行病学调查〔J〕.中国疫苗和免疫,2014,20(6):533-535.
〔11〕徐德顺,朱晓娟,陈莉萍,等.轮状病毒星状病毒和甲型肝炎病毒的单管多重荧光定量RT—PCR检测方法研究〔J〕.浙江预防医学,2015,27(4):357-361.
〔12〕卫海燕,黄学勇,许玉玲,等.EV71病毒核酸快速检测方法的比较〔J〕.病毒学报,2012,2(6):670-673.
〔13〕SANCHEZ G,BOSCH A,GOMEZ-MARIANO G,et al. Evidence for qiiasispecies distributions in the human hepatitis A virus genome〔J〕.Virology,2003,315(1):34-42.
〔14〕SULBARAN Y,GUTIERREZ C R,MARQUEZ B,et al. Hepatitis A virus genetic diversity in Venezuela:exclusive circulation of subgenotype lA and evidence of quasispecies distribution in the isolates〔J〕.Journal of medical virology,2010,82(11):1829-1834.
〔15〕COSTA-MATTIOLI M,DOMINGO E,CRISTINA J.Analysis of sequential hepatitis A virus strains reveals coexistence of distinct viral subpopulations〔J〕.The JoumaI of general virology,2006,87(1):115-118.
〔16〕王昊.我国甲肝病毒流行株全基因组序列分析及准种变异研究〔D〕.北京:中国疾病预防控制中心病毒病预防控制所,2014.
〔17〕朱光泽.戊型肝炎流行病学和戊型肝炎病毒全基因克隆与表达研究〔D〕.吉林:吉林大学畜牧兽医学院,2007.
Establishment of Hepatitis A Virus RT-PCR Detection Method and Its Epidemiological Investigation in Swinery
Ai Zhiqiong1,Zhang Ling1,2,Li Lijuan3,Li Ze1,Wang Yunhong1,Shen Yuanying1*
(1.College of Public Health,Dali University,Dali,Yunnan 671000,China;2.Disease Control and Prevention Centers of Zigong,Zigong,Sichuan 643000,China;3.Pre-clinical College,Dali University,Dali,Yunnan 671000,China)
Objective:To study the epidemic state of the Hepatitis A Virus(HAV)infection in swinery,and to explore the possibility of swine as another host or carrier of HAV for providing basis for prevention and controlling measures of human HA.Methods:Serum HAV-IgG of swine in Dali was detected by enzyme-linked immunosorbent assay(ELISA),and HAV-RNA of swine blood and swine bile samples were tested by reverse transcription-polymerase chain reaction(RT-PCR),with the blood and bile of HAV as positive control.Results:①HAV antibody positive rate of the blood samples of swine were detected as 73.3%(374/510);②RT-PCR method was built to detect HAV;③HAV-RNA of positive control samples were detected with RT-PCR;④HAV-RNA of swine blood and swine bile samples were not detected with RT-PCR.Conclusion:RT-PCR method is successfully built to detect HAV-RNA.The antibody positive rate of HAV is rather high in the blood sample of swine.Further research is necessary to demonstrate whether the swine could infect human HAV.
Hepatitis A virus(HAV);swine;Enzyme-linked immunosorbent assay(ELISA);Reverse transcription-Polymerase chain reaction(RT-PCR);Dali
R512.91
A
2096-2266(2016)10-0081-04
(责任编辑董杰)
云南省科技厅青年基金资助项目(2012FD035);云南省科技厅应用基础研究面上项目基金资助(2013FB060)
2016-03-09
2016-05-02
艾志琼,讲师,主要从事分子流行病学研究.
*通信作者:申元英,教授.
