硫普罗宁联合拉米夫定在肺结核合并慢性乙型肝炎治疗中的作用
2016-11-18康定理胡秀琼高红英成都市温江区人民医院药剂科成都61110成都市温江区人民医院呼吸内科成都61110成都市温江区人民医院护理部成都61110成都市温江区人民医院消化内科成都61110
王 飞,康定理,胡秀琼,李 芳,高红英(1.成都市温江区人民医院药剂科,成都 61110;.成都市温江区人民医院呼吸内科,成都 61110;.成都市温江区人民医院护理部,成都 61110;.成都市温江区人民医院消化内科,成都 61110)
硫普罗宁联合拉米夫定在肺结核合并慢性乙型肝炎治疗中的作用
王飞1*,康定理2#,胡秀琼3,李芳4,高红英2(1.成都市温江区人民医院药剂科,成都611130;2.成都市温江区人民医院呼吸内科,成都611130;3.成都市温江区人民医院护理部,成都611130;4.成都市温江区人民医院消化内科,成都611130)
目的:探讨硫普罗宁联合拉米夫定在肺结核合并慢性乙型肝炎(以下简称“乙肝”)治疗中的作用及安全性。方法:将150例确诊为肺结核合并慢性乙肝的患者按随机数字表法分为A组(药物联合组)、B组(拉米夫定组)、C组(对照组),各50例。3组患者均采用异烟肼+利福喷丁+乙胺丁醇+左氧氟沙星(2HTELfx/4HT)方案进行抗结核治疗及常规保肝药物治疗等;B组患者在此基础上口服拉米夫定片0.1 g,qd;A组患者在B组治疗基础上加服硫普罗宁片0.3 g,tid。3组患者疗程均为6个月。观察3组患者治疗前后的肝损伤情况、血清纤维化指标与治疗后的乙肝病毒学指标、临床疗效和不良反应发生情况。结果:治疗后,C组患者血清ALT、AST、TBIL水平较治疗前明显升高,A组患者上述指标水平较治疗前明显降低,差异均有统计学意义(P<0.05);B组患者上述指标与治疗前比较差异无统计学意义(P>0.05);治疗后血清ALT、AST、TBIL水平A组<B组<C组,差异均有统计学意义(P<0.05)。3组患者治疗后HBsAg转阴率、HBeAg转阴率与HBV-DNA转阴率比较,差异均无统计学意义(P>0.05)。C组患者各项血清纤维化指标水平与治疗前比较,差异均无统计学意义(P>0.05);A、B组患者各项血清纤维化指标水平均较治疗前明显降低,差异均有统计学意义(P<0.05);治疗后各项血清纤维化指标水平A组<B组<C组,差异均有统计学意义(P<0.05)。A、B、C组患者的总有效率分别为94.00%、76.00%、62.00%,组间比较差异有统计学意义(P<0.05);不良反应发生率分别为14.00%、16.00%、30.00%,组间比较差异无统计学意义(P>0.05)。结论:硫普罗宁联合拉米夫定能明显减轻抗结核药物对患者肝功能的损伤,有利于肺结核治疗的顺利进行,且不良反应较少。
硫普罗宁;拉米夫定;肺结核;慢性乙型肝炎;肝损伤
据近年来文献报道,我国有约600万例结核病患者和约9 300万例慢性乙型肝炎(以下简称“乙肝”)病毒(HBV)感染患者,其中肺结核合并慢性乙肝的发病率高达39%左右[1-2]。研究发现,慢性乙肝患者在抗结核治疗过程中药物性肝损伤的发生率大约为30%~50%[3]。在抗结核治疗过程中,机体会对HBV产生特异性免疫反应,加之抗结核药物能直接损伤肝细胞,从而严重影响患者的肝功能,甚至会导致急性肝功能衰竭;但是,停用抗结核药物会增强结核分枝杆菌的耐药性,严重影响患者的预后[4]。因此,如何在保证抗结核治疗有效性的同时减少肝功能损伤,是亟待解决的问题。目前,治疗慢性乙肝的常用药物有干扰素、阿德福韦酯、拉米夫定和硫普罗宁等,其中应用较为广泛的为拉米夫定和硫普罗宁,两者对慢性乙肝的有效性和安全性已得到大量临床研究证实[5-6]。本研究在对肺结核合并慢性乙肝患者行常规治疗的同时,采用硫普罗宁联合拉米夫定预防抗结核药物治疗过程中的肝功能损伤和病毒复制加重,取得了较好的临床效果,现报道如下。
1 资料与方法
1.1纳入与排除标准
纳入标准:(1)依据2001年中华医学会结核病学分会制定的《肺结核诊断和治疗指南》[7]诊断为肺结核;(2)依据2010年中华医学会肝病学分会和感染病学分会制定的《慢性乙型肝炎防治指南》[8]诊断为慢性乙肝;(3)HBV表面抗原阳性,HBVDNA≤105copies/ml、丙氨酸转氨酶(ALT)≤2倍正常值上限、总胆红素(TBIL)≤2倍正常值上限;(4)有发热、乏力、盗汗等肺结核临床表现;(5)无心、脑、肾等重要脏器功能障碍;(6)患者及其家属均知情同意并签署知情同意书。
排除标准:(1)合并肝癌、慢性肝硬化或其他类型肝炎者;(2)妊娠或哺乳期妇女;(3)严重精神障碍者;(4)对抗结核药物和拉米夫定、硫普罗宁等药物过敏者;(5)药物治疗过程中依从性较差者。
1.2研究对象
本研究方案经医院医学伦理委员会审核通过后,选择2010年3月-2015年3月确诊为肺结核合并慢性乙肝且在我院呼吸内科治疗的患者150例,其中男性78例,女性72例。按随机数字表法将患者分为A(药物联合组)、B(拉米夫定组)、C(对照组)组,每组50例。A组患者男性27例,女性23例;年龄23~59岁,平均(36.2±7.1)岁;肺结核类型:血行播散型肺结核18例,继发性肺结核32例;肺结核病程3~8年,平均(5.9± 1.8)年;乙肝病程6~15年,平均(8.1±2.7)年。B组患者男性25例,女性25例;年龄27~62岁,平均(36.6±8.8)岁;肺结核类型:血行播散型肺结核19例,继发性肺结核31例;肺结核病程4~9年,平均(6.1±2.1)年;乙肝病程7~13年,平均(8.3± 3.1)年。C组患者男性26例,女性24例;年龄25~63岁,平均(37.1±7.9)岁;肺结核类型:血行播散型肺结核20例,继发性肺结核30例;肺结核病程3~7年,平均(6.2±2.5)年;乙肝病程5~14年,平均(7.9±2.8)年。3组患者的性别、年龄、肺结核类型、肺结核病程、乙肝病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.3治疗方法
3组患者均采用2HTELfx/4HT方案进行抗结核治疗(H:异烟肼0.3 g/d;T:利福喷丁0.45 g、每周2次;E:乙胺丁醇0.75 g/d;Lfx:左氧氟沙星0.4 g/d)+常规保肝药物(如甘草酸二铵或护肝片等)治疗。B组患者在此基础上口服拉米夫定片(安徽贝克生物制药有限公司,批准文号:国药准字H20103618,规格:0.1 g)0.1 g,qd。A组患者在B组治疗基础上加服硫普罗宁片(成都倍特药业有限公司,批准文号:国药准字H20073812,规格:0.1 g)0.3 g,tid。治疗过程中每个月检测患者肝肾功能,若ALT或天冬氨酸转氨酶(AST)≥120 U/L、TBIL≥34.2 μmol/L则停止抗结核治疗,转为静脉滴注甘草酸二铵或还原性谷胱甘肽等解毒治疗,待转氨酶、TBIL降至正常,再恢复抗结核治疗。3组患者疗程均为6个月。
1.4观察指标与疗效评价
(1)3组患者治疗前后血清ALT、AST、TBIL水平。(2)3组患者治疗后乙肝表面抗原(HBsAg)转阴率、乙肝e抗原(HBeAg)转阴率与HBV-DNA转阴率。(3)3组患者治疗前后Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)与血清透明质酸(HA)水平。(4)3组患者临床疗效。疗效评价方法[9]——显效:临床症状及体征消失,肝脾肿大缩小,肝功能恢复正常,血清HBVDNA<105copies/ml;有效:临床症状及体征基本消失,肝脾肿大程度稳定,肝功能基本正常,血清HBV-DNA<105copies/ ml,但HBeAg(+);无效:临床症状及体征无改善或恶化,肝功能及血清指标未达到上述标准。总有效率=(显效例数+有效例数)/总例数×100%。(5)不良反应发生情况。
1.5统计学方法
应用SPSS 20.0软件对数据进行统计分析。计量资料以±s表示,采用方差分析;计数资料以例或率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.13组患者肝损伤情况比较
治疗前,3组患者血清ALT、AST、TBIL水平比较,差异均无统计学意义(P>0.05)。治疗后,C组患者血清ALT、AST、TBIL水平较治疗前明显升高,A组患者上述指标水平较治疗前明显降低,差异均有统计学意义(P<0.05);B组患者上述指标与治疗前比较差异无统计学意义(P>0.05)。A组患者治疗后血清ALT、AST、TBIL水平明显低于B、C组,B组患者治疗后上述指标水平明显低于C组,差异均有统计学意义(P<0.05)。3组患者肝损伤情况比较见表1。
表1 3组患者肝损伤情况比较(±s)Tab 1 Comparison of liver damage among 3groups(±s)

表1 3组患者肝损伤情况比较(±s)Tab 1 Comparison of liver damage among 3groups(±s)
注:与治疗前比较,*P<0.05;与C组比较,#P<0.05;与B组比较,&P<0.05Note:vs.before treatment,*P<0.05;vs.group C,#P<0.05;vs.group B,&P<0.05
TBIL,μmol/L 19.3±2.1 16.1±1.9*#&18.9±1.5 19.4±2.5#18.8±2.3 23.1±2.8*组别A组n 50 B组50 C组50时期治疗前治疗后治疗前治疗后治疗前治疗后ALT,U/L 65.3±8.5 55.2±6.7*#&66.8±11.3 64.7±10.5#65.7±9.7 77.3±10.2*AST,U/L 65.7±8.8 50.5±7.6*#&66.1±11.3 64.8±9.2#66.6±9.5 78.6±10.1*
2.23组患者乙肝病毒学指标比较
治疗后,3组患者HBsAg转阴率、HBeAg转阴率与HBVDNA转阴率比较,差异均无统计学意义(P>0.05),具体见表2。

表2 3组患者乙肝病毒学指标比较(%%)Tab 2 Comparison of hepatitis B virology indexes among 3 groups(%%)
2.33组患者治疗前后血清纤维化指标比较
治疗前,3组患者PCⅢ、Ⅳ-C、HA水平比较,差异均无统计学意义(P>0.05)。治疗后,C组患者各血清纤维化指标水平与治疗前比较,差异均无统计学意义(P>0.05);A、B组患者各血清纤维化指标水平较治疗前明显降低,差异均有统计学意义(P<0.05)。B组患者治疗后各血清纤维化指标水平明显低于C组,A组患者治疗后各血清纤维化指标水平明显低于B、C组,差异均有统计学意义(P<0.05)。3组患者治疗前后血清纤维化指标比较见表3。
表3 3组患者治疗前后血清纤维化指标比较(±s ,ng/ml)Tab 3 Comparison of serum fibrosis indexes among 3 groups before and after treatment(±s ,ng/ml)
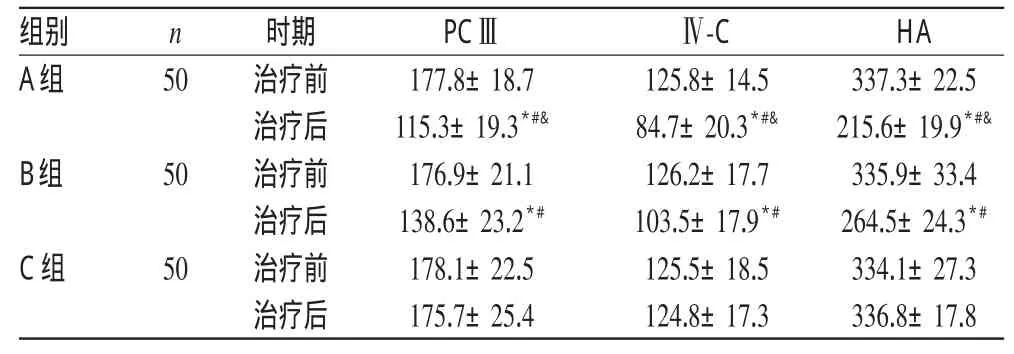
表3 3组患者治疗前后血清纤维化指标比较(±s ,ng/ml)Tab 3 Comparison of serum fibrosis indexes among 3 groups before and after treatment(±s ,ng/ml)
注:与治疗前比较,*P<0.05;与C组比较,#P<0.05;与B组比较,&P<0.05Note:vs.before treatment,*P<0.05;vs.group C,#P<0.05;vs.group B,&P<0.05
A组337.3±22.5 215.6±19.9*#&335.9±33.4 264.5±24.3*#334.1±27.3 336.8±17.8 50 B组50 C组50治疗前治疗后治疗前治疗后治疗前治疗后177.8±18.7 115.3±19.3*#&176.9±21.1 138.6±23.2*#178.1±22.5 175.7±25.4 125.8±14.5 84.7±20.3*#&126.2±17.7 103.5±17.9*#125.5±18.5 124.8±17.3
2.43组患者临床疗效比较
A组患者总有效率为94.00%,B组为76.00%,C组为62.00%,组间比较差异有统计学意义(P<0.05),具体见表4。

表4 3组患者临床疗效比较Tab 4 Comparison of clinical efficacy among 3groups
2.5不良反应
A组患者出现3例恶心呕吐、2例皮疹、2例皮肤瘙痒,B组患者出现3例恶心呕吐、3例皮疹、1例皮肤瘙痒、1例黄疸,C组患者出现6例恶心呕吐、4例黄疸、3例皮疹、2例皮肤瘙痒。3组患者不良反应发生率分别为14.00%、16.00%、30.00%,差异无统计学意义(χ2=4.75,P=0.09)。
3 讨论
肺结核合并慢性乙肝患者的抗结核治疗过程中,尤其在强化治疗阶段,抗结核药物如异烟肼、利福平等多会引发药物性肝损伤,其中异烟肼通过其代谢产物的氧化应激而产生肝损伤,利福平通过影响肝脏的脂质代谢而产生肝脏毒性。因此,为保证抗结核治疗的顺利进行,肺结核合并慢性乙肝患者的常规治疗过程必须强调保肝治疗[10-11]。
本研究结果显示,治疗后,C组患者血清ALT、AST、TBIL水平均较治疗前明显升高,B组患者上述指标水平与治疗前比较无显著差异,A组患者上述指标水平均较治疗前明显降低,治疗后血清ALT、AST、TBIL水平A组<B组<C组。这反映了肺结核合并慢性乙肝患者在抗结核治疗过程中发生了肝损伤,常规保肝药物如甘草酸二铵等对肝脏的保护作用较为局限,而硫普罗宁联用拉米夫定在减少肝损伤、恢复肝功能方面优于单纯使用拉米夫定。虽然3组患者治疗后的HBsAg转阴率、HBeAg转阴率与HBV-DNA转阴率无明显差异,但A组和B组患者治疗后的血清PCⅢ、Ⅳ-C、HA水平均较治疗前明显降低,且A组<B组<C组。这说明了硫普罗宁联合拉米夫定能明显减轻肝脏炎症反应,减缓乃至扭转肝脏纤维化的进程。3组患者总有效率的比较结果更证实了硫普罗宁联用拉米夫定在维持抗结核治疗的顺利进行及减少肝损伤中的作用。
硫普罗宁作为一种含有活性巯基的甘氨酸衍生物,可以降低肝脏中的氧自由基含量,减少氧自由基对肝细胞膜和线粒体的损伤,维持还原性谷胱甘肽水平,增强肝脏的解毒功能[12];同时,其能降低肝脏三磷酸腺苷(ATP)酶的活性,提高ATP含量,保证呼吸链电子传递功能,从而恢复肝脏功能。此外,硫普罗宁在机体内水解后形成甘氨酸系氨基酸,含有一碳单位,能促进嘌呤核苷酸的合成,进而促进肝细胞的再生[13];且其可通过肾脏代谢,避免在肝脏蓄积而导致的肝脏负荷过重现象[14]。拉米夫定作为一种常用的治疗慢性乙肝的核苷酸类似物,能特异性地抑制HBV-DNA聚合酶的活性而阻断DNA复制,减少肝细胞内HBV载量,继而减轻肝脏炎症,降低HBV对肝脏的损伤,延缓肝脏纤维化进程,改善肝脏功能[15-16]。同时,有研究显示,拉米夫定能有效提高乙肝患者T淋巴细胞水平,增强机体抗病毒能力,抑制HBV在肝脏内的复制[17]。总之,硫普罗宁能减轻抗结核药物导致的肝损伤,保护肝细胞;拉米夫定能明显缓解HBV导致的肝损伤,减少HBV载量;两种药物分别从两种途径改善肺结核合并乙肝患者的肝功能,降低转氨酶水平,减轻肝损伤,存在协同治疗作用。
综上所述,硫普罗宁联合拉米夫定能明显减轻抗结核药物对患者肝功能的损伤,有利于肺结核治疗的顺利进行,且不良反应较少。但本研究样本较小,尚需大样本、多中心试验对本结论进一步验证。
[1]邓国防,孙丽珍,雷建平,等.拉米夫定联合抗结核药物治疗肺结核合并乙型肝炎病毒携带者的临床分析[J].中国防痨杂志,2014,36(2):104.
[2]姚君,钟皓成,章丹丹.莫西沙星与左氧氟沙星治疗中青年耐多药肺结核病的疗效比较[J].中国药房,2013,24(20):1884.
[3]Animesh R.Comments on:Risk factors for drug induced hepatitis with first-line antituberculosis drugs in hospitalized patients of pulmonary tuberculosis[J].J Postgrad Med,2014,60(2):224.
[4]Srilohasin P,ChaiprasertA,Tokunaga K,et al.Genetic diversity and dynamic distribution of Mycobacterium tuberculosis isolates causing pulmonary and extrapulmonary tuberculosis in Thailand[J].J Clin Microbiol,2014,52(12):4267.
[5]Wang G,Liu Y,Qiu P,et al.Cost-effectiveness analysis of lamivudine,telbivudine,and entecavir in treatment of chronic hepatitis B with adefovir dipivoxil resistance[J]. Drug Des Devel Ther,2015,9:2839.
[6]陈长寅,覃宗坦,邱绍勤.硫普罗宁活化慢性乙型肝炎超氧化物歧化酶的初步研究[J].中华实验和临床病毒学杂志,2000,14(4):355.
[7]中华医学会结核病学分会.肺结核诊断和治疗指南[J].中华结核和呼吸杂志,2001,24(2):70.
[8]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南:2010年版[J].中华传染病杂志,2011,29(2):65.
[9]叶素素,张新雷,徐伟.替比夫定、阿德福韦酯联用与恩替卡韦单药治疗失代偿期乙肝肝硬化疗效对比观察[J].山东医药,2015,55(2):65.
[10]Aktas AE,Yigit N,Ayyildiz A,et al.Comparison of the mycobacterium growth indicator tube method and the method of proportion for drug susceptibility testing of mycobacterium tuberculosis[J].Eurasian J Med,2014,46(2):96.
[11]de Knegt GJ,Ten KM,van Soolingen D,et al.Enhancement of in vitro activity of tuberculosis drugs by addition of thioridazine is not reflected by improved in vivo therapeutic efficacy[J].Tuberculosis:Edinb,2014,94(6):701.
[12]Li XP,Wen F,Yang W,et al.The role of tiopronin for the prevention of chemotherapy-related liver toxicity in advanced colorectal cancer patients treated with mFOLFOX7:a prospective analysis[J].Tumori,2014,100(4):446.
[13]Bao QY,Geng DD,Xue JW,et al.Glutathione-mediated drug release from Tiopronin-conjugated gold nanoparticles for acute liver injury therapy[J].Int J Pharm,2013,446(1/2):112.
[14]Tang MC,Cheng L,Qiu L,et al.Efficacy of tiopronin in treatment of severe non-alcoholic fatty liver disease[J]. Eur Rev Med Pharmacol Sci,2014,18(2):160.
[15]Cho YK,Cui XJ,Jeong SU,et al.Different mechanism of selection of adefovir-resistant mutant viruses during adefovir monotherapy in patients with lamivudine-resistant chronic hepatitis B[J].Antiviral Res,2014,112:8.
[16]Woo HY,Choi JY,Yoon SK,et al.Rescue therapy with adefovir in decompensated liver cirrhosis patients with lamivudine-resistant hepatitis B virus[J].Clin Mol Hepatol,2014,20(2):168.
[17]Yim HJ,Lee HJ,Suh SJ,et al.Adefovir and lamivudine combination therapy in patients with entecavir-resistant chronic hepatitis B:antiviral responses and evolution of mutations[J].Intervirology,2014,57(5):239.
(编辑:胡晓霖)
Effects of Tiopronin Combined with Lamivudine on the Treatment of Pulmonary Tuberculosis Combined with Chronic Hepatitis B
WANG Fei1,KANG Dingli2,HU Xiuqiong3,LI Fang4,GAO Hongying2(1.Dept.of Pharmacy,Chengdu Wenjiang District People’s Hospital,Chengdu 611130,China;2.Dept.of Respiratory Medicine,Chengdu Wenjiang District People’s Hospital,Chengdu 611130,China;3.Dept.of Nursing,Chengdu Wenjiang District People’s Hospital,Chengdu 611130,China;4.Dept.of Gastroenterology,Chengdu Wenjiang District People’s Hospital,Chengdu 611130,China)
OBJECTIVE:To investigate clinical efficacy and safety of tiopronin combined with lamivudine in the treatment of pulmonary tuberculosis complicated with chronic hepatitis B.METHODS:150 cases diagnosed as pulmonary tuberculosis with chronic hepatitis B were randomly divided into group A(drug combination group),group B(lamivudine group)and the group C(control group),with 50 cases in each group.3 groups were given isoniazid+rifapentine+ethambutol+levofloxacin(2HTELfx/4HT)anti-TB treatment and liver protection treatment,etc.Group B was additionally given Lamivudine tablet orally,0.1 g,qd;group A was additionally given Tiopronin tablet 0.3 g,tid,on the basis of group B.The treatment course of 3 groups lasted for 6 months. Liver damage,serum fibrosis indexes of 3 groups were observed in 3 groups before and after treatment as well as hepatitis B virology indexes,clinical efficacy and the occurrence of ADR after treatment.RESULTS:After treatment,serum levels of ALT,AST and TBIL weresignificantly increased in group C,significantly decreased in group A,with statistical significance(P<0.05).There was no statistical significance in above indexes of group B before and after treatment(P>0.05).Serum levels of ALT,AST and TBIL after the treatment:group A<group B<group C,with statistical significance(P<0.05).There were no significant difference in the negative rate of HBsAg,the negative rate of HBeAg,the negative rate of HBV-DNA among 3 groups after treatment(P>0.05).Serum fibrosis indexes of group A and B decreased significantly compared to before treatment,with statistical significance(P<0.05);serum fibrosis indexes after the treatment:group A<group B<group C,with statistical significance(P<0.05).The total effective rate were 94.00%,76.00%and 62.00%respectively in group A,group B and group C,with statistical significance(P<0.05).The incidence of ADR were 14.00%,16.00%and 30.00%respectively,withoutstatisticalsignificance(P>0.05).CONCLUSIONS:Tiopronin combined with lamivudine can significantly reduce liver function damage caused by anti-TB drugs.It is conducive to the smooth progress of tuberculosis chemotherapy with fewer adverse reactions.
Tiopronin;Lamivudine;Pulmonary tuberculosis;Chronic hepatitis B;Liver damage
R521;R512.6+2
A
1001-0408(2016)29-4112-04
10.6039/j.issn.1001-0408.2016.29.26
*副主任药师。研究方向:临床药学。电话:028-82722707。E-mail:1015964815@qq.com
副主任医师。研究方向:呼吸内科学。电话:028-82723884。E-mail:kangdingli2015@163.com
(2015-11-02
2016-01-28)
