羊口疮疫苗对兔体液免疫和细胞免疫的影响
2016-11-18张七斤安维雪涂明亮张志丹
李 智,张七斤,安维雪,涂明亮,张志丹,李 娜,仲 亮
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
羊口疮疫苗对兔体液免疫和细胞免疫的影响
李智,张七斤,安维雪,涂明亮,张志丹,李娜,仲亮
(内蒙古农业大学兽医学院,内蒙古呼和浩特010018)
为深入研究羊口疮疫苗诱导机体产生免疫效应的分子机理,用羊口疮疫苗免疫兔,并对其血清中的特异性抗体水平和外周血免疫相关细胞因子的表达水平进行研究。将500 mL灭活的羊口疮病毒感染细胞毒液和经超声波破碎的灭活羊口疮病毒感染细胞毒液分别浓缩至100 mL,按照佐剂说明书比例,分别与弗氏佐剂、201VG、1313VG、GEL01、11R VG混匀。另外,取灭活的羊口疮痂皮毒液10 mL与201 VG混匀,制备成疫苗。用所制备的不同佐剂疫苗各免疫2只兔子。在免疫后不同时间采集外周血,应用琼脂免疫扩散方法检测血清中特异性抗体效价,同时应用实时荧光定量PCR方法检测外周血中细胞因子表达水平。结果显示:在兔子接种羊口疮疫苗后期,血清中抗体效价除了“1313VG+未破碎病毒”组为1:8之外,其他组别的抗体效价均达到1:16或 1:32;各组别外周血中Th1型细胞因子(IL-2 、IFN-ɣ、TNF-α)的表达量与对照组相比总体上升,而Th2型细胞因子(IL-4、IL-6)的表达量总体呈下降趋势。结果表明,羊口疮疫苗可以同时诱导机体产生细胞免疫应答和体液免疫应答,但对该两种免疫应答的诱导水平不同。
羊口疮疫苗;体液免疫;细胞免疫;特异性抗体;细胞因子;佐剂
羊传染性脓疱(Contagious Ecthyma,CE)又称羊口疮(ORF),是由羊口疮病毒(ORF virus,ORFV)引起的山羊和绵羊的一种急性、接触性传染病,人和其他动物也可感染[1]。近年来,随着我国养羊业的快速发展,羊口疮引起的经济损失越来越严重。目前还没有治疗羊口疮的特效药。由于羊口疮病毒免疫的特殊性和其他一些原因,至今为止尚未研制成功安全、高效的羊口疮病毒疫苗。目前预防羊口疮的弱毒疫苗存在毒力返强等缺点[2]。除此之外,人们对羊口疮疫苗的免疫应答机理尚不十分清楚。为了降低羊口疮带来的经济损失,研究羊口疮病毒的免疫应答机理和研制免疫效果良好的羊口疮疫苗十分必要。
本研究根据琼脂免疫扩散试验具有的简便、快捷、低廉等特点,将其用于特异性抗体检测;利用实时荧光定量PCR具有的重复性好、特异性强、敏感性高等特点,将其用于mRNA检测[3]。通过检测兔外周血中特异性抗体和上述几种细胞因子的表达水平,为探究羊口疮疫苗的免疫机制和研发新型羊口疮疫苗提供有益的理论参考依据。
1 材料与方法
1.1 病毒
羊口疮病毒株,2015年由涂明亮分离到并命名为ORFV-Q株。通过病毒滴度测定,其TCID50为10-5.5/0.1 mL。毒株由内蒙古农业大学传染病实验室保存。
1.2 试验动物
健康的26只成年雌性兔子购自呼和浩特市周边某集约化养殖场。
1.3 主要试剂
弗氏完全佐剂和弗氏不完全佐剂,购自SIGMA公司;MONTANIDETMISA 201 VG、MONTANIDETMIMS 1313 N PR VG、MONTANIDETMGEL01、MONTANIDETMISA 11R VG,均由赛彼科公司馈赠;2×Easy Taq SuperMix,购自北京全式金生物技术有限公司;兔外周血淋巴细胞分离液试剂盒,购 自 Solarbio公 司;RNAiso Plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBRRPremix Ex TaqTM, 均购自宝生物工程(大连)有限公司。
1.4 主要仪器
250D型数字式细胞粉碎仪,购自美国BRANSON公司;5417R型低温高速离心机,购自德国Eppendorf公司;22331型PCR仪,购自德国Eppendorf公司;Syngene G:BOX凝胶成像仪,购自英国SYNGENE公司;恒温水浴锅,购自北京市长风仪器仪表公司;CFX™ 96 Real-Time PCR仪,购自Bio-Rad公司。
1.5 引物设计及合成
根据GenBank 中IL-2、IL-4、IL-6、TNF-α和IFN-ɣ基因的序列,分别在各基因的保守区设计特异性引物[4]。引物由生工生物工程(上海)有限公司合成(表1)。

表1 本实验所用各引物序列及产物大小
1.6 疫苗的制备
取500 mL灭活的羊口疮细胞毒液(用0.4%甲醛37 ℃灭活48 h,4 ℃保存,灭活病毒接种于羊睾丸细胞上观察3~5 d无病变)和经超声波破碎的500 mL灭活的羊口疮细胞毒液,分别装入透析袋内,包埋于PEG-6000浓缩至100 mL[5]。按照佐剂说明书比例,将浓缩后的病毒液分别与弗氏佐剂、201 VG、1313 N PR VG、GEL01、ISA 11R VG佐剂用研钵混合均匀;称取病羊痂皮1 g,加入10 mL Hanks液研磨后冻融3次,离心后取上清,用甲醛同上述方法灭活后,与201 VG混合均匀。以上疫苗4 ℃保存备用。
1.7 动物免疫
用1.6制备的11种疫苗免疫兔子,每种疫苗免疫2只,共22只,空白对照4只。分群饲养,每间隔14~15 d免疫1次,共3次。免疫途径为背部皮下分点注射和腹股沟皮下注射。免疫剂量为1 mL/只。其中弗氏佐剂组的一免为完全弗氏佐剂,二免为不完全弗氏佐剂,三免不加佐剂[6]。
1.8 血清抗体检测
1.8.1 琼脂板的制作。用0.15 mol/L PBS (pH7.2)配制1.0%琼脂,制作厚度0.3~0.4 mm的平皿,待琼脂凝固后打梅花孔,孔径3~5 mm,孔间距4~7 mm,用针头挑出孔内琼脂,火焰封底,4 ℃备用[7]。
1.8.2 琼脂免疫扩散试验。免疫后每隔7 d,从兔子耳缘静脉采血后分离血清;在制作好的琼脂板中央孔,用移液枪加灭活羊口疮病毒液60 μL,在周围孔加倍比稀释血清60 μL,每个稀释度加一孔;加样完毕后,将琼脂板放入湿盒内,置37 ℃中扩散24~36 h后,观察结果并记录。
1.9 细胞因子检测
1.9.1 兔外周血淋巴细胞的分离。三免后10 d,从兔子耳缘静脉采血2 mL(加肝素抗凝),加入淋巴细胞分离液混合,分离出淋巴细胞。
1.9.2 RNA提取与反转录。按照RNAiso Plus说明书提取淋巴细胞总RNA,并将总RNA按照PrimeScriptTMRT reagent Kit with gDNA Eraser说明书反转录为cDNA,-20 ℃保存,用于常规PCR和荧光定量PCR。
1.9.3 普通PCR检测细胞因子表达。以上述提取的cDNA为模板,用2×EasyTaq SuperMix试剂盒配制25 μL普通PCR反应体系:2×EasyTaq SuperMix 12.5 μL、上游引物(10 μM)1 μL、下游引物(10 μM)1 μL、cDNA模板1 μL、ddH2O 9.5 μL。PCR扩增反应条件为:95 ℃预变性5 min;95 ℃变性30 s;59 ℃退火45 s;72 ℃延伸30 s;72 ℃延伸10 min。取5 μL上述PCR产物在3%琼脂糖凝胶上电泳,电压110 V,时间30 min,电泳结束后用紫外凝胶成像系统鉴定、拍照。
1.9.4 细胞因子荧光定量PCR及溶解曲线的绘制。20 μL PCR反应体系为:2×SYBR Premix Ex Taq 10 μL、上游引物(10 μM)0.5 μL、下游引物(10 μM)0.5 μL、cDNA模板2 μL、ddH2O 7 μL。 根据引物退火温度,确定荧光定量PCR反应条件为:95 ℃ 30 s,95 ℃ 10 s,59 ℃ 30 s,72 ℃ 10 s,40个循环;在72 ℃反应时采集荧光光信号;然后采用60 ℃至95 ℃,以0.5 ℃为一个单位,6 s采集巧光信号,绘制烙解曲线[8-9]。
2 结果
2.1 琼扩试验结果
琼扩试验结果显示,三免10 d后,血清中抗体效价除了“1313VG+未破碎病毒”组为1:8之外,其余组别均达到1:16,“GEL01+未破碎病毒”组达到 1:32。三免后“弗氏佐剂+破碎病毒”组琼扩试验样品效价见图1。

图1 琼扩试验结果
2.2 细胞因子的普通PCR扩增和荧光定量PCR扩增结果
普通PCR结果显示,检测的所有细胞因子(包括β-actin、IL-2、IL-4、IL-6、IFN-ɣ、TNF-α)样品均可扩增出特异性目的条带,大小分别在150~200 bp、100~150 bp、100~150 bp、100~150 bp、100~150 bp、100~150 bp之间,分别与预期大小(分别为185 bp、118 bp、128 bp、107 bp、121 bp、107 bp)相符,表明以上6种细胞因子均已表达。普通PCR结果见图2,细胞因子荧光定量PCR扩增结果见图3。
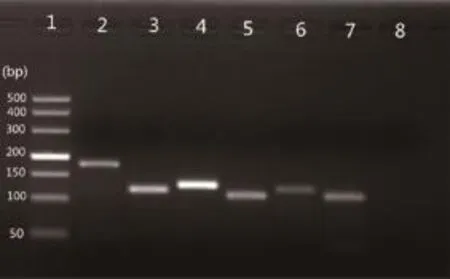
图2 各细胞因子普通PCR扩增结果
图3 细胞因子荧光定量PCR扩增结果
2.3 荧光定量PCR检测兔子外周血中各种细胞因子表达量变化结果
用所配制的疫苗在第3次免疫结束10 d后,使用荧光定量PCR方法,检测外周血中IL-2、IL-4、IL-6、 IFN-ɣ及TNF-α的表达。将所有细胞因子使用荧光定量PCR所得的Ct值与内参基因β-actin使用荧光定量PCR检测所得的Ct值进行比较,最终得到外周血液中IL-2、IL-4、IL-6、IFN-ɣ及TNF-α的表达量变化,纵坐标为2-△△Ct值,所得数据使用SPASS 17.0进行显著性分析[10],结果如下:
2.4.1 免疫后兔子外周血中IL-2表达量变化结果。由图4可知,各组别免疫后外周血中IL-2表达量都高于对照组。软件分析后得到“弗氏+破碎病毒”组、“弗氏+未破碎病毒”组、“201VG+未破碎病毒”组、“201VG+破碎病毒”组、“GEL01+破碎病毒”组分别与对照组相比差异显著(P<0.05),其他组别差异不显著。
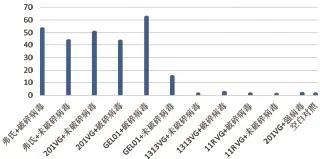
图4 兔子外周血中IL-2表达量变化结果
2.4.2 免疫后兔子外周血中IL-4表达量变化结果。由图5可知,各组别免疫后外周血中只有“GEL01+破碎病毒”组中的IL-4表达量上升,与对照组相比差异显著(P<0.05);其他组中的IL-4表达量都低于对照组,与对照组相比差异不显著(P>0.05)。
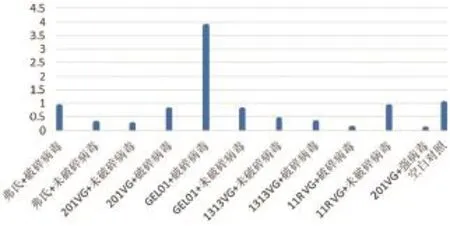
图5 兔子外周血中IL-4表达量变化结果
2.4.3 免疫后兔子外周血中IL-6表达量变化结果。由图6可知,各组别免疫后外周血中IL-6表达量都低于对照组,各组别与对照组相比无显著差异(P>0.05)。
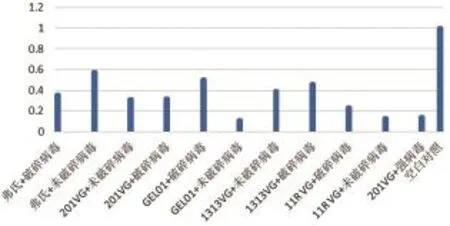
图6 兔子外周血中IL-6表达量变化结果
2.4.4 免疫后兔子外周血中IFN-ɣ表达量变化结果。由图7可知,各组别免疫后外周血中IFN-ɣ表达量都高于对照组,“GEL01+破碎病毒”组与对照组相比差异显著(P<0.05)。
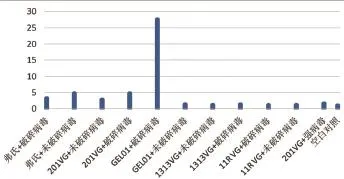
图7 兔子外周血中IFN-ɣ表达量变化结果
2.4.5 免疫后兔子外周血中TNF-α表达量变化结果。由图8可知,各组别免疫后外周血中TNF-α表达量都高于对照组。经过SPASS软件分析后得到“弗氏+破碎病毒”组、“201VG+未破碎病毒”组、“GEL01+未破碎病毒”组、“1313VG+破碎病毒”组分别与对照组差异显著(P<0.05),其他组别与对照组无显著差异(P>0.05)。
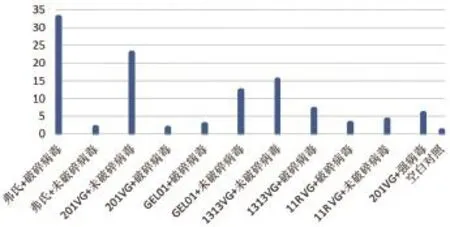
图8 兔子外周血中TNF-α表达量变化结果
3 讨论
本研究发现,兔子在接种羊口疮病毒后70 d内,其血清中特异性抗体效价不断上升。并且在三免10 d后使用琼扩试验检测特异性抗体效价,发现整体上效价可达到1:16,与鲜思美等[5]的研究结果一致:不同疫苗产生抗体的时间可能不同,产生的抗体水平也不一样,但整体呈现上升趋势,表明羊口疮疫苗可以很好地诱导机体产生体液免疫。本研究中,在实验设计之初,为了研究是否由病毒囊膜内部的某些物质诱导机体产生特异性抗体,将疫苗分为超声波破碎组和未进行超声波破碎组。最终琼扩结果显示,各组别均诱导机体产生良好的体液免疫,推断羊口疮特异性抗体是由羊口疮病毒囊膜表面某种蛋白诱导产生的。
IL-2、TNF-α、IFN-ɣ与Th1类细胞发育与分化有关。它们可以促进机体产生细胞免疫应答,在抗病毒过程中发挥着十分重要的作用。Th2型细胞因子主要有IL-4、IL-6,而Th2类细胞主要介导体液免疫[11]。研究中,在三免10 d后,使用实时荧光定量PCR仪检测这几类细胞因子的表达水平。结果显示,各类疫苗组的IL-2、IFN-ɣ、TNF-α表达水平有差异,但与对照组相比均呈上升趋势,而且个别疫苗组和对照组差异显著。除了“GEL01+破碎病毒”组中IL-4表达和对照组相比差异显著,呈现升高状态外,其他各类疫苗组的IL-4表达量均低于对照组,无显著差异。各类疫苗组的IL-6表达量均低于对照组,但没有显著差异。因此认为羊口疮疫苗诱导机体产生了细胞免疫,这与张冰冰等[12]的研究结果相似。免疫后期的Th1类细胞因子上升,Th2类细胞因子下降,可能是因为羊口疮疫苗接种动物以后,会诱导Th1型免疫应答,而抑制Th2型免疫应答,这与国内外的一些相关报道一致[11]。由于灭活疫苗主要诱导体液免疫,因此本研究在赛彼科公司的推荐下,选择了这几种可以提高机体细胞免疫应答的佐剂,可能Th1型细胞因子表达量上升明显和佐剂的选择也有一定的关系。根据荧光定量结果可以看出,“GEL01+破碎病毒”组诱导细胞免疫效果最好,但是IL-4表达和对照相比却呈现升高状态,其具体原因需要进一步研究。
本研究也存在一些不足,例如荧光定量检测的时机可能不是最佳时间段,未做纵向对比。对研究羊口疮疫苗的免疫机制来说,研究羊口疮病毒的免疫逃避机制也很重要。vIL-10是多功能因子,主要表现为阻止一系列刺激免疫反应的细胞因子合成,如巨噬细胞分泌的TNF-α和IL-8,淋巴细胞分泌的IFN-ɣ;GIF主要抑制粒细胞巨噬细胞集落刺激因子和IL-2 来发挥其作用[13-14]。因而,如果在一免后的不同时间节点,采集样品,检测细胞因子的表达量,尤其分析IL-2、IFN-ɣ、TNF-α的变化趋势,则可以揭示免疫逃避机制和细胞免疫应答机制。在荧光定量PCR检测的重复性方面也需要进行研究和摸索,进行更多的重复性试验,这样将使研究数据更加可靠。
综上所述,羊口疮疫苗在免疫后期,既可以诱导体液免疫应答产生特异性抗体,也可以诱导机体产生细胞免疫应答,改变相关细胞因子的表达量。但是,这两种免疫应答机制如何通过抗体和细胞因子相互作用和影响尚不得而知,需要进一步研究。
[1] 李旭东. 羊传染性脓疱实时荧光定量PCR方法的建立[D]. 呼和浩特:内蒙古农业大学,2015.
[2] 林裕胜,江锦秀,胡奇林,等. 羊传染性脓疱病毒研究进展[J]. 动物医学进展,2016,37(2):91-96.
[3] 韩猛立. 牛IFN-α、IFN-β及IFN-ɣmRNA实时SYBR Green Ⅰ定量 RT-PCR检测方法的建立及应用[J]. 中国预防兽医学报,2010,32(10):762-767.
[4] 李金明. 实时荧光PCR技术[M]. 北京:人民军医出版社,2011,4-5.
[5] 鲜思美. 琼脂扩散试验检测羊口疮病毒[J]. 中国兽医杂志,2014,50(8):23-25.
[6] 高晶晖. 羊口疮病毒威海株和昆明株的分离鉴定及毒力致弱研究[D]. 杨凌:西北农林科技大学,2014.
[7] 郭鑫. 动物免疫学实验教程[M]. 北京:中国农业大学出版社,2007:71-74.
[8] 苏日娜. 实时荧光定量PCR检测小鼠肠道乳酸菌及细胞因子含量的研究[D]. 呼和浩特:内蒙古农业大学,2015.
[9] Wang G,Shang Y,Wang Y,et al. Comparison of a loopmediated isothermal amplifi cation for virus with quantitative realtime PCR[J]. Virology Journal,2013,10(1):1-8. DOI:10.1186/1743-422X-10-138.
[10] Yip S P,Lee S Y,To S S,et al. Improved real-time PCR assay for homogeneous multiplex genotyping of four CYP2C9 alleles with hybridization probes[J]. Clin Chem,2003,49:2109.
[11] 武月章,安潇潇,张文慧,等. BCG免疫对小鼠血清特异性抗体和脾脏免疫相关细胞因子表达的影响[J]. 吉林农业大学学报,2015,37(6):726-730.
[12] 张冰冰. 羊传染性脓疱病毒感染羔羊细胞免疫应答变化规律的研究[D]. 长春:吉林大学,2011.
[13] 张瑜. 羊口疮病毒杨凌株和泸西株的分离鉴定及毒力致弱研[D]. 杨凌:西北农林科技大学,2014.
[14] 杨雯昱.羊口疮病程中Th17细胞相关细胞因子的变化[D]. 杨凌:西北农林科技大学,2015.
(责任编辑:朱迪国)
The Infl uence of Sheep Ecthyma Vaccine on Humoral Immune Response and Cellular Immune Response of Rabbits
Li Zhi,Zhang Qijin,An Weixue,Tu Mingliang,Zhang Zhidan,Li Na,Zhong Liang
(College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot,Inner Mongolia 010018)
In order to better understand the molecular mechanism of immune response induced by sheep ecthyma vaccine,the level of specifi c antibodies in serum and expression of related cytokines in peripheral blood of rabbits immunized with sheep ecthyma vaccine were detected. 500 mL inactivated sheep ecthyma virus-infected cell suspensions were condensed into 100 mL,as well as another 500 mL suspensions with ultrasonic fragmentation treatment. Then the two portions of concentrated solutions were respectively mixed with Freund's adjuvant,201 VG,1313 VG,GEL01 and 11R VG to prepare different vaccines. In addition,10 mL inactivated sheep ecthyma crust venom was also used to generate vaccine by being mixed with 201 VG. Each kind of vaccine was applied to immunize two rabbits,and then blood samples were collected at different time to detect the level of specifi c antibodies in serum by agar immunodiffusion assay and the expression of cytokines in peripheral blood by real-time fl uorescence quantitative PCR. The results showed that the serum antibody titer all reached 1:16 or 1:32 in later period of immunization except the vaccine“1313VG+inactivated virus-infected cell suspensions”,antibody titer of which was 1:8. Interestingly,the expression quantity of Th1 cytokines(IL-2,IFN-ɣ and TNF-α)in peripheral blood of all experimented rabbits increased in comparison with the control group. By contrast,the expression of Th2 cytokines(IL-4,IL-6)decreased. In conclusion,both humoral immune response and cellular immune response of rabbits were induced by sheep ecthyma vaccines prepared,and the changes of the two kinds of immune responses varied.
sheep ecthyma vaccine;humoral immune response;cellular immune response;specific antibody;cytokine;adjuvant
852.23
B
1005-944X(2016)11-0089-06
10.3969/j.issn.1005-944X.2016.11.024
张七斤
